非酮症高血糖性偏侧舞蹈症3 例临床分析
2014-03-11董斌春李文玉宋春伶
王 路,董斌春,李文玉,宋春伶
非酮症性高血糖性偏侧舞蹈症是一种临床少见的特殊的综合征,典型表现为三联征:非酮症性高血糖、舞蹈症(偏侧或双侧)及头部MRI T1加权像纹状体区高信号[1,2],其具体发病机制尚未充分阐明。本文回顾性分析吉林大学第二医院神经内科自2010 年7 月~2014 年2 月收治的诊断为该病的3 例患者的临床资料,现分析如下。
1 临床资料
病例1,女性,60 岁,因左侧肢体不自主抖动14 d 于2010年7 月30 日入院。既往:“糖尿病”病史13 y,未治疗;“高血压病”病史10 余年,未规律治疗。否认心脏病病史、一氧化碳中毒史、药物毒物接触史、脑血管病病史、药物及食物过敏史。否认相关疾病家族史。入院查体:左侧肢体可见舞蹈样动作,表现为不规律的伸臂、伸腿、手臂摆动,余神经系统未见异常体征。入院查头部MRI:右侧基底节区见少许条状稍短T1信号(见图1)。查头部CT:右侧基底节区可见片状稍高密度影(见图2)。入院后空腹血糖18.73 mmol/L,糖化血红蛋白:14.8%,尿常规:酮体-。诊断为非酮症高血糖性偏侧舞蹈症,应用胰岛素治疗联合口服降糖药物治疗,同时给予氟哌啶醇2 mg 3 次/d 口服。住院期间监测血糖显示:空腹血糖6.3~9.7 mmol/L 之间,餐后血糖波动在9.5~12.7 mmol/L之间。患者左侧肢体偶有不自主活动,偶有手指伸屈动作,无明显大的舞蹈样动作。1 m 后随访,患者随机血糖均控制在10.0 mmol/L 以下,左侧肢体偶有轻微不自主抖动,复查头部MRI:右侧基底节区见片状稍短T1信号,与入院时相比范围明显变小(见图2)。
病例2,女性,61 岁,因左侧肢体不自主抖动10 d 于2012年5 月30 日入院。既往:“高血压”病史5 y,最高时220/110 mmHg,间断服用硝苯地平、利血平等药物,血压控制在150~160/80~100 mmHg 之间。否认糖尿病病史。入院查体:左侧肢体可见舞蹈样动作,左侧肢体肌张力减低,余神经系统无异常体征。头部CT:右侧基底节区片状稍高密度影。入院后空腹血糖19mmol/L,餐后2 h 血糖32.32 mmol/L。尿常规:酮体-。诊断为非酮症高血糖性偏侧舞蹈症,给予胰岛素系统调整血糖,同时给予硫必利口服。患者入院后不控制饮食,监测血糖显示:空腹血糖波动在10~16 mmol/L,餐后2 h 血压波动在19~22 mmol/L 之间,左侧肢体不自主活动改善不明显。后经糖尿病教育,严格控制饮食,同时将硫必利改为氟哌啶醇2 mg 3 次/d 口服。患者入院6 d,空腹血糖8~9.6 mmol/L,餐后2 h 血糖5.1~14 mmol/L,左侧肢体不自主活动明显减轻。
病例3,女性,74 岁,因双侧上肢不自主抖动4 d 于2014年2 月18 日入院。既往:“2 型糖尿病”4 y,未治疗;“高血压病”10 y,(用药名称、方法、剂量不详),血压最高160/100 mmHg,未监测血压变化。“心脏病”史10 y,心肌梗死病史5 y,未规律治疗;“脑梗死”5 y,未规律治疗。“上呼吸道感染”14 d,经治疗后好转。否认肝炎、结核等传染病病史及其接触史;否认食物及药物过敏史。入院查体:双上肢不规律、无目的的伸臂、抬臂、手臂摆动及手指伸曲运动,伴有面部挤眉弄眼、伸舌,以右侧肢体抖动明显。余神经系统无异常体征。头部CT 影像所见:双侧基底节可见斑点状稍高密度影(见图4、图5)。头部MRI 影像所见:两侧基底节区可见多发斑点状短T1信号(见图6)。入院后测随机血糖30.4 mmol/L,尿常规:酮体-,甲状腺功能正常。诊断为非酮症高血糖性偏侧舞蹈症,给予胰岛素调整血糖,联合达美康30 mg 口服日一次早餐前控制血糖,同时给予氟哌啶醇1 mg 3 次/d 口服。患者入院治疗6 d,空腹血糖8.1~10.1 mmol/L,餐后2 h 血糖13.2~16.9 mmol/L。患者双侧上肢抖动症状完全缓解。
2 讨论
非酮症性高血糖性偏侧舞蹈症多见于亚洲老年女性,提示可能与遗传因素、亚洲国家糖尿病控制不佳及女性对多巴胺的反应性较高有关[1,2]。本研究中的3 例患者均为老年女性,且院前未治疗糖尿病或未发现糖尿病,符合上述特点。
该病发病机制目前尚不清楚。目前一些研究认为,患者的舞蹈症状与基底节区慢性缺血导致基底节区慢性功能障碍有关[3],高血糖患者由于微血管病变基底节区存在慢性缺血,但尚未发生梗死,当发生高血糖时,血脑屏障受到破坏,导致细胞内酸中毒和代谢紊乱,局部脑血流量减少及糖代谢衰竭,三羧酸循环受到抑制,而脑细胞以γ-氨基丁酸为能量来源,酮症患者有乙酰乙酸作为再合成γ-氨基丁酸的物质,而非酮症高血糖患者的γ-氨基丁酸将被很快耗竭,而多巴胺功能相对增强,导致基底节纹状区正常功能受到损害,从而发病[4]。而绝经后女性雌激素水平降低,使多巴胺受体敏感性增强,在某些情况下被激活并且功能亢进而致病[5]。Abe Y[1]对患者MR 波谱分析显示,病灶处的肌醇峰降低,提示病变处山梨醇途径受损,而这也是糖尿病视网膜病变及神经病变的病理生理学机制之一,考虑非酮症高血糖性偏侧舞蹈症的发病与代谢紊乱有关。也有的研究认为,炎症反应可能参与了该病的发生与发展。Wang 等[6]报道3 例该病于发病前几天有感染病史,脑脊液检查显示,免疫球蛋白IgG 水平增高,IgG 水平或24 h 鞘内合成率增高,提示舞蹈症状可能与中枢神经系统炎症反应有关。Ahlskog[7]报道1 例患者的抗谷氨酸脱羧酶(GAD)-65 滴度增高,这是一种γ-氨基丁酸能神经元的标记物,结果显示在纹状区含量丰富,而影像学结果显示病变多选择性累及尾状核头部、苍白球及壳核,而内囊前肢不受累。这些表明,对基底节神经元的自身免疫炎症反应过程可能参与该病发病。Starr 等[8]报道,通过磁共振成像可检测到2 型糖尿病患者血脑屏障通透性增加。可以推测,糖尿病患者可能由于血脑屏障通透性增加,并且基底神经节容易被抗GAD-65 抗体或其他自身免疫性抗体攻击而发病。本研究中1 例患者发病前有明确上呼吸道感染病史,符合上述报道,但未能进行相关检查来明确这一观点。也许非酮症高血糖性偏侧舞蹈症是由多重因素相互作用造成基底节区受损而致病,该病具体发病机制尚有待进一步研究证实。
非酮症高血糖性偏侧舞蹈症的主要影像学表现为头部CT 可见基底节区高密度影,头部MRI 可见基底节区短T1信号,本研究中3 例患者均符合上述特点。曾有研究认为影像学变化为病变部位微血管出血所致[9]。Mittal[10]的研究则通过磁敏感加权成像否定了基底节区出血的可能。本研究中头部CT 与一般血肿明显不同,未累及邻近内囊等结构,无明显占位和水肿效应,不符合血管走形分布。目前的研究多倾向于离子沉积所致。郝丽君等[4]研究随访患者1 m 后复查头部CT 显示基底节区高密度影可完全消失,呈等密度影,可除外钙化可能。唐乐梅等[11]研究随访6 例显示T1WI 高信号于短期内消失,提示高密度或信号为可逆性病变,非钙盐沉积所致。本研究中有1 例患者发病1 m 后复查头部MRI显示右侧基底节区片状稍短T1信号影范围较入院时明显变小,不支持钙盐沉积。Fujioka 等[12]通过大鼠动物实验,推测T1加权信号增高与锰的蓄积有关。Ondo[13]认为T1WI 高信号的原因在于锌沉积,而非钙沉积。Cherian 等[14]研究报道,病变部位病理改变为选择性神经元丢失、神经胶质细胞代偿性增生以及星形胶质细胞明显增多,且未见含铁血黄素沉着;将T1WI 高信号解释为急性缺血导致脑组织损害后肥胖型星形细胞内的蛋白质水合层的作用,这些星形细胞表达亲锌金属蛋白,致使壳核后部信号非对称性减低。Mittal 等[10]报道:SWI 显示双侧壳核区对称性低信号,提示为顺磁性物质沉积,考虑脑缺血伴随星形细胞反应性代偿肥大以及矿物质沉积可能为主要病因。
非酮症高血糖性偏侧舞蹈症的患者如症状较轻微,仅通过控制血糖患者症状就可以改善,但应避免降糖过快,同时积极补液,纠正电解质紊乱[15]。如舞蹈症状严重,需加用多巴胺受体拮抗剂,临床上常用氟哌啶醇、硫必利、氯丙嗪、奋乃静等,通过减少对基底神经节间接通路的抑制作用来控制舞蹈症状[1,2]。本研究中均应用胰岛素联合多巴胺受体拮抗剂治疗,治疗后患者症状缓解,随访未复发。总之,虽然非酮症高血糖性偏侧舞蹈症的发病机制尚不清楚,但是糖尿病微血管病变、代谢紊乱及炎症反应可能发挥重要作用。经过早期诊断,合理治疗,多数患者预后较好。
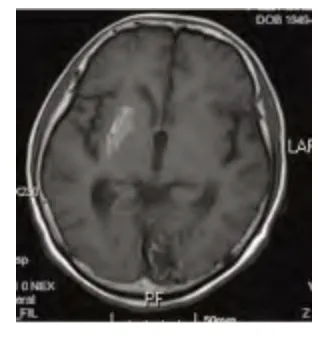
图1 病例1 入院时头部MRI 显示右侧基底节区见少许条状稍短T1信号
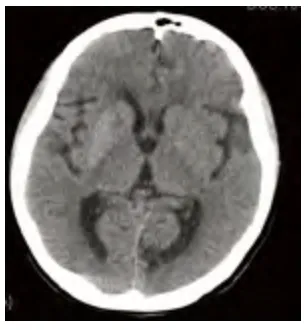
图2 病例1 入院时头部CT 显示右侧基底节区可见片状稍高密度影

图3 病例1 在1 m后复查头部MRI 右侧基底节区见片状稍短T1信号,与入院时相比范围明显变小
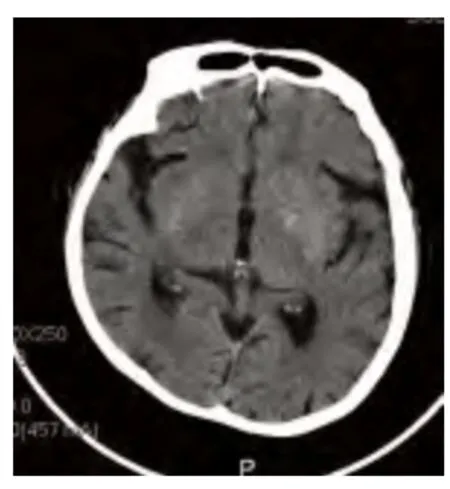
图4 病例3 入院时头部CT 影像显示双侧基底节可见斑点状稍高密度影
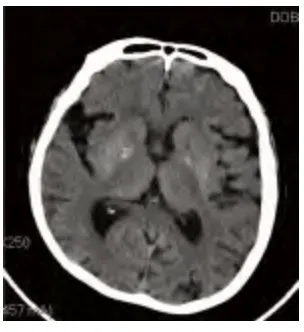
图5 病例3 入院时头部CT 影像显示双侧基底节可见斑点状稍高密度影

图6 病例3 入院时头部MRI 影像显示两侧基底节区可见多发斑点状短T1信号
[1]Abe Y,Yamamoto T,Soeda T,et al.Diabetic striatal disease:clinical presentation,neuroimaging,and pathology[J].Intern Med,2009,48(13):1135-1141.
[2]Lee SH,Shin JA,Kim JH,et al.Chorea-ballism associated with nonketotic hyperglycaemia or diabetic ketoacidosis:Characteristics of 25 patients in Korea[J].Diabetes Res Clin Pract,2011,93(2):e80-83.
[3]Chang KH,Tsou JC,Chen ST,et al.Temporal features of magnetic resonance imaging and spectroscopy in non-ketotic hyperglycemic chorea-ballism patients[J].Eur J Neurol,2010,17(4):589-593.
[4]郝丽君,杜艳芬,杨同良,等.非酮症性高血糖合并舞蹈症13 例临床及神经影像学分析[J].天津医药,2013,7:725-727.
[5]Narayanan S.Hyperglycemia-induced hemiballismus hemichorea:A case report and brief review of the literature[J].The Journal of Emergency Medicine,2012,43(3):442-444.
[6]Wang JH,Wu T,Deng BQ,et al.Hemichorea-hemiballismus associated with nonketotic hyperglycemia:A possible role of inflammation[J].Journal of the Neurological Sciences,2009,284:198-202.
[7]Eric AJ,Hiroshi N,Evidente VGH,et al.Persistent chorea triggered by hyperglycemic crisis in diabetics[J].Mov Disord,2001,16:890-898.
[8]Starr JM,Wardlaw J,Ferguson K,et al.Increased blood-brain barrier permeability in type II diabetes demonstrated by gadolinium magnetic resonance imaging[J].J Neurol Neurosurg Psychiatry,2003,74:70-76.
[9]Pisani A,Diomedi M,Rum A,et al.Acanthocytosis as a predisposing factor for non-ketotic hyperglycasmia induced chorea-ballism[J].J Neurosurg Psychiatry,2005,76:1717-1719.
[10]Mittal P.Hemichorea-hemiballism syndrome.A look through susceptibility weighted imaging[J].Ann Indian Acad Neurol,2011,14(2):124-126.
[11]唐乐梅,苗延巍,郑程程,等.非酮症高血糖偏身舞蹈症的颅脑CT 及MRI 表现[J].中国医学影像技术,2012,28(10):1793-1796.
[12]Fujioka M,Taoka T,Matsuo Y,et al.Magnetic resonance imaging shows delayed ischemic striatal neurodegeneration[J].Ann Neurol,2003,54(6):732-735.
[13]Ondo WG.Hyperglycemic nonketotic states and other metabolic imbalances[J].Handb ClinNeurol,2011,100:287-291.
[14]Cherian A,Thomas B,Baheti NN,et al.Concepts and controversiesin nonketotic hyperglycemia-induces hemichorea:Further evidence from susceptibility-weighted MR imaging[J].J Magn Reson Imaging,2009,29(3):699-703.
[15]王 莹,孙大勇,王迎新,等.非酮症高血糖性舞蹈病16 例临床及影像学分析[J].山东医药,2012,52(36):82-85.
