氧化多壁碳纳米管对水中钠离子的吸附研究*
2014-03-09刘维慧
陈 龙 张 静 刘维慧 李 春 元 光
(中国海洋大学 信息科学与工程学院 青岛 266100)
碱金属材料,特别是锂,是社会生产和人民生活必需的重要材料。随着人类对锂需求的不断扩大,陆地上的锂资源已经远远不能满足人类的需求。海水中锂资源储量极其丰富,是陆地储量的一万余倍,目前吸附法被认为是提取锂离子的有效方法之一(Mohammadiet al,2003;Sadrzadehet al,2008;Hadadinet al,2010)。但是海水中锂离子浓度远远低于钠离子的浓度,并且两者的化学性质十分相似,钠离子严重妨碍了对锂的提取。因此,利用吸附法提取锂元素时,首先需要考察锂的吸附剂材料对钠离子的吸附特性。本文旨在研究碳纳米管对钠离子的吸附特性,从而为进一步研究利用碳纳米管提取海水中的锂元素奠定基础。
碳纳米管具有独特的中空管状结构,具有大的比表面积和高的化学稳定性等优点(Iijima,1991),使其在很多领域具有广阔的应用前景,如:场发射体(Der Heeret al,1995)、储氢材料(Dillonet al,1997)、微电子元件(Collinset al,1997)、催化剂载体(Planeixet al,1994)和吸附剂材料(Liet al,2003a;Bienfaitet al,2004;Pyrzynska,2008),并且国内外对其吸附特性已经进行了研究(Liet al,2003b;Bienfaitet al,2004;Pyrzynska,2008)。近年来碳纳米管对水溶液中金属离子的吸附特性研究已经取得了一定的进展(Luet al,2006a,b,c;Stafiejet al,2008),并且发现碳纳米管对离子的吸附程度依赖于碳纳米管的氧化过程、溶液温度、pH等因素(Kuo,2009)。
但目前有关碳纳米管吸附水中钠离子的研究不多。Kuo等(2009)采用硫酸与高锰酸钾混合液处理碳纳米管对镉离子进行吸附研究,实验结果表明随着温度及 pH的增加,纯化的碳纳米管对镉离子的吸附量相应增加。当然碳纳米管的处理方法对碳纳米管的吸附特性具有重要影响,一般采用强酸如硝酸、硫酸与硝酸混合液、硫酸与高锰酸钾混合液对碳纳米管进行纯化处理,从而达到去除碳纳米管中的金属和碳杂质的效果(Monthiouxet al,2001;Montoroet al,2006)。国内学者方建慧等(2006)制备了基于碳纳米管的电极,并将其用于液流式电吸附脱盐,获得了较高的脱盐效率。
本文采用 H2SO4/HNO3混酸对多壁碳纳米管进行强酸处理,考察了温度、初始浓度、吸附时间对钠离子吸附的影响,探讨多壁碳纳米管吸附钠离子的机理。
1 材料与方法
1.1 多壁碳纳米管的强酸氧化过程
将3g多壁碳纳米管(MWCNTs,南京吉仓纳米科技有限公司)浸入80mL体积比为3︰1的硫酸与硝酸混合液中,超声处理30min,然后静置24h,再用大量去离子水清洗多壁碳纳米管(MWCNTs),直至滤液的pH值不再变化,最后在110°C下干燥,直到质量不再发生变化。
1.2 钠离子的吸附及测定
在50mL浓度为5000、10000、25000、30000、50000mg/L的氯化钠水溶液中(即钠离子浓度为:2028.13、3764、10086.17、12140.92、19547.42mg/L),分别放入0.4g经过强酸氧化与未氧化的多壁碳纳米管,超声分散30min,在不同温度下(274K、277K、282K、288K、298K、310K、320K、330K、340K)吸附若干小时,直到溶液的电导率不再发生变化,再测量水溶液的电导率值,从而间接求出钠离子对应的浓度。
单位质量的多壁碳纳米管对钠离子的吸附量由公式(1)计算:

其中,qe:平衡吸附量(mg/g);C0:初始钠离子浓度(mg/L);Ce:平衡钠离子浓度(mg/L);W:吸附剂(多壁碳纳米管)质量;V:溶液体积(L)
本实验的整个过程中利用电导率仪(上海雷磁DDSJ-308A)测量水溶液钠离子的浓度。电导率仪校准曲线如图1所示(即水溶液中钠离子浓度与溶液电导率的关系)。
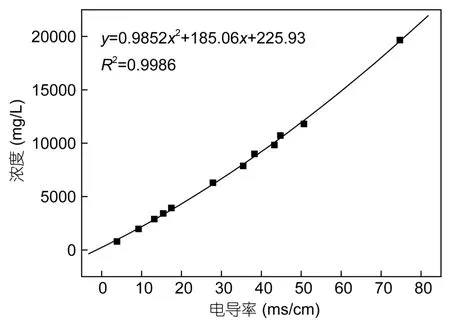
图1 电导率仪校准曲线Fig.1 Calibration curve of the conductometer
2 结果与讨论
2.1 多壁碳纳米管(MWCNTs)的表征
2.1.1 氧化前后MWCNTs的扫描电镜图 图2为多壁碳纳米管强酸氧化前(图2a)、后(图2b)的扫描电镜图。如图2a所示,未经过H2SO4/HNO3强酸氧化的MWCNTs存在严重的团聚现象,并且表面含有杂质;经强酸氧化后如图2b所示,MWCNTs开始变得松散,并且表面比较光洁,有较多的管出现,即多壁碳纳米管比较分散。
2.1.2 氧化前后MWCNTs的红外光谱图 图3为强酸氧化前后多壁碳纳米管的红外吸收谱。强酸氧化后的多壁碳纳米管除了在 1450—1600/cm 左右有碳-碳双键的振动之外,1700—1740/cm 左右的吸收峰表明有羰基(-C=O)存在(Daviset al,1999),2800—3100/cm左右的吸收峰表明有次甲基(-CH)存在(Daviset al,1999;Yanget al,2006),3200—3400/cm左右的吸收峰表明有羟基(-OH)存在(Daviset al,1999;Luet al,2005;Yanget al,2006),另外图3中显示在1083/cm、1208/cm、1376/cm处出现了吸收峰,这有可能是多壁碳纳米管表面残留的硫酸根和硝酸根引起的红外吸收。显然,经过强酸氧化后,多壁碳纳米管表面引入了许多含氧官能团(如-OH、-C=O等),这将会增加多壁碳纳米管的亲水性。

图2 多壁碳纳米管氧化前后的扫描电镜图Fig.2 SEM image of as-grown MWCNTs(a) and oxidized MWCNTs(b)
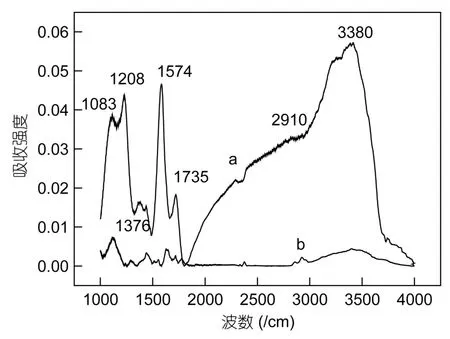
图3 氧化的MWCNTs(a)与未氧化的MWCNTs(b)的红外光谱图Fig.3 FTIR spectra of oxidized MWCNTs(a) and as-grown MWCNTs(b)
2.2 温度对MWCNTs的影响
本文考察了274K—333K时,强酸氧化的MWCNTs对钠离子吸附性能的影响(图4)。研究发现,对同一初始浓度的钠离子而言(无论是高浓度还是低浓度),低温时氧化的多壁碳纳米管对钠离子的吸附量明显高于高温时的吸附量,即温度升高不利于吸附进行。
2.3 初始浓度对MWCNTs的影响
本文研究了不同初始质量浓度的钠离子对强酸氧化的多壁碳纳米管吸附性能的影响,结果如图5所示。在同一温度下,随着钠离子初始浓度的升高,吸附量呈增大趋势。在295K时,钠离子的初始质量浓度达到19547.42mg/L,强酸氧化的 MWCNTs静态平衡吸附量为231.76mg/L。
2.4 吸附时间对MWCNTs的影响
吸附时间的改变也会影响多壁碳纳米管对钠离子的吸附量,如图6所示,温度为274K时,氧化的多壁碳纳米管对不同初始浓度的钠离子的吸附量随着时间的推移逐渐增加,对于钠离子初始浓度为 3764mg/L的溶液,大概需要 5d吸附过程方可达到平衡,对于低浓度盐溶液,如钠离子的初始浓度为 2028.13mg/L时,达到吸附平衡仅需 50h,因此低浓度的盐溶液将会更快达到吸附平衡。

图4 温度对钠离子吸附的影响Fig.4 Influence of temperature on adsorption of Na+
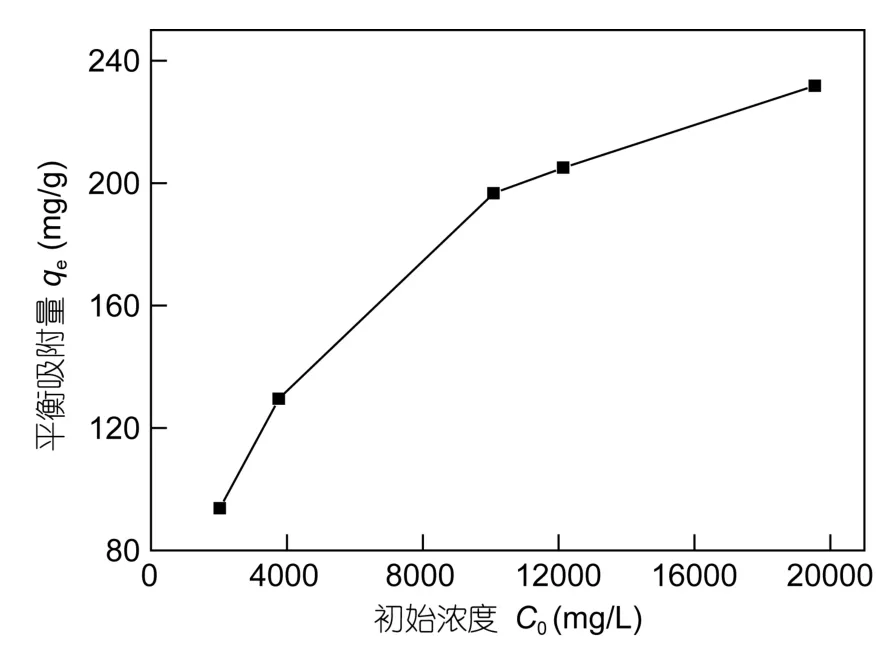
图5 295K下不同初始质量浓度的Na+对吸附的影响Fig.5 Influence of initial Na+ mass concentration on adsorption of Na+, at 295K
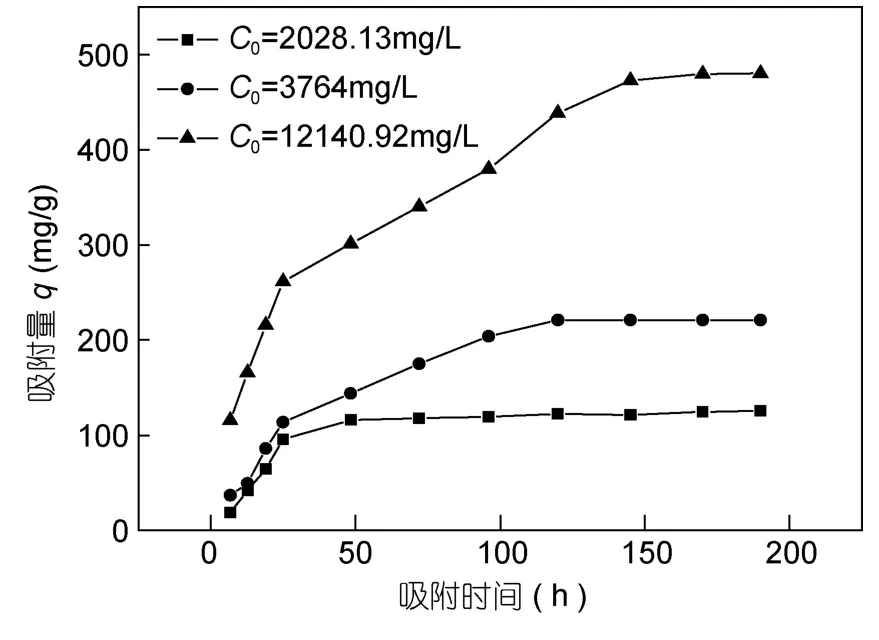
图6 吸附时间对Na+吸附的影响Fig.6 Influence of adsorption time on adsorption of Na+
2.5 等温吸附模型研究
对于给定浓度的溶液而言,吸附量是一个重要参数,因为它决定了多少吸附剂在最大程度上能够改变溶液中的成分。
Langmuir与Freundlich等温吸附理论是关于吸附的主要理论。Langmuir等温模型的假设条件为:吸附层是单分子层,吸附质分子间无作用力,且表面均匀。公式(2)即为Langmuir等式:

其中,Ce为钠离子的平衡浓度(mg/L);qmon为单分子层的饱和吸附量(mg/g),kl为与吸附能有关的 Langmuir常数(L/mg)。
Freundlich等温模型是一个半经验的多层吸附理论,该模型对于那些具有吸附极限大的吸附剂适用,该模型的表达如公式(3):
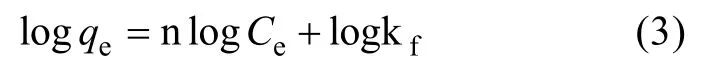
其中,qe为钠离子平衡吸附量(mg/g);Ce为钠离子平衡浓度(mg/L),kf、n为与吸附能、吸附强度有关的Freundlich常数。
图7为不同温度下(274K、277K、282K、288K、295K、303K、313K、332K、333K)强酸处理的多壁碳纳米管对钠离子的Langmuir、Freundlich吸附等温线。拟合参数如表1所示。结果表明,强酸处理的多壁碳纳米管在不同温度下对钠离子的吸附等温线基本与Langmuir方程吻合,相关系数见表1。由表1可知,随着温度的升高,1/qmon逐渐升高,即饱和吸附量(qmon)逐渐降低,说明温度升高可以导致多壁碳纳米管的吸附能力降低。
综合图7及表1所示,强酸处理的多壁碳纳米管对钠离子的吸附等温线与Freundlich也基本吻合,特别是在较高的温度下,更符合Freundlich吸附模型。随着温度的升高,参数n基本保持不变,但是kf呈现降低趋势,反映了多壁碳纳米管吸附能力的降低。kf虽然不能代表最大吸附量,但是其值大小可以作为吸附容量的指标(徐丛等,2009)。

图7 274k—333k 氧化 MWCNTs的 Langmuir(a)、Freundlich(b)吸附等温线Fig.7 Langmuir(a) and Freundlich(b) adsorption isotherm of the oxidized MWCNTs at 274—333K

表1 295k—333k下Langmuir、Freundlich等温模型的相关参数Tab.1 Coefficients of Langmuir and Freundlich isotherm at 295—333K
2.6 吸附热力学研究
利用 Langmuir吸附平衡常数及范特霍夫等温方程(公式(5)),可以进一步计算多壁碳纳米管吸附钠离子的热力学参数。标准自由能变(ΔG0)、标准焓变(ΔH0)、标准熵变(ΔS0)与 Langmuir吸附平衡常数有关:
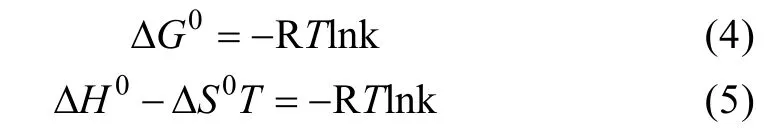
其中,k为Langmuir吸附平衡常数(L/mol);R为常数(8.314×10−3KJ/molK),T为绝对温度(K),ΔH0与ΔS0可以通过范特霍夫等温方程函数的斜率与截距间接求出。
图8即为范特霍夫等温线(ΔH0与ΔS0通过该图可以间接求出),相应的拟合参数如表2所示。一般认为,物理吸附的化学反应焓变ΔH小于40KJ/mol(Karaet al,2003)或者 ΔH0在 20.9—418.4KJ/mol时为化学吸附(Unluet al,2006)。本实验中 ΔH0为-9.3KJ/mol,表明了硫酸/硝酸强酸处理的多壁碳纳米管对钠离子的吸附过程为物理吸附,而且吸附过程为放热过程(ΔH0<0)。本实验中 ΔG0在所有实验温度下都为负,表明多壁碳纳米管对钠离子的吸附过程是自发的。随着温度的升高,ΔG0的绝对值变小,说明吸附过程在低温条件下更加自发进行。
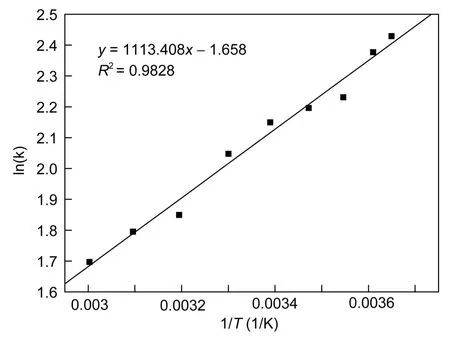
图8 温度对氧化MWCNTs吸附钠的ln(k)的影响Fig.8 Effect of temperature on the distribution coefficients ofNa on the oxidized MWCNTs

表2 不同温度下氧化MWCNTs对钠离子吸附的热力学参数Tab.2 Thermodynamic parameters of MWCNTs at various temperatures
硫酸/硝酸强酸氧化的多壁碳纳米管表面引入了一些含氧官能团(–OH、–C=O等),使得多壁碳纳米管更好地分散于水溶液中,从而增大了多壁碳纳米管的吸附表面积,有利于多壁碳纳米管对钠离子的吸附。在低温时(<280K),多壁碳纳米管吸附钠离子的过程符合Langmuir模型,而在温度较高时(>313K)则更加符合Freundlich模型。多壁碳纳米管吸附钠离子的吸附能小于60meV,并随温度升高而逐渐降低;吸附量的减小可能是由于温度升高加剧了离子的热运动,使得吸附在多壁碳纳米管上的离子脱附之后重新回到溶液中,并且导致多壁碳纳米管对钠离子的吸附转向Freundlich模型。
3 结论
本文通过硫酸/硝酸(H2SO4/HNO3)氧化法改性多壁碳纳米管,研究在不同温度、初始浓度、吸附时间条件下,多壁碳纳米管对钠离子的吸附情况。实验结果表明,强酸氧化过程为多壁碳纳米管表面引入了一些含氧官能团(–OH、–C=O等),从而使得多壁碳纳米管对钠离子的吸附能力显著提高;随着温度的升高,强酸氧化的多壁碳纳米管对钠离子的吸附能力减弱;而随着初始浓度的升高,多壁碳纳米管对离子的吸附量增加;吸附平衡过程需要经过较长的时间;吸附等温线更加符合 Langmuir等温模型;ΔH<0表明,多壁碳纳米管对钠离子的吸附过程是一个放热过程。
方建慧,施利毅,张建军等,2006.液流式电吸附脱盐装置的炭电极的制造方法.高科技纤维与应用,31(2):54
徐 丛,李 薇,潘 纲,2009.Zn(II)/α-FeOOH 吸附体系的固体浓度效应.物理化学学报,25(9):1737—1742
Bienfait M,Zeppenfeld P,Dupont-Pavlovsky Net al,2004.Thermodynamics and structure of hydrogen,methane,argon,oxygen,and carbon dioxide adsorbed on single-wall carbon nanotube bundles.Physical Review B,70(3):035410—035419
Collins P G,Zettl A,Bando Het al,1997.Nanotube nanodevice.Science,278(5335):100—102
Dillon A C,Jones K M,Bekkedahl T Aet al,1997.Storage of hydrogen in single-walled carbon nanotubes.Nature,386(27):377—379
Der Heer W A,Chatelain A,Ugarte D A,1995.Carbon nanotubule field-emission electeon source.Science,270:1179—1180
Davis W M,Erickson C L,Johnston C Tet al,1999.Quantitative fourier transform infrared spectroscopic investigation humic substance functional group composition.Chemosphere,38(12):2913—2928
Hadadin N,Qaqish M,Akawwi Eet al,2010.Water shortage in Jordan—Sustainable solutions.Desalination,250(1):197—202
Iijima S,1991.Helical microtubules of graphitic carbon.Nature,354(6348):56—58
Kuo C Y,2009.Water purification of removal aqueous copper(II)by as-grown and modified multi-walled carbon Nanotubes.Desalination,249(2):781—785
Kuo C Y,Lin H Y,2009.Adsorption of aqueous cadmium(II)onto modified multi-walled carbon nanotubes following microwave/chemical treatment.Desalination,249(2):792—796
Kara M,Yuzer H,Sabah Eet al,2003.Adsorption of cobalt from aqueous solutions onto epiolite.Water Research,37(1):224—232
Lu C,Chiu H,2006a.Asorption of zinc(II) from water with purified carbon nanotubes.Chemical Engineering Science,61:1138—1145
Lu C,Chiu H,Liu C,2006b.Removal of zinc(II) from aqueous solution by purified carbon nanotubes:kinetics and equilibrium studies.Industrial and Engineering Chemistry Research,45:2850—2855
Lu C,Liu C,2006c.Removal of nickel(II) from aqueous solution by purified carbon nanotubes.Journal of Chemical Technology and Biotechnology,81(12):1932—1940
Lu C S,Chung Y L,Chang K F,2005.Adsorption of trihalomethanes from water with carbon nanotubes.Water Research,39(6):1183—1189
Li Y H,Wang S,Luan Zet al,2003a.Adsorption of cadmium(II)from aqueous solution by surface oxidized carbon nanotubes.Carbon,41(5):1057—1062
Li Y H,Ding J,Luan Zet al,2003b.Competitive adsorption of Pb2+,Cu2+and Cd2+ions from aqueous solutions by multiwalled carbon nanotubes.Carbon,41(14):2787—2792
Montoro L A,Rosolen J M,2006.A multi-step treatment to effective purification of single-walled carbon nanotubes.Carbon,44(15):3293—3301
Monthioux,Smith B W,Burteaux Bet al,2001.Sensitivity of single-wall carbon nanotubes to chemical processing:an electron microscopy investigation.Carbon,39(8):1251—1272
Mohammadi T,Kaviani A,2003.Water shortage and seawater desalination by electrodialysis.Desalination,158(1—3):267—270
Pyrzynska K,2008.Carbon nanotubes as a new solid-phase extraction material for removal and enrichment of organic pollutants in water.Separation &Purification Reviews,37:375—392
Planeix J M,Coustel N,Coq B et al,1994.Application of carbon nanotube as supports in heterogeneous catalysis.J Am Chem Soc,116(17):7935—7936
Stafiej A,Pyrzynska K,2008.Adsorption of heavy metal ions with carbon nanotubes.Separation and Purification Technology,58(1):49—52
Sadrzadeh M,Mohammadi T,2008.Sea water desalination using electrodialysis.Desalination,221(1—3):440—447
Yang C,Hu X,Wang Det al,2006.Ultrasonically treated multi-walled carbon nanotubes(MWCNTs) as Pt Ru catalyst supports for methanol electrooxidation.Journal of Power Sources,160:187—193
Unlu N,Ersoz M,2006.Adsorption characteristics of heavy metal ions onto a low cost biopolymeric sorbent from aqueous solutions.Journal of Hazardous Materials,136(2):272—280
