大菱鲆胃质子泵(H+ /K+ ATPase)与消化机能发生的关系*
2014-03-09徐世宏肖志忠马道远赵春彦肖永双武宁宁刘清华
迟 良 徐世宏 肖志忠 马道远 林 帆 赵春彦肖永双 武宁宁 刘清华① 李 军①
(1.中国科学院海洋研究所生物技术中心 青岛 266071;2.中国科学院大学 北京 100049;3.青岛市渔业技术推广站 青岛 266071)
胃质子泵,又称为胃 H+/K+ATP酶(H+/K+ATPase),是胃酸分泌的关键性酶,它通过水解 ATP酶为离子转运提供能量,完成 H+、K+离子转运和胃酸的分泌(Chowet al,1995)。H+/K+ATPase首先在上世纪70年代,由Forte等人在牛蛙的胃粘膜分离出来(Prinzet al,1992)。后来证明H+/K+ATPase具有跨膜运输质子的作用,从而为胃酸分泌机理的研究奠定了基础(vanDrielet al,1995;Forteet al,1996)。
质子泵分为 α、β两个亚单位。α亚基在胞质内外形成多个回褶,因此形成了胞质区、膜区和胞质外区三个功能区域。α亚基含有ATP结合位点、酰基磷酸化位点等,是质子泵的催化亚基,起催化和转运H+、K+的功能(Kakeiet al,1995;Asanoet al,1997;Besanconet al,1997)。β亚基只含有一个跨膜区域,是质子泵的辅助亚基,主要起稳定α亚基和辅助泌酸的功能(Horisbergeret al,1991;Tyagarajanet al,1996;CourtoisCoutryet al,1997)。另外,研究表明 H+/K+ATPase的正常分泌对于维持壁细胞的结构和发育也起到重要的作用。Spicer等通过基因打靶技术培养的H+/K+ATPase α亚基缺失的小鼠出现胃酸分泌减少,胃粘膜细胞变形,微绒毛和管泡消失,线粒体异常等症状(Spicer et al,2000)。Scarff等发现 H+/K+ATPase β亚基缺失的小鼠会出现胃酸分泌减少,微管和管泡的结构紊乱等特征(Scarffet al,1999)。
目前,对于 H+/K+ATPase的研究主要集中在哺乳动物中,在海水鱼类中关于 H+/K+ATPase还比较少。因为鱼类在消化过程中会受到温度,酸碱度及海水不断稀释、中和的影响,所以海水鱼类的消化过程较陆生动物更为复杂。因此,研究H+/K+ATPase对了解海水鱼类的消化机制重要的意义。
大菱鲆(Scophthalmus maximus)属鲆科(Bothidae)、菱鲆属(Scophthalmus),自然分布于东北大西洋沿岸,因其肉质鲜美,营养丰富,适应水温低,现在已成为我国北方重要的海水养殖种类。研究大菱鲆的消化机制对优化饵料结构,合理投饵,提高苗种成活率都具有重要的意义。因此,本文以大菱鲆为材料研究H+/K+ATPase的时空表达模式及其与消化机能发生的关系,以期为研究大菱鲆乃至海水鱼类的消化机理提供理论基础。
1 材料与方法
1.1 实验材料
实验所用大菱鲆鱼苗及成鱼取自山东烟台东方海洋科技股份有限公司。采用腹部挤压法获得若干亲鱼成熟的卵子和精液,并采用人工受精获得受精卵。将质量较好的浮性卵移入孵化网箱中进行孵化,孵化时水温为(14 ± 0.5) °C。将初孵化仔鱼转至水泥池中培育,水泥池面积 25m2培养密度 125尾每升。培育条件:水温调整为18—19 °C,溶氧7.0—8.5 mg/L,盐度30—32,pH 7.7—8.0。4至19日龄,仔鱼投喂轮虫(Brachionus plicatilis)13至 35日龄,投喂卤虫(Artemianauplii)。从27日龄起开始投喂配合饵料。
分别取个时期胚胎(2细胞期,8细胞期,囊胚期,原肠期,心跳期)及仔稚幼鱼(初孵为仔鱼,鳞片出现为稚鱼,鳞片铺满全身为幼鱼),孵化后在每天投喂前取样,分两批分别投入液氮及 Bouin’s液中固定保存,分别用于RNA提取和组织切片研究。另外,取1龄成鱼的腮、心脏、食管、胃、肠、肝脏、脾、肾、肌肉、卵巢等组织保存于液氮中,用于提取RNA。用于原位杂交实验的仔稚鱼每天投喂前取样,4%多聚甲醛固定 24h,梯度甲醇脱水,置于 100%甲醇中–20°C 长期保存。
1.2 RNA的提取和cNDA第一链的合成
胚胎、仔稚幼鱼及不同组织的样品约100 mg,使用购于 BioFlux 公司的 Simply P Total RNA Extration Kit试剂盒提取总RNA。提取的总RNA经分光光度计检测及甲醛变性电泳检测后,使用北京全式金生物技术有限公司生产的 Transcript Fist-Strand Cdna Synthesis Supermix试剂盒反转录合成cDNA第一链。
1.3 大菱鲆H+/K+ ATPase α亚基cDNA全长的克隆
根据GenBank中已公布的H+/K+ATPase α亚基的基因序列,通过比对在保守区域设计引物HK1F和HK1R(表1),使用TransTaq HiFi DNA聚合酶(全式金北京)扩增大菱鲆H+/K+ATPase α亚基的保守片段。反应体系:0.25 μL TransTaq HiFi DNA Polymerase,5 mM dNTPs,上下游引物分别为 0.2μL,2.5 μL 10 ×TransTaqHiFi Buffer,2μL cDNA 模版 和 17.25 μL ddH2O补至25μL。PCR反应条件:94°C预变性5min;94°C 30s,54 30s,72°C 90s,30 个循环,最后 72°C 延伸8 min。对扩增产物使用凝胶回收试剂盒进行回收,将回收的PCR产物与pMT-18T连接后,转化大肠杆菌E.coliDH5α中,然后送至北京华大基因公司进行测序。根据测序结果设计大菱鲆H+/K+ATPase α亚基RACE 引物 GSP1(3’RACE)和 GSP2(5’RACE)。

表1 试验中所需的引物序列Tab.1 Primers used for gene amplification by PCR
RACE反应过程使用 SMARTTMRACE cDNA Amplication Kit(Clontech)进行,根据说明书要求进操作。RACE PCR 反应体系:5 mM dNTPs,2.5 μL 10×Universal Primer A Mix(UPM),5µM Gene Specific Primer,1.25 μL RACE-ready cDNA,0.5 μL HiFi TransTaq,2.5 μL 10 ×TransTaqHiFi Buffer,加水至25 μL。RACE 反应条件:94°C 预变性 5min,94°C 30s,68°C 45s,72°C 90s,最后 72°C 延伸 5min,36 个循环。PCR 产物经1%的琼脂糖检测后,使用琼脂糖凝胶回收试剂盒回收,连接至pMT-18T载体后,转化大肠杆菌E.coliDH5α中,LB培养基培养过夜后,挑选阳性克隆送至上海美吉生物医药科技有限公司测序。
1.4 大菱鲆H+/K+ ATPase α亚基的表达模式分析
根据已获得的大菱鲆 H+/K+ATPase α亚基的cDNA全长序列设计引物HK2F和HK2R和一对特异的内参引物β-actinF和β-actinR进行RT-PCR检测大菱鲆H+/K+ATPase的时空表达情况。分别提取大菱鲆胚胎、仔稚幼鱼及成鱼鳃、食管、心脏、肝、脾、胃、肠、肾、肌肉和卵巢10个组织的总RNA,经反转录后用于 RT-PCR检测和荧光定量 PCR检测,定量检测引物为HK3F和HK3R。 RT-PCR的总反应体系为 25 μL,其中 ddH2O 15.25 μL,10×PCR buffer 2.5 μL,dNTPs 4 μL,上、下游引物(10 μmol/L)各 1 μL,Taq 酶 0.25 μL,cDNA 模板 1 μL。反应条件为 4°C 预变性 5 min;94°C 变性 40 s、60°C 退火 30 s、72°C延伸2 min,26个循环。荧光定量反应体系为25 μL,SYBR Primix Ex TaqTMII(2×),12.5 μL,上下游引物(10 μmol/L)分别为 1 μL,cDNA 模版 2 μL,ddH2O,8.5 μL。反应条件为:95°C 30 s;95°C 5 s;60°C 30 s,40 个循环。
1.5 整体原位杂交
根据已获得的大菱鲆 H+/K+ATPase α亚基的序列设计特异性地高辛标记的反义探针(上游:5’AGTGATGAGTTGGATGACGCAC 3’;下游:5’ ATA AGCCAGAGAAACAGAGGGG 3)进行整体原位杂交。探针的制备使用Roche探针标记试剂盒完成。按照其说明书操作。取4%多聚甲醛固定的22日龄的大菱鲆幼鱼,经梯度甲醇脱水。将幼鱼的内脏团剥离,梯度甲醇复水。10 µg/ml蛋白酶K进行消化2h,4%多聚甲醛在固定20 min。移去固定液,1×PBST清洗6次,每次10 min。然后预杂交液中60°C预杂交2h,在含有10ng/μL探针的杂交液中60°C杂交过夜。多余的探针经 50% SSCT/50%甲酰胺、2×SSCT、0.2×SSCT洗涤后,使用2%的脱脂奶粉封闭2h。经染色缓冲液平衡后,与抗体杂交4°C过夜。实验结果使用Nikon YS-100显微镜观察拍片记录。
1.6 组织学观察
大菱鲆幼鱼Bouin’s液固定24h,70%乙醇保存。切片时使用乙醇梯度脱水,二甲苯透明,石蜡包埋进行连续切片,切片厚度 8µm,HE染色,在 Nikon YS-100显微镜下观察拍片记录。
1.7 序列分析和数据统计分析
测序结果使用DNASTAR Lasergene v7和MEGA 4.0进行结构和进化树分析。利用SPSS13.0软件对荧光定量PCR结果进行显著性检验,P< 0.05表示具有显著性差异,描述性统计量用平均值±标准差表示。
2 结果
2.1 大菱鲆H+/K+ ATPase α亚基cDNA全长序列分析
大菱鲆H+/K+ATPase α亚基cDNA 全长3467bp ,包含 5’UTR 175 bp,3’UTR 329 bp 和 ORF 2964 bp,编码988个氨基酸,前30个氨基酸为信号肽(图1)。通过与GenBank 上已公布的H+/K+ATPase α亚基比对发现大菱鲆 H+/K+ATPase 亚基与斑鳜(Siniperca chautsi) H+/K+ATPase α亚基序列同源性最高,达89%。
大菱鲆H+/K+ATPase α亚基蛋白序列具有10个跨膜结构域,蛋白磷酸化位点DKTGTLT(图1)
2.2 大菱鲆H+/K+ ATPase α亚基的序列比对及进化树构建
根据大菱鲆H+/K+ATPase α亚基的氨基酸序列,与GenBank公布的H+/K+ATPase α亚基氨基酸序列,使用MEGA4.0构建了大菱鲆H+/K+ATPase与其它物种的 Neighbor-joining系统进化树(图2),结果表明:H+/K+ATPase 的进化关系具有物种特异性,哺乳动物、禽类、两栖类及鱼类分别聚为一类。
2.3 大菱鲆H+/K+ ATPase在大菱鲆发育不同时期表达分析
以大菱鲆β-actin基因为内参基因,检测了大菱鲆 H+/K+ATPase基因在仔稚幼鱼不同发育时期及各组织的表达情况。结果显示,大菱鲆H+/K+ATPase直至孵化后22d 才开始表达(图3a)。荧光定量结果显示,大菱鲆H+/K+ATPase基因的表达在呈现指数性的增长(图3b )。另外,通过整体原位杂交技术显示大菱鲆的H+/K+ATPase首先在消化道的食道和胃的贲门区开始表达,然后再逐渐扩散到整个胃区(图3c)。

图1 大菱鲆H+/K+ ATPase α亚基cDNA 及其氨基酸序列Fig.1 cDNA sequence and deduced amino acid sequence of H+/K+ ATPase α subunit gene from turbot(Scophthalmus maximus)
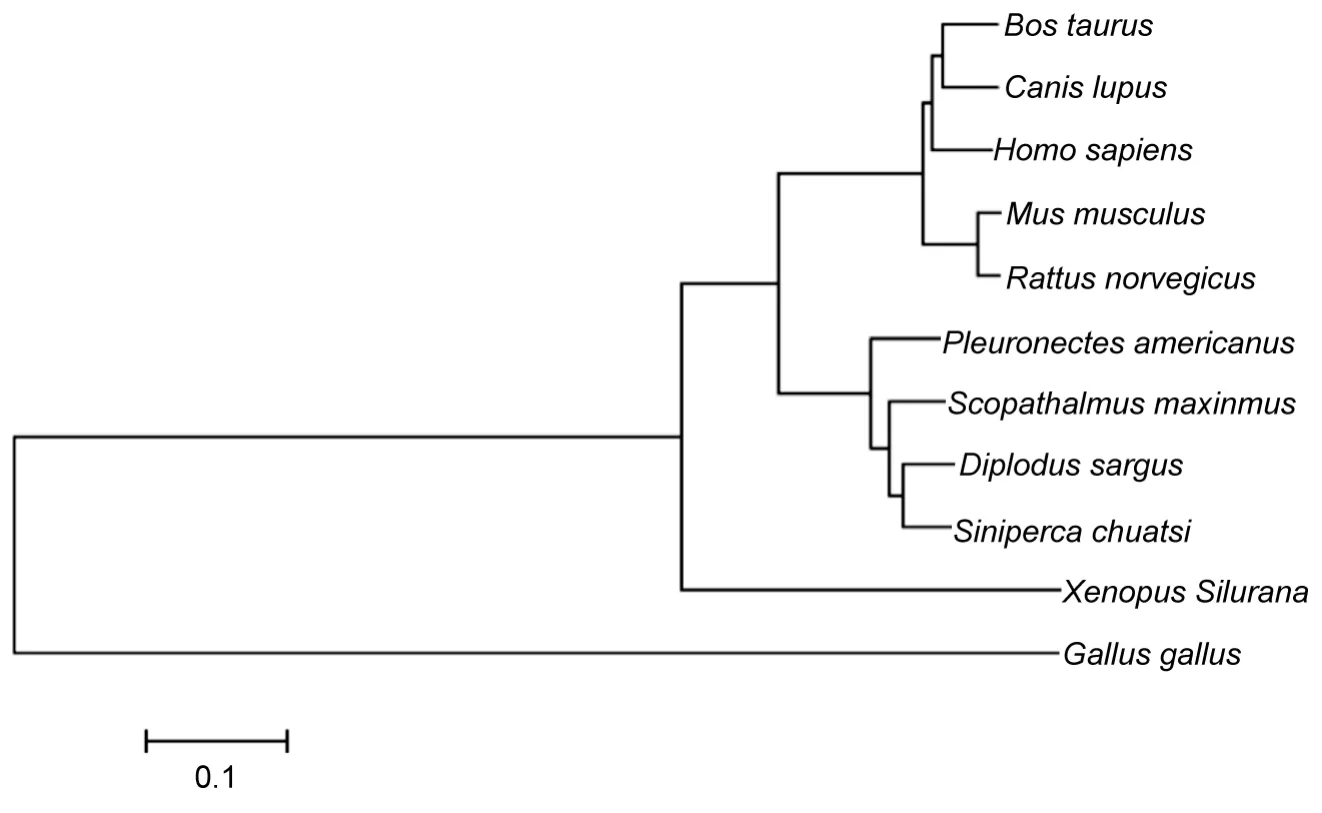
图2 利用MEGA 4.0 构建的H+/K+ ATPase的NJ进化树Fig.2 The Neighbor-joining tree of H+/K+ ATPase using MEGA 4.0
同时通过检测RT-PCR及荧光定量PCR检测大菱鲆成鱼各组织 H+/K+ATPase的表达情况,结果显示:大菱鲆 H+/K+ATPase主要在食道和胃中表达,在卵巢中也检测到了H+/K+ATPase的微量表达(图4a,图4b)。
2.4 大菱鲆消化道的发育过程
为了能够更好地了解大菱鲆的消化机理,作者对大菱鲆仔鱼消化道进行了组织切片观察,结果发现胚胎孵化后第一天(1 day post hatching,1 dph)大菱鲆的食管为一条细长的管状。2 dph时,食道粘膜上皮由单层立方上皮细胞组成,3dph由单层立方上皮细胞变为复层扁平上皮,8 dph 出现杯状细胞(图5a—c)。

图3 a 大菱鲆H+/K+ ATPase在发育不同时期的mRNA表达Fig.3a Expression of H+/K+ ATPase of development stages by RT-PCR
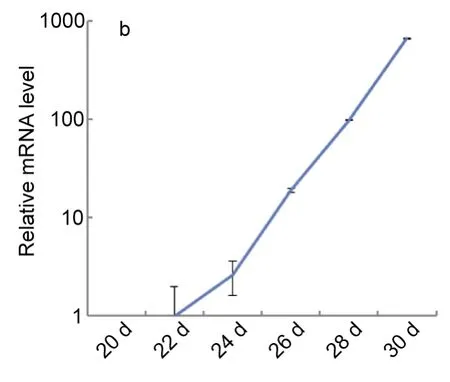
图3 b 大菱鲆H+/K+ ATPase在发育不同时期的mRNA的定量分析Fig.3b Expression of H+/K+ ATPase of development stages by quantitative real-time PCR
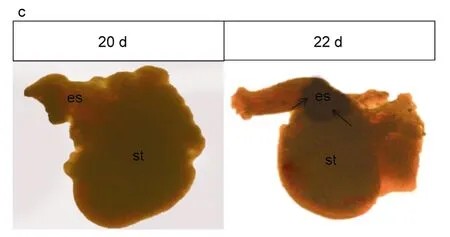
图3 c H+/K+ ATPase mRNA在大菱鲆消化道中的分布Fig.3c Development and distribution of H+/K+ ATPase mRNA in turbot digestive tract by whole in situ hybridization of antisense probe
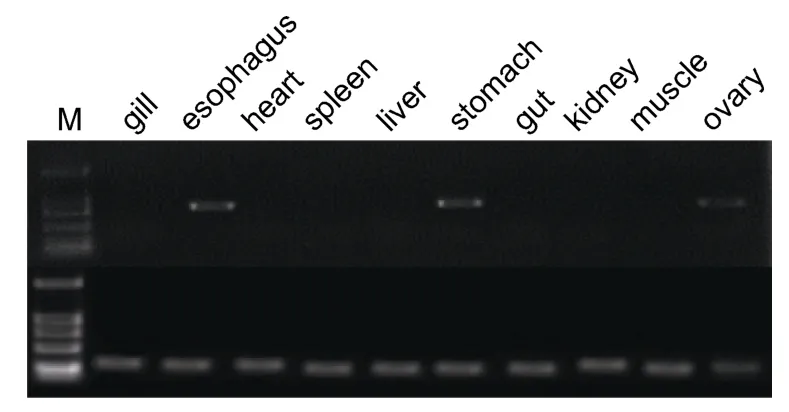
图4 a H+/K+ ATPase在大菱鲆不同组织的表达情况Fig.4a Expression of H+/K+ ATPase mRNA in tissues of adult turbot.M:Maker
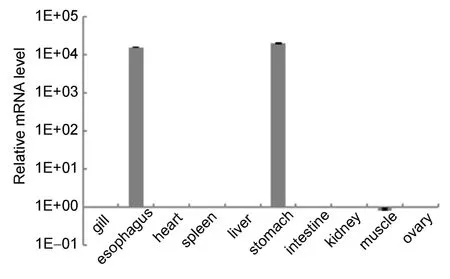
图4 b H+/K+ ATPase 在大菱鲆不同组织的相对表达量Fig.4b The relative expression in different tissues of H+/K+ATPase from turbot
大菱鲆胃的发育较食管的分化稍晚,初孵仔鱼的胃没有分化。2 dph,胃原基开始膨大,食管在接近胃体处的复层扁平上皮逐渐转变为单层柱状上皮。3 dph,胃粘膜逐渐出现褶皱,胃与食管的分化明显。8 dph可分化为贲门区、基底区和幽门区(图5d—f )。16 dph 胃腺出现。通过组织切片观察证明,大菱鲆的胃是由食道的末端膨大分化而来的。
3 讨论
α亚基含有ATP结合位点、酰基化位点和离子识别位点等,在稳定H+/K+ATPase酶的结构,行使功能等方面起到重要的作用(Besanconet al,1997;Asanoet al,1998)。因此本研究使用RACE技术克隆了大菱鲆的H+/K+ATPase α亚基,全长3467 bp,与GenBank已公布的H+/K+ATPase α亚基序列比对发现,与斑鳜的同源性最高达89%,其次与牙鲷(Diplodus sargus)、美洲鲽(Pleuronectes americanus)分别为88%和87%。通过进化树分析发现H+/K+ATPase 在进化上具有物种特异性,哺乳类、鸟类、两栖类和鱼类分别聚为一类,作者认为这可能与物种的食物来源相关。
胃腺的出现通常是认为胃的功能完善的标志(Infanteet al,2001;Wuet al,2009)。H+/K+ATPase 动物体内主要起到提供酸性环境激活胃蛋白酶的作用,因此总是与胃的消化功能联系在一起(Kageyama,2002)。作者通过 RT-PCR技术检测到大菱鲆 H+/K+ATPase在胚胎孵化后 22d开始表达,结合作者关于大菱鲆胃蛋白酶原的实验,作者认为大菱鲆的胃行使酸性消化功能至少要在 22d胃蛋白酶原与 H+/K+ATPase基因开始表达之后,因此胃的消化功能的完善未必与胃的组织结构完善一致。
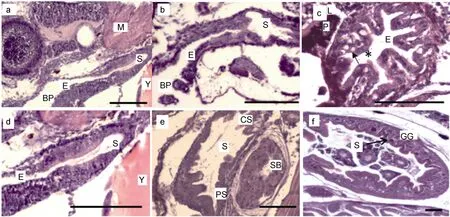
图5 大菱鲆食道和胃的组织发育Fig.5 Development of esophagus and stomach in turbot
H+/K+ATPase 主要在生物体胃中起到提供酸性环境辅助消化的作用(Scarffet al,1999;Spiceret al,2000)。但在其它的组织中H+/K+ATPase也具有其它的辅助功能。Altman等报道了H+/K+ATPase在有胃病的病人的喉部和下颌腺中会起到保护粘膜的作用(Altmanet al,2011)。Kraut 等研究发现在大鼠的肾脏也有 H+/K+ATPase的 mRNA表达,他们认为 H+/K+ATPase 在肾脏中能够起到平衡体液中的离子和酸碱平衡的作用(Krautet al,1994,1997,2001)。Choe 等在黄貂鱼(Dasyatis sabina)的鳃中检测到了 H+/K+ATPase的表达,他们认为鳃中的H+/K+ATPase能够让黄貂鱼更加适应海水的环境(Choeet al,2004)。在本研究中,通过RT-PCR和荧光定量PCR检测,大菱鲆的 H+/K+ATPase不仅在胃中表达,在食道中的表达量也很高,另外在卵巢中也检测到 H+/K+ATPase的微量表达。为了研究食道中有H+/K+ATPase的表达的原因,作者使用组织学技术,对大菱鲆的消化道的发育过程进行了研究。结果发现,大菱鲆的食道是胃的前体,胃的发育是在食道的末端由食道复扁平上皮转化为柱状上皮发育而来。因此作者认为,H+/K+ATPase在大菱鲆的食道中的高度表达可能是因为食道是胃的前体因此保留了分泌H+/K+ATPase的能力。另外,通过整体原位杂交实验也证明大菱鲆的 H+/K+ATPase首先在胃的贲门部和食管的末端开始表达。这也从另一个方面证明了作者的观点。
Altman K W,Kinoshita Y,Tan Met al,2011.Western blot confirmation of the H+/K+-ATPase proton pump in the human larynx and submandibular gland.Otolaryngology- head and neck surgery:official journal of American Academy of Otolaryngology-Head and Neck Surgery,145(5):783—788
Asano S,Hoshina S,Nakaie Yet al,1998.Functional expression of putative H+-K+-ATPase from guinea pig distal colon.American Journal of Physiology-Cell Physiology,275(3):C669—C674
Asano S,Matsuda S,Tega Yet al,1997.Mutational analysis of putative SCH 28080 binding sites of the gastric H+,K+-ATPase.Journal of Biological Chemistry,272(28):17668—17674
Besancon M,Simon A,Sachs Get al,1997.Sites of reaction of the gastric H,K-ATPase with extracytoplasmic thiol reagents.Journal of Biological Chemistry,272(36):22438—22446
Choe K P,Verlander J W,Wingo C Set al,2004.A putative H+-K+-ATPase in the Atlantic stingray,Dasyatis sabina:primary sequence and expression in gills.American Journal of Physiology-Regulatory Integrative and Comparative Physiology,287(4):R981—R991
Chow D C,Forte J G,1995.Functional-significance of the beta-subunit for heterodimeric P-type ATPases.Journal of Experimental Biology,198(1):1—17
CourtoisCoutry N,Roush D,Rajendran Vet al,1997.A tyrosine-based signal targets H/K-ATPase to a regulated compartment and is required for the cessation of gastric acid secretion.Cell,90(3):501—510
Forte J G,Yao X B,1996.The membrane-recruitmentand-recycling hypothesis of gastric HCl secretion.Trends in Cell Biol,6(2):45—48
Horisberger J D,Jaunin P,Reuben M Aet al,1991.The H,K-ATPase beta-subunit of NA,K-pumps.Journal of Biological Chemistry,266(29):19131—19134
Infante J L Z,Cahu C L,2001.Ontogeny of the gastrointestinal tract of marine fish larvae.Comparative Biochemistry and Physiology C-Toxicology &Pharmacology,130(4):477—487
Kageyama T,2002.Pepsinogens,progastricsins,and prochymosins:structure,function,evolution,and development.Cellular and Molecular Life Sciences,59(2):288—306
Kakei N,Ichinose M,Tatematsu Met al,1995.Effects of long-termomeprazole treatment on adult-rat gastric-mucosaenancement of the epithelial-cell proliferation and suppression of its differentiation.Biochemical and Biophysical Research Communications,214(3):861—868
Kraut J A,Helander K G,Helander H Fet al,2001.Detection and localization of H+-K+-ATPase isoforms in human kidney.American Journal of Physiology-Renal Physiology,281(4):F763—F768
Kraut J A,Hiura J,Besancon Met al,1997.Effect of hypokalemia on the abundance of HK alpha(1) and HK alpha(2) protein in the rat kidney.American Journal of Physiology-Renal Physiology,272(6):F744—F750
Kraut J A,Hiura J,Scott Det al,1994.Isolation of an H+/K+-ATPase from the rat kidney.Journal of the American Society of Nephrology,5(3):290—290
Prinz C,Kajimura M,Scott Det al,1992.Acid-secretion and the H,K-ATPase of stomach.Yale Journal of Biology and Medicine,65(6):577—596
Scarff K L,Judd L M,Toh Bet al,1999.Gastric H+,K+-adenosine triphosphatase beta subunit is required for normal function,development,and membrane structure of mouse parietal cells.Gastroenterology,117(3):605—618
Spicer Z,Miller M L,Andringa Aet al,2000.Stomachs of mice lacking the gastric H,K-ATPase alpha-subunit have achlorhydria,abnormal parietal cells,and ciliated metaplasia.Journal of Biological Chemistry,275(28):21555—21565
Tyagarajan K,Townsend R R,Forte J G,1996.The beta-subunit of the rabbit H,K-ATPase:A glycoprotein with all terminal lactosamine units capped with alpha-linked galactose residues.Biochemistry,35(10):3238—3246
vanDriel I R,Callaghan J M,1995.Proton and potassium transport by H+/K+-ATPases.Clinical Experimental Pharmacology and Physiology,22(12):952—960
Wu T,Sun L-C,Du C-Het al,2009.Identification of pepsinogens and pepsins from the stomach of European eel(Anguilla anguilla).Food Chemistry,115(1):137—142
