流动注射化学发光法测定人尿液中尿酸的含量Δ
2014-03-09齐慧丽马东平陇东学院化学化工学院甘肃庆阳745000
齐慧丽,盖 轲,马东平(陇东学院化学化工学院,甘肃庆阳 745000)
在动物体内,尿酸(Uric acid,UA)是嘌呤碱的氧化产物,嘌呤代谢紊乱可以导致痛风、高尿血症、Lesch-Nyhan综合征,而肾脏损伤、白血病或肺炎患者则常会出现高尿血症,白血病患者24 h UA最大排泄量可达12 g,而正常人只有250~750 mg[1]。由此可见,进行生理体液中UA的测定,对诊断和治疗由嘌呤代谢紊乱引起的上述疾病及选择正确的药物治疗处方,具有重要的指导作用。现行的临床检验方法中,测定UA最常用的是磷钨酸还原法[2],但体液中存在的还原性物质和有色物质对比色法有干扰,同时,体液中的蛋白能与UA血浆形成共沉淀,导致有色溶液的浑浊,给检测带来困难;采用高效液相色谱法[3-5]可提高检测的选择性,但这些方法涉及昂贵的仪器或复杂的装柱过程、蛋白质的分离过程,造成了检测操作上的不便;利用酶促反应的特异性,也可以提高选择性[6-7],但酶试剂昂贵,稳定性较差,且酶分析法操作复杂;直接电化学方法具有快速、简便和灵敏度高等优点,但由于UA和抗坏血酸(AA)在人体液中同时存在,且具有类似的氧化峰电位,用裸电极检测时易受干扰。目前,许多化学修饰电极用于AA共存体系中UA的测定取得了较好的效果[8-10],但由于临床需要,仍需对简便、高灵敏度和高选择性的方法进行研究。化学发光法具有仪器简单、灵敏度高、线形范围宽的优点,但将化学发光法用于UA测定的报道并不多见[11-12]。在试验中,笔者发现,荧光素、溴化十六烷基三甲铵(CTMAB)、铜离子(Cu2+)的混合物与可以发生化学发光反应,UA则是该化学发光反应的猝灭剂。AA基于这一现象,结合流动注射技术,建立了测定人尿液中UA含量的方法,对此猝灭现象的特性进行了研究。
1 材料
1.1 仪器
BPCL超微弱发光分析仪(中国科学院生物物理研究所);F-7000荧光分光光度计(日本日立公司);pHS-3C型数字酸度计(上海精密科学仪器有限公司)。
1.2 药品与试剂
UA标准品(美国Sigma公司,含量>99.6%,批号:050K08822);铜粉(天津市致远化学试剂有限公司);硝酸(HNO3,天津市科密欧化学试剂有限公司);氢氧化钠(NaOH,天津百世化工有限公司);CTMAB(北京奥博星生物技术责任有限公司);荧光素(上海试剂三厂);AA(成都市科龙化工试剂厂);试验所用试剂均为分析纯,水为二次蒸馏水。
2 方法与结果
2.1 溶液的配制
2.1.1 UA标准溶液。称取UA标准品0.200 0 g溶于1 L水中,作为贮备液(200 mg/L)。0.1~20 mg/L的UA标准溶液则由贮备液稀释而成,且保证其中AA的含量为25 mg/L。
2.1.2 Cu2+贮备液(1.0×10-2mol/L)。称取铜粉0.635 0 g,用1∶1 HNO3溶解,定容至1 L。
2.1.3 荧光素标准溶液(5.0×10-3mol/L)。称取荧光素1.662 0 g,用0.1 mol/L NaOH 10 ml溶解,定容至1 L。
2.1.4 混合化学发光试剂的配制。依次向1 L量瓶中加入5.0×10-2mol/L CTMAB100 ml和Cu2+贮备液10 ml,最后边振摇边缓慢加入5.0×10-3mol/L荧光素标准溶液100 ml,配制成混合化学发光试剂。
2.2 试验方法
流动注射化学发光法测定UA的流路如图1所示。蠕动泵P1用来输送混合化学发光试剂和NaOH,蠕动泵P2用来输送载液(水)和样品。两个泵的流速均为2.5 ml/min。管路的连接均采用0.8 mm内径的聚四氟乙烯(PTFE)管,采样环体积30 μl。将混合化学发光试剂与NaOH溶液混合后,由水载流再与UA标准溶液(或UA样品)混合,UA标准溶液系列和UA样品中均加入AA,保证其中AA浓度为25 mg/L。以水作空白得到发光强度I0;待空白稳定后将UA溶液注入,测定其发光强度Is。光电倍增管的工作电压为-800 V。化学发光信号值由BPCL超微弱发光分析仪检测、记录。以ΔI=I0-Is与质量浓度c的线性关系进行定量。
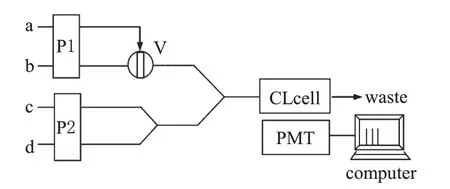
图1 流动注射化学发光法测定UA的流路示意图a.样品;b.载液;c.混合化学发光试剂;d.NaOH溶液;P1、P2.蠕动泵;V.进样阀;CL cell.化学发光池;PMT.光电倍增管Fig 1 Schematic diagram of uric acid determined by flow injection chemiluminescencea.sample;b.carrier liquid;c.mixed chemiluminescence reagent;d.NaOH;P1,P2.peristaltic pump;V.admission valve;CL cell.chemiluminescence cell;PMT.photomultiplier
2.3 试验条件的优化
本方法测定UA是基于UA能猝灭荧光素混合化学发光体系与AA的化学发光。因此,笔者详细研究了影响荧光素混合化学发光体系与AA反应的因素。
2.3.1 反应介质浓度的选择。该化学发光反应必须在碱性条件下进行,试验中分别采用相同浓度的NaOH、碳酸氢钠、碳酸钠、磷酸二氢钠、磷酸氢二钠和NaOH-碳酸钠作为反应介质考察对信号强度的影响。结果表明,用NaOH溶液稀释鲁米诺(3-氨基邻苯二甲酰肼)溶液,不仅可以增强测定体系的化学发光信号,还可提高化学发光信号的重现性。因此,试验中选择NaOH溶液作为反应介质。
试验中考察了NaOH浓度对化学发光强度的影响,见图2。在1.0×10-2~0.25 mol/L范围内,ΔI随NaOH浓度的增大而增大;NaOH浓度为0.25 mol/L时,ΔI达最大值;在0.25~0.5 mol/L范围内,ΔI随NaOH浓度的增大反而减小。因此,试验中选择0.25 mol/LNaOH作为最佳浓度。

图2 NaOH浓度对ΔI的影响Fig 2 Effects of NaOH concentration on ΔI
2.3.2 荧光素浓度的选择。荧光素浓度与测量的灵敏度和重现性直接相关。笔者考察了荧光素浓度在1.0×10-4~2.5×10-3mol/L范围内对化学发光强度的影响,见图3。荧光素浓度在1.0×10-4~5.0×10-4mol/L范围内,随着荧光素浓度的增大,ΔI值增大;当荧光素浓度增大至5.0×10-4mol/L时,ΔI达最大值;进一步增大荧光素的浓度,ΔI值反而降低。因此,在试验中选用5.0×10-4mol/L的荧光素。

图3 荧光素浓度对ΔI的影响Fig 3 Effects of fluorescein concentration on ΔI
2.3.3 表面活性剂浓度的选择。表面活性剂CTMAB可以增敏AA和混合化学发光试剂的发光强度。笔者考察了CTMAB浓度在0~1.0×10-2mol/L范围内对体系化学发光强度的影响,见图4。无CTMAB时,体系的化学发光强度非常弱;CTMAB的浓度在5.0×10-4~5.0×10-3mol/L范围内,ΔI值随着CTMAB的浓度增大而增大;当CTMAB浓度超过5.0×10-3mol/L时,ΔI值不再明显增大。因此,试验选用浓度为5.0×10-3mol/L的CTMAB作为增敏剂。

图4 CTMAB浓度对ΔI的影响Fig 4 Effects of CTMAB concentration on ΔI
2.4 含量测定方法学考察
2.4.1 线性关系与检出限考察。通过试验研究,确定测定体系的反应试剂浓度分别为:NaOH溶液0.5 mol/L、荧光素5.0×10-4mol/L、铜离子1.0×10-4mol/L、CTMAB 5.0×10-3mol/L、AA 25 mg/L,主泵(P1)、副泵(P2)流速均为2.5 ml/min,光电倍增管负高压为800 V。在上述优化的试验条件下,对一系列浓度的UA溶液进行测定。以水作空白测得发光强度I0;待空白稳定后将浓度分别为0.1、0.5、1.0、2.5、5.0、10、15、20 mg/L的UA溶液注入,测定其发光强度Is。以ΔI=I0-Is与质量浓度c的线性关系进行定量。结果线性回归方程为:ΔI=-306.58c+3 557.9(r=0.999 0,n=5),表明在0.1~20 mg/L质量浓度范围内,相对化学发光强度变化值(ΔI)与UA的质量浓度(c)呈良好的线性关系,检出限为3.3×10-2mg/L。
2.4.2 精密度试验。配制1 mg/L的UA标准溶液,在优化的试验条件下,对1 mg/L的UA进行11次平行测定,得相对标准偏差(RSD)为1.2%,表明方法精密度良好。
2.4.3 加样回收率试验。取3份已知含量的样品,分别加入等量UA溶液,按“2.2”项方法操作,测定UA的含量,计算加样回收率。结果3份样品的加样回收率分别为101.0%、99.5%、98.4%,平均加样回收率为99.63%;RSD分别为0.57%、0.81%、1.40%,总平均值为0.93%(n=3)。结果表明该方法准确可靠,见表1。

表1 加样回收率试验结果(n=3)Tab 1 Results of recovery tests(n=3)
2.4.4 干扰试验。为了考察该体系测定UA的选择性,配制合成尿样作为干扰物。合成尿样含有尿液中除UA以外的大部分物质,见表2。其中,每种物质的量都按成人24 h最高排泄量计,而成人24 h排尿量按1 L计[1]。将含有1 mg/L UA的合成尿样与1 mg/L的标准UA溶液分别进样,所得信号值差异<5%。结果表明,正常量的共存物质并不干扰UA的测定,2倍量的共存物质有5%的正干扰。
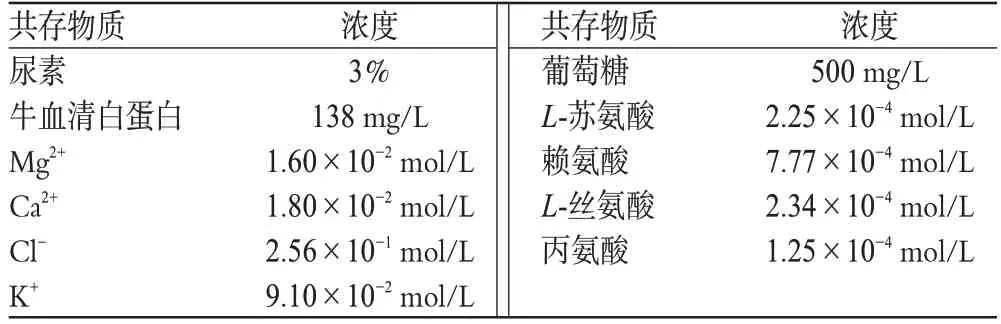
表2 合成尿样的成分Tab 2 The composition of the urine sample
2.5 样品分析
分别取3名志愿者的新鲜尿液,稀释后按“2.2”项方法进行化学发光法测定,同时将样品送检医院实验室检查(采用UA酶-过氧化物酶偶联法[2]测定样品中UA的含量)。测定结果表明,本方法对尿样中UA含量的测定结果与医院实验室检查的结果一致,见表3。

表3 尿样分析结果Tab 3 Results of the urine sample analysis
3 讨论
3.1 流路的选择
流路中各管道加入的反应试剂不同将影响反应的进程。前期试验中试验了3种不同流路对化学发光强度的影响,结果选择a、b、c、d 4个管道分别加入UA标准溶液、水、混合化学发光试剂和NaOH溶液时,该流路发光信号比较稳定且ΔI值较大。
3.2 混合化学发光试剂稳定时间
通过试验发现,该体系的发光强度与混合化学发光试剂的稳定时间有关。在5 d时间内,放置时间越长,试剂与AA所产生的化学发光强度越大。稳定期超过5 d,化学发光强度在3个月内趋于稳定。故本试验所使用的发光混合试剂均放置5 d以上。
3.3 AA用量的选择
试验研究表明,样品或UA标准溶液中AA质量浓度越低,测定UA的检出限就越低。为了获得足够低的检出限、更好的重现性和足够宽的线性范围,且考虑到尿液中含有20~30 mg/L的AA(成人)[1],笔者考察了10~60 mg/L的AA对UA测定的影响。试验结果表明,当加入的AA质量浓度为25 mg/L时ΔI值达最大值,同时可得到足够低的检出限和足够好的重现性。因此试验选用质量浓度为25 mg/L的AA。
本研究建立了化学发光法测定人尿液中UA含量的新方法,该方法无需对样品进行分离,可直接检测;尿液无需特殊处理,直接稀释后,其中的UA可以选择性地猝灭AA与荧光素-表面活性剂-铜离子混合物在碱性条件下产生的化学发光。本方法采用化学发光结合流动注射技术测定人尿液中UA含量,分析结果与医院实验室的检查结果具有很好的一致性。本法分析系统设备简单,操作简便,结果可靠,能对尿液中UA含量进行快速测定,可用于监测由于代谢紊乱和使用药物所引起的UA异常,为临床诊断和处方提供依据。
[1]何金昌.尿液分析与临床诊断[M].深圳:海天出版社,1993:7、26.
[2]卫生部医政司.全国临床检验操作规程[M].3版.南京:东南大学出版社,2005:232.
[3]施政,刘健,申屠建中,等.高效液相色谱法定量尿酸、黄嘌呤和次黄嘌呤在人体血清中的浓度[J].中国临床药理学与治疗学,2013,18(5):532.
[4]江雅平,刘欧,徐国宾,等.反相高效液相色谱紫外法检测人血清尿酸[J].临床检验杂志,2012,30(4):244.
[5]胡坪,王瑞娟,王月荣,等.HPLC法测定人尿中尿酸含量[J].分析试验室,2011,30(5):50.
[6]付海莹,王建秀,邓留.基于石墨烯和室温离子液体复合物溶胶修饰的玻碳电极制备尿酸电化学传感器[J].分析化学,2014,42(3):441.
[7]常艳兵,刘艳玲,何琼.Pt-Au合金纳米管修饰玻碳电极的尿酸酶传感器的研制[J].分析科学学报,2013,29(4):515.
[8]孙娜,王宗花,夏建飞,等.聚对氨基苯磺酸/石墨烯复合修饰电极对尿酸的选择性灵敏测定[J].分析测试学报,2012,31(7):853.
[9]马艳蓉.尿酸在普鲁士蓝修饰电极上的电化学动力学性质研究[J].宁夏工程技术,2010,9(2):128.
[10]樊雪梅,王书民,赵夏,等.尿酸在聚磺基水杨酸修饰玻碳电极上的电化学行为及其应用[J].理化检验:化学分册,2009,45(8):910.
[11]刘梅,何云华,吕九如.高锰酸钾-甲醛-尿酸化学发光体系的研究[J].分析化学,2005,33(4):535.
[12]瞿鹏,李保新,章竹君.反向流动注射抑制化学发光法测定尿酸[J].理化检验:化学分册,2004,40(8):470.
