不同指标评价布渣叶药材质量的聚类分析Δ
2014-03-09李泽华徐文杰董玉娟汪梦霞许灿新广东省人民医院广东省医学科学院广州510080广东省中医药工程技术研究院广州510095广州中医药大学附属第二中医院广州510405
李泽华,徐文杰,董玉娟,汪梦霞,许灿新(1.广东省人民医院/广东省医学科学院,广州 510080;2.广东省中医药工程技术研究院,广州 510095;.广州中医药大学附属第二中医院,广州 510405)
布渣叶为椴树科植物破布叶Microcos paniculataL.的干燥叶,主产于我国岭南地区,属于广东道地药材。其味微酸、性平,具有消食化滞、清热利湿的功效,临床多用于饮食积滞、感冒发热、湿热黄疸等症,已收载于2010年版《中国药典》(一部)和《广东省中药材标准》(第一册)[1-2]。布渣叶含有黄酮类、生物碱、三萜类、挥发油类等成分[3],其中黄酮类是其主要活性成分[4]。关于不同产地的布渣叶中总黄酮及牡荆苷质量分数的分析已有相关报道[5-10],但未见应用聚类分析法从总黄酮及牡荆苷质量分数两个指标来对不同产地布渣叶进行质量评价的研究报道。笔者选择不同产地的布渣叶,分别以总黄酮与牡荆苷的含量为指标,并应用聚类分析法对布渣叶进行产区分类,以为完善布渣叶的药材质量评价标准提供参考。
1 材料
1.1 仪器
UV-2550型紫外分光光度计(日本岛津公司);2695-2998型高效液相色谱(HPLC)仪,配备PAD检测器、四元梯度泵、Empower 2数据处理系统(美国沃特斯公司);KQ5200DE型数控超声波清洗器(昆山市超声仪器有限公司);Mettler XS205DU型电子天平(瑞士梅特勒托利多公司);MilliPore Advantage A10自动纯水机(美国默克密理博公司)。
1.2 试剂
芦丁对照品(批号:100080-200707)、牡荆苷对照品(批号:111687-200602)均购于中国食品药品检定研究院;D101型大孔吸附树脂(沧州宝恩吸附材料科技有限公司);甲醇为色谱纯,水为纯化水,其余试剂均为分析纯。
1.3 药材
布渣叶经广东省中医药工程技术研究院刘法锦教授鉴定为椴树科植物破布叶M.paniculataL.的干燥叶,药材来源见表1。

表1 布渣叶药材来源Tab 1 Source ofM.paniculata
2 方法与结果
2.1 牡荆苷的含量测定[1]
2.1.1 色谱条件 色谱柱:AKKZONOBEL Kromasil 100-5 C18(250 mm×4.6 mm,5 μm);流动相:甲醇-0.4%甲酸溶液(30 ∶70,V/V);检测波长:339 nm;流速:1.0 ml/min;柱温:25 ℃。色谱见图1。
2.1.2 对照品溶液的制备 取牡荆苷对照品适量,精密称定,加70%甲醇制成每1 ml含牡荆苷106.70µg的对照品溶液,即得。
2.1.3 供试品溶液的制备 取布渣叶药材粉末(过3号筛)约2.0 g,精密称定,置具塞锥形瓶中,精密加入70%甲醇50 ml,密塞,称定质量,超声(功率:200 W,频率:40 kHz)处理1 h,放冷,再次精密称定,用70%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。

图1 高效液相色谱图A.样品;B.对照品;1.牡荆苷Fig 1 HPLC chromatogramsA.sample;B.control substance;1.vitexin
2.1.4 线性关系考察 精密量取“2.1.2”项下的对照品溶液1、2、6、9、12、15 ml,分别置25 ml量瓶中,加入70%甲醇稀释至刻度,制成每1 ml含牡荆苷4.27、8.54、25.62、38.43、51.24、64.05µg的对照品溶液。精密吸取上述溶液各10 μl,注入液相色谱仪,按“2.1.1”项下色谱条件进样测定,记录色谱图。以峰面积积分值(y)为纵坐标,进样量(x,ng)为横坐标,进行线性回归,得回归方程为y=2 338.3x+8 595(r=0.999 9)。结果表明,牡荆苷的进样量在42.70~640.50 ng范围内与其峰面积积分值呈良好线性关系。
2.1.5 精密度试验 精密吸取牡荆苷对照品溶液(质量浓度为106.70 μg/ml)10 μl,按上述色谱条件进样测定,重复5次,记录色谱图。结果,RSD=1.02%(n=5),表明仪器精密度良好。
2.1.6 稳定性试验 取同一供试品(S1)溶液,分别于0、1、2、4、6、8、10 h按上述色谱条件进样测定,记录色谱图。结果,RSD=1.35%(n=7),表明供试品溶液在10 h内稳定性良好。
2.1.7 重复性试验 精密称取同一批样品(S1)6份,按“2.1.3”项下方法制备供试品溶液,再按上述色谱条件进样测定,记录色谱图,并计算样品含量。结果,牡荆苷的平均质量分数为0.11%,RSD=1.16%(n=6),表明本方法重复性良好。
2.1.8 加样回收率试验 取已知质量分数的样品(S1)约1.0 g,共9份,精密称定,分别精密加入适量的牡荆苷对照品,按“2.1.3”项下方法制备供试品溶液,再按上述色谱条件进样测定,记录色谱图,计算加样回收率,结果见表2。
2.1.9 样品中牡荆苷的含量测定 取布渣叶药材适量,按“2.1.3”项下方法制备供试品溶液,再按上述色谱条件进样测定,记录色谱图,并计算样品中牡荆苷的质量分数,结果见表3。
2.2 总黄酮的含量测定
2.2.1 对照品溶液的制备 取芦丁对照品适量,精密称定,加70%乙醇超声(功率:250 W,频率:100 kHz)使溶解,制成每1 ml含0.46 mg的溶液,即得。
2.2.2 供试品溶液的制备 取各批次布渣叶药材粉末(过3号筛)约2.0 g,精密称定,置100 ml具塞锥形瓶中,精密加入70%乙醇50 ml,称定质量,超声(功率:250 W,频率:100 kHz)处理30 min,放冷,再次精密称定,用70%乙醇补足减失的质量,摇匀,滤过,精密量取续滤液10 ml,95 ℃水浴加热,蒸干,加水5 ml使溶解,过D101型大孔吸附树脂柱,以水100 ml洗脱,弃去水液,再用70%乙醇洗脱,收集洗脱液,置50 ml量瓶中,加70%乙醇至刻度,摇匀,即得。
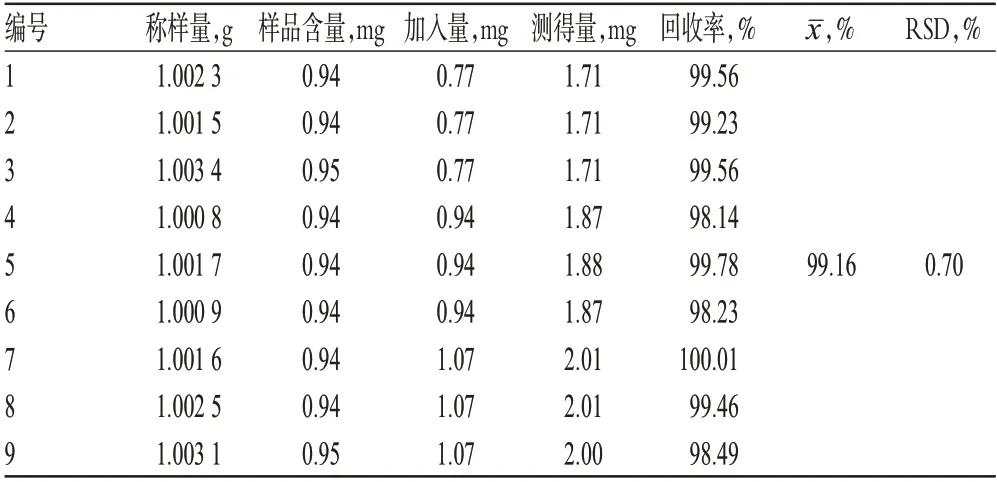
表2 牡荆苷加样回收率试验结果(n=9)Tab 2 Results of recovery tests(n=9)

表3 样品中牡荆苷的含量测定结果(n=2)Tab 3 Content determination of vitexin in samples(n=2)
2.2.3 线性关系考察 精密量取对照品溶液1、2、3、4、5、6 ml,分别置25 ml量瓶中,加70%乙醇至6 ml,依次精密加入5%亚硝酸钠溶液1 ml(摇匀,放置6 min)、10%硝酸铝溶液1 ml(摇匀,放置6 min)、氢氧化钠试液10 ml,加水至刻度(摇匀,放置15 min),以相应试剂为空白,在500 nm波长处测定吸光度(A)。以A(y)为纵坐标,质量浓度(x,μg/ml)为横坐标,进行线性回归,得回归方程为y=0.008 8x+0.064 2(r=0.999 5)。结果表明,芦丁的质量浓度在18.28~109.68 μg/ml范围内与其吸光度呈良好线性关系。
2.2.4 样品中总黄酮的含量测定 取上述布渣叶药材,分别按“2.2.2”项下方法制备供试品溶液,测定吸光度,结果见表4。

表4 样品中总黄酮的含量测定结果(n=2)Tab 4 Content determination of total flavonoids in samples(n=2)
2.3 聚类分析
应用SAS JMP Statistical Discovery V9.0.2.0统计分析大师软件,采用离差平方和法,选取欧氏距离平方和作为样品的测度,对20份布渣叶样品的牡荆苷和总黄酮的质量分数分别进行聚类分析。样品中牡荆苷、总黄酮含量的聚类分析树状图见图2;样品中牡荆苷、总黄酮含量的聚类历史记录见表5、表6。

图2 样品中牡荆苷、总黄酮含量的聚类分析树状图A.牡荆苷含量;B.总黄酮含量Fig 2 Cluster analvsts of the content of vitexin and total flavonoids in samplesA.vitexin;B.total flavonoids
以牡荆苷的质量分数为指标,当欧氏距离为0.75时,所有样品分为四大类,其中1、11、12聚为一类,3、5、13、14、16、19聚为一类,7、10、17、18聚为一类,2、4、6、8、9、15、20聚为一类。以总黄酮的质量分数为指标,当欧氏距离为0.72时,所有样品分为四大类,其中1、5、15、16、17、20聚为一类,2、6、9、10、18聚为一类,11为一类,3、4、7、8、12、13、14、19聚为一类。结果表明,同一产区的布渣叶并没有全部归为一类,这可能与布渣叶药材具体的采收地点、采收时间、干燥方法、贮藏方法不同等有关,也说明布渣叶对地理环境、采收时间和加工贮藏方法等因素比较敏感。
采用SPSS Statistic 17.0统计软件对布渣叶中牡荆苷与总黄酮质量分数的相关性进行分析。结果表明,二者没有显著性关系,相关性数据见表7。

表5 样品中牡荆苷含量的聚类历史记录Tab 5 Cluster record of the content of vitexin in samples

表6 样品中总黄酮含量的聚类历史记录Tab 6 Cluster record of the content of total flavonoids in samples
3 讨论
在总黄酮质量分数测定中,笔者分别以供试品、对照品及空白对照在200~800 nm波长范围内进行扫描。结果显示,对照品溶液及供试品溶液的最大吸收波长一致,两者在(500±2)nm处有最大吸收,故选择500 nm为测定波长。
本研究分别以牡荆苷和总黄酮的质量分数为指标进行聚类分析,二者结果不相同,进一步对样品中牡荆苷和总黄酮质量分数的相关性进行研究,二者仍无相关性,即牡荆苷质量分数的高低并不能代表样品中总黄酮的高低,这同时也表明,以单一活性成分判断药材质量的优劣是有缺陷的。本研究结果表明布渣叶药材的质量受到诸多因素的影响,且评价布渣叶药材质量时应进行多指标的综合评价。

表7 样品中牡荆苷与总黄酮含量的相关性分析Tab 7 Relative data of the contents of vitexin and total flavonoids in samples
[1]国家药典委员会.中华人民共和国药典:一部[S].2010年版.北京:中国医药科技出版社,2010:88-89.
[2]广东省食品药品监督管理局.广东省中药材标准:第一册[S].广州:广东科学技术出版社,2004:66-68.
[3]曾聪彦,吴惠妃,郭展荣.布渣叶化学成分定性鉴别的实验研究[J].世界中西医结合杂志,2009,4(3):175.
[4]陈雪婷.布渣叶总黄酮微丸的药学研究[D].广州:广州中医药大学,2012.
[5]潘天玲,李坤平,林赞菲,等.不同产地布渣叶总黄酮含量及其清除自由基活性研究[J].广东药学院学报,2009,25(5):452.
[6]罗文汇,谭志灿,李养学,等.HPLC测定布渣叶中牡荆苷的含量[J].中国实验方剂学杂志,2012,18(5):110.
[7]冯燕燕,梁秋娴,李小青,等.布渣叶中总黄酮与牡荆苷质量分数的季节动态变化[J].广东药学院学报,2013,29(1):35.
[8]李坤平,高崇凯,李卫民.布渣叶药材中黄酮的高效液相色谱指纹图谱分析[J].理化检验:化学分册,2011,47(2):194.
[9]孙冬梅,谭志灿,毕晓黎,等.RP-HPLC法同时测定布渣叶牡荆苷和异牡荆苷的含量[J].中国药房,2013,24(7):630.
[10]孙冬梅,陈雪婷,谭志灿.HPLC同时测定布渣叶提取物中3种黄酮苷的含量[J].中国实验方剂学杂志,2013,19(11):102.
