牙鲆(Paralichthys olivaceus)β诺达病毒衣壳蛋白重组表达及复性条件优化*
2014-03-08蒋嫣冉张亦陈刘逸尘耿绪云孙金生
蒋嫣冉 张亦陈① 刘逸尘 耿绪云 孙金生,
(1.天津市动植物抗性重点实验室 天津师范大学生命科学学院 天津 300387;2.天津市水生动物疫病预防控制中心 天津 300221)
β诺达病毒(Betanodavirus)亦被称为神经坏死病毒(viral nervous necrosis,NNV),是已发现的最小鱼类病毒(Chiet al,2001;Groveet al,2003;黄剑南等,2005),其基因组包括2条正义的、不含有poly(A)末端的单链RNA,分别为RNA1和RNA2。RNA1的大小约为3.1kb,编码非结构A蛋白,A蛋白是病毒的依赖RNA的RNA聚合酶(RNA-dependant RNA polymerase,RdRp)(Johnsonet al,2000;Tanet al,2001)。RNA2 的大小约为 1.4kb,编码病毒主衣壳蛋白(major capsid protein,MCP)(Krondiriset al,2002)。该病毒能感染5个目17科的40多种经济鱼类,引发病毒性神经坏死症(Viral nervous necrosis,VNN),对仔鱼和稚鱼的致死率极高,是国际兽疫组织确定的严重疫病[Mundayet al,1992;世界动物卫生组织(OIE)鱼病专家委员会,2001]。该病自1985年暴发至今,已在世界范围蔓延,我国水产养殖也深受其害。Lin等(2001)首次在我国大陆地区的石斑鱼体内分离获得β诺达病毒,基因型分析显示属于 RGNNV型。2006年本实验室从天津地区养殖牙鲆体内也检出该病毒(PONNV毒株)(毛海涛,2008),其基因型与RGNNV型相似性最高,这是我国大陆地区首次发现该病毒感染牙鲆的病例,近几年本地区β诺达病毒感染养殖牙鲆的状况频发,亟需建立有效的防控方法。
牙鲆(Paralichthys olivaceus)属硬骨鱼纲、辐鳍亚纲、鲽形目、鲽亚目、鲆科、牙鲆属,是名贵海水经济鱼类,极具经济价值,在我国渔业养殖中占有非常重要的地位。但随着养殖规模扩大和养殖密度提高,各种病害暴发越来越频繁,其中由β诺达病毒引起的病毒性神经坏死症是严重危害鱼苗的重大病害之一,由于鱼苗普遍易感染,且死亡率极高,经济损失巨大(顾中华等,2012)。研制有针对性的疫苗对病毒性疫病的防控至关重要,基于天然病毒的灭活和减毒疫苗虽然具有较好的免疫效果,但安全性等方面亦存在问题,因此通过基因工程手段制备亚单位疫苗等方法越来越受到重视。利用大肠杆菌表达外源基因,具有工艺简单、产量高、成本低等优点,但直接表达的蛋白质通常会形成包涵体,需复性后才具有生物学活性,因此,复性效率的高低对产品质量和生产成本至关重要(吴正辉等,2008)。不同蛋白质结构和构象复杂多样,复性条件差别较大,因此,有针对性地探索目的蛋白的包涵体复性条件对工业化生产具有重要意义。本研究构建了感染牙鲆的β诺达病毒完整衣壳蛋白原核表达载体,优化诱导表达参数,在获得目的蛋白高效表达的基础上,利用正交分析获得包涵体复性的最适条件,为今后的工业化生产提供了重要依据。
1 材料与方法
1.1 材料、试剂和仪器
1.1.1 实验材料、菌株、质粒E.coliDH5α和BL21(DE3)plsS菌株购自天根生化科技有限公司,表达载体Pet21a和带有PONNV毒株RNA2完整cDNA序列的质粒RNA2-PMD18T 由本实验室保存。
1.1.2 主要试剂和仪器
试剂:LA-Taq DNA聚合酶、T4DNA连接酶、限制性内切酶、DL-2000 DNAMarker和Premixed Protein Marker均购自宝生物工程(大连)有限公司;胶回收试剂盒和质粒小提试剂盒均购自 Axygen;PageRuler Unstained Protein Ladder购自Fermentas。
仪器:PCR仪(Bio-Rad);Duo flow蛋白纯化仪(BIO-RAD);LGJ-10C冻干机(北京四环科学仪器厂有限公司);JY92-2D超声波细胞粉碎机(宁波新芝生物科技股份有限公司);恒温培养箱(上海博讯实业有限公司医疗设备厂);蛋白电泳仪(BIO-RAD);微量核酸蛋白测定仪(BIO-RAD);台式冷冻离心机(Thermo)。
1.2 方法
1.2.1 引物设计 根据 PONNV毒株序列特点(KF841612),使用Primer Premier 5.0软件在其衣壳蛋白完整编码框两端设计正反向引物,并在终止密码子前引入His标签编码序列。引物序列如下:正向引物(NYQf0001e):5’-CATATG GTACGCAAAGGTGAG-3’,反向引物(NYQr1014He):5’-AAGCTT AGTGGT GGTGGTGGTGGTGGTTTTCCGAGTCAACCCT-3’。引物序列下划线为酶切位点。引物由生工生物(上海)有限公司合成。
1.2.2 重组表达载体的构建 使用前述设计的引物,以RNA2-PMD18T质粒为模板扩增病毒衣壳蛋白编码区,PCR反应体系为:10×LA-Taq buffer 2.5μL,上下游引物(10μmol/L)各 1μL,LA-Taq DNA 聚合酶1U,dNTP(10mmol/L)2μL,模 板 1μL,双 蒸 水17.3μL。PCR 反应条件为:94°C 预变性 4min;94°C 变性 1min,50—55°C退火 1min(6个循环,每循环降1°C),72°C延伸1min;94°C变性1min,51°C退火1min,72°C延伸1min,24个循环;72°C总延伸 10min。扩增产物经 1%琼脂糖凝胶电泳分离,目的条带采用Axygen凝胶回收试剂盒抽提并以 2.5μL扩增片段,2.1μL Solution I和 0.4μL PMD-18T 载体的体系 16°C连接过夜。连接产物转化 DH5α感受态细胞,经氨苄平板筛选转化子进行PCR检测后送北京华大生物公司测序并保种。抽提带有克隆片段的质粒和Pet21a质粒,分别经NdeI和HindIII双酶切后将带有His标签的病毒衣壳蛋白克隆片段接入Pet-21a质粒构建表达载体 RNA2-Pet21a,连接接产物转化DH5α感受态细胞,经 PCR及测序检测无误后保存备用。
1.2.3 重组蛋白的诱导表达与质谱鉴定 将 RNA2-Pet21a质粒转化表达菌株BL21(DE3)plsS,挑取阳性克隆接种于含有氨苄和卡那抗性的LB液体培养基中,37°C震荡培养至OD = 0.5—0.6,取1mL未诱导菌液作为对照,其余加入 IPTG至终浓度为 1mmol/L,分别于诱导 0.5h、1h、2h、3h、4h、5h收集菌液,10000g离心2min,弃上清。用PBS清洗沉淀后,10000g离心2min 加入 1mL Lysis Buffer(50mmol/L NaH2PO4⋅2H2O,300mmol/L NaCl,10mmol/L Iminazole),进行超声破碎,程序为:400W,5s/次,间隔5s,破碎5min,至半透明。4°C,10000g离心20min,收集上清与沉淀,分别适量加 1×SDS上样缓冲液,煮沸 10min,10000g离心1min后,取上清经 15% SDS-PAGE分离,将目的条带切下送华大生物科技公司进行质谱鉴定。
1.2.4 重组蛋白的纯化 将1L诱导表达的重组菌液经 10000r/min离心 10min收集菌体,按 1g湿菌10mL BufferA破碎缓冲液(含 1% TritionX-100,2mmol/LEDTA)的比例重悬菌体,冰浴超声破碎3次。破碎后溶液4°C,10000r/min,离心10min,弃去上清留沉淀。BufferB洗涤缓冲液(300mmol/L NaCl,50mmol/L NaH2PO4⋅2H2O,5mmol/L Iminazole,2mmol/L Urea,pH 7.4)洗涤沉淀3次,可得初步纯包涵体。上述包涵体经 WashI buffer(500mmol/L NaCl,20mmol/L Iminazole,20mmol PB,8mol/L Urea)溶解,涡旋振荡20min,4°C,10000r/min离心10min,上清经0.22μm滤膜过滤后结合于镍离子亲和柱纯化,具体操作按照Bio-Scale Mini profanity IMAC操作手册进行。
1.2.5 重组蛋白复性条件优化 参考稀释复性主要优化条件(吴正辉等,2008;庞怀宇等,2010),以大肠杆菌表达产生的重组衣壳蛋白包涵体为材料,利用正交试验优化重组蛋白的稀释复性条件。以盐离子浓度即PBS浓度(A)、尿素浓度(B)、温度(C)以及 pH(D)四个因素做为主要优化参数,针对每个参数设置 4个实验条件进行综合正交分析,研究不同因素对重组蛋白复性影响的大小并找出适宜的匹配条件。参照表1设计将分别将 400μL浓度为1.06μg/μL的重组包涵体蛋白溶液加入到 4mL不同复性缓冲液中在不同温度下复性 12h。复性产物10000g离心10min,收集上清冻干后用1×PBS溶解,利用微量核酸蛋白测定仪进行蛋白浓度测定,计算可溶蛋白总量。

表1 重组蛋白复性中的因素与水平参数值Tab.1 Refolding factors and levels of recombinant protein
2 结果
2.1 原核表达载体的构建
以RNA2-PMD18T质粒为模板,利用引物NYQf0001e和NYQr1014He扩增长度为1017bp的β诺达病毒衣壳蛋白编码区,电泳检测在约1kb处有单一条带,测序结果与预期一致。目的片段经HindIII和NdeI双酶切连入表达载体Pet-21a,测序显示含有T7启动子驱动的C端融合His标签的完整病毒衣壳蛋白表达盒,表明载体构建成功。
2.2 目的蛋白诱导表达与质谱鉴定
含有RNA2-Pet21a表达载体的大肠杆菌在37°C条件下培养至OD = 0.5—0.6,加入IPTG至终浓度为1mmol/L,进行诱导表达,分别在0、0.5、1、2、3、4、5h点取样,破碎菌体后分别取上清和沉淀,经15%SDS-PAGE分离检测。结果显示对照组在预期大小没有明显条带,实验组在 37kDa左右有预期大小条带,且随诱导时间延长表达量也随之增加并在约5h后达到峰值(图1)。用洁净手术刀小心切取目标条带经质谱鉴定,利用 LC-ESI-MS进行分析和鉴定,结果采用BioWorks软件与SEQUEST数据库进行比对,发现目标蛋白有-ISQAVLPAGTGTDGYVVVDATIVPDLLPR-、-LILLCVGNNTDVVNVSVLC R-、-FAGNAGTPAGWFR-、-QILLPVGTVCTR-4条肽段与预期蛋白中的相应氨基酸序列完全匹配(图2),由此判定上述蛋白条带即为表达的重组衣壳蛋白。
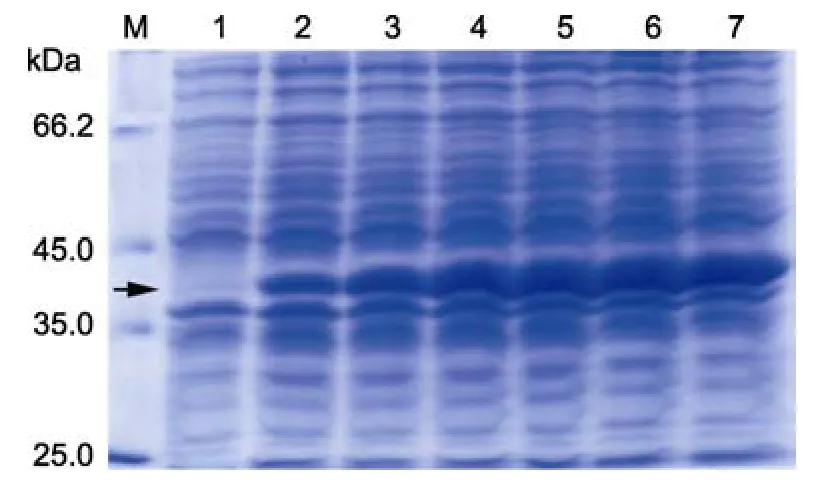
图1 重组衣壳蛋白在大肠杆菌BL21(DE3)plsS中的表达Fig.1 Expression of recombinant capsid protein in E.coli BL21(DE3)plsS
2.3 衣壳蛋白纯化及复性条件优化
离心收集诱导后的发酵菌体,破碎后取上清经镍离子亲和柱纯化,SDS-PAGE电泳检测表明获得单一条带,纯度>98%(图3)。正交试验中包涵体溶液经12h稀释复性后,离心取上清,冻干后用1×PBS溶解并测量蛋白浓度,计算可溶蛋白总量。测量结果见表2,直接分析表明,重组衣壳蛋白初步复性的最佳条件为A1B1C1D1,即在温度为4°C,复性缓冲液中PBS浓度0.05mol/L,尿素浓度0.8mol/L,pH为7的条件下复性效果最好,其复性前蛋白总量为 424μg,复性后可溶蛋白总量为73.08μg,蛋白复性率为17.24%。极差大小为B >D >A >C,表明尿素浓度对重组蛋白复性的影响最大,其次是复性缓冲液的pH,PBS浓度和温度对复性影响较小。方差分析结果见表3,计算得到因素的偏差平方和、自由度、F比、临界值,显示出各因素对重组蛋白复性影响的显著性,因素显著性程度为B >D >C >A。

图2 重组蛋白的质谱鉴定Fig.2 Mass spectrum verified the recombinant capsid protein
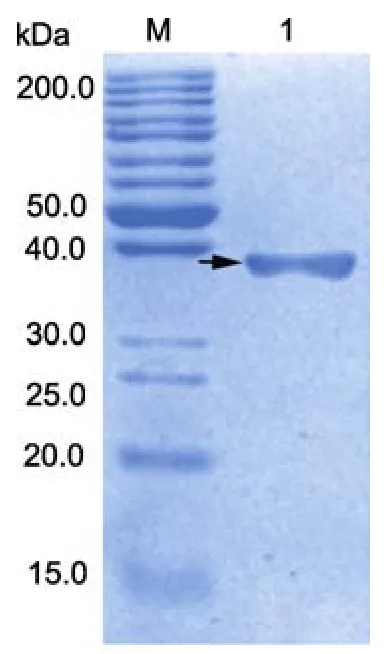
图3 纯化后重组蛋白的SDS-PAGE分析Fig.3 SDS-PAGE analysis of purified recombinant protein

表2 L16(4)4正交试验结果分析Tab.2 Analysis of orthogonal test
3 讨论
诺达病毒(Nodaviradae)可分为主要感染昆虫的α诺达病毒属(Alphanodavirus)以及以鱼类为主要感染对象的β诺达病毒属(Betanodavirus)(刘传凤等,2011),其中β诺达病毒根据来源、感染宿主以及致病性等方面的不同可分为4种基因型。β诺达病毒衣壳蛋白具有大量抗原表位,可诱导宿主产生保护性抗体,因此可通过体外表达该病毒的衣壳蛋白来研制抗病毒疫苗(Hegdeet al,2002)。但是,不同β诺达病毒株系衣壳蛋白之间虽具有较高的相似性,但也存在差异,主要原因是其复制所依赖的聚合酶RdRp校正能力弱,容易引发突变,从而产生针对不同宿主细胞表面受体的表位,因此该病毒具有非常广泛的宿主侵染性。基于β诺达病毒这一特点,有必要研制有针对性的疫苗产品,以提高保护效率;另一方面也可为进一步研究其与特定宿主细胞表面相互识别及结合位点的信息提供参考。近年来已有一些研究尝试利用原核表达系统制备β诺达病毒衣壳蛋白。陈晓艳等(2005)将斜带石斑鱼(Epinephlus coioides)神经坏死病毒(orange-spotted nervous necrosis virus,OGNNV)衣蛋白基因连接到 pet32a表达载体,转化至大肠杆菌BL21(DE3),表达获得分子量为 55.3kDa的融合蛋白。苏友禄等(2010)将赤点石斑鱼(Epinephelus akaara)神经坏死病毒(RGNNV)主衣壳蛋白(MCP)基因进行原核重组表达,得到分子量约为44.5kDa的重组蛋白。Tanaka等(2001)将七带石斑鱼(Epinephelus septemfasciatusThunberg)β诺达病毒的MCP基因在大肠杆菌中进行了融合表达,提取包涵体溶液免疫动物后,用不同滴度的病毒液进行攻毒。低剂量病毒攻毒组的相对存活率达69%—88%,平均为78.5%,高剂量病毒攻毒组的相对存活率为 35%—37%,因此可利用重组β诺达病毒衣壳蛋白制备疫苗。本研究针对感染牙鲆的β诺达病毒,利用大肠杆菌表达系统,构建用于制备该病毒衣壳蛋白的表达载体RNA2-Pet21a,转化BL21(DE3)plysS后经诱导表达获得约37kDa的重组蛋白,质谱鉴定为β诺达病毒衣壳蛋白,这将有助于进一步研制有针对性的疫苗或检测制品。

表3 正交试验方差分析Tab.3 Analysis of variance for orthogonal test
工业生产重组蛋白药物,一半以上是在大肠杆菌中表达的,并多以包涵体形式存在,因此,复性过程对生产效率和生产成本至关重要,对工业生产影响巨大(冯小黎,2001;吴正辉等,2008)。通常,天然构象的蛋白较包涵体形式具有更多的抗原表位,免疫原性亦更高,因此利用复性后的衣壳蛋白有望获得更佳的免疫效果,但目前对于重组该病毒衣壳蛋白的包涵体复性条件的分析鲜有报道。本研究构建的β诺达病毒衣壳蛋白表达载体转化宿主菌,经诱导表达后利用 SDS-PAGE分析发酵液以及菌体裂解液等组分,发现表达的重组蛋白主要以包涵体的形式存在,这与已报道的一些β诺达病毒衣壳蛋白重组表达结果一致(陈晓艳等,2005;苏友禄等,2010)。产物经镍离子亲和柱纯化后得到目的蛋白的单一的条带,在此基础上,尝试了对重组蛋白的包涵体进行复性条件的优化。通过正交试验着重分析了4种关键因素对复性效果的影响,数据分析中极差是反映试验因素影响的关键参数,极差越大表明其对试验结果的影响越大,本研究中极差最大的为 B,说明尿素对该包涵体复性的影响较大,其次是复性缓冲液 pH,PBS浓度和温度相对影响较小。复性后蛋白浓度最高的因素组合为A1B1C1D1,即在4°C条件下,利用PBS浓度0.05mol/L,尿素浓度为0.8mol/L,pH为7的缓冲液对包涵体进行稀释复性可以获得较好的效果,其蛋白复性率为17.24%,是较理想的复性条件。本研究成功构建了β诺达病毒衣壳蛋白原核表达载体,实现重组蛋白高效表达,并优化了复性条件,可为今后批量放大生产提供技术支持,亦可为同类研究提供重要参考。
毛海涛,2008.养殖牙鲆(Paralichthys olivaceus)病毒性神经坏死病的调查及诊断技术研究.天津:天津师范大学硕士学位论文,12—13
世界动物卫生组织(OIE)鱼病专家委员会,2001.水生动物病害诊断手册.北京:中国农业出版社,80—83
冯小黎,2001.重组包涵体的折叠复性.生物化学与生物物理进展,28(4):482—485
刘传凤,张珈敏,胡远扬,2011.野田村病毒RNA的复制机制.微生物学通报,38(9):1418—1424
苏友禄,郭志勋,冯 娟等,2010.赤点石斑鱼神经坏死病毒主衣壳重组蛋白多克隆抗体的制备.南方水产,6(6):8—13
吴正辉,郜金荣,佘应龙等,2008.不同复性条件对重组人组织纤溶酶原激活剂复性的影响.武汉大学学报(理学版),54(4):462—466
陈晓艳,翁少萍,殷志新等,2005.斜带石斑神经坏死病毒主衣壳蛋白的原核表达和纯化.中山大学学报,44(6):83—86
庞怀宇,吴娇娇,李素霞等,2010.正交试验优化黏质沙雷菌脂肪酶包涵体复性条件.食品与药品,12(1):4—6
顾中华,张亦陈,耿绪云等,2012.牙鲆β诺达病毒环介导等温扩增检测方法的建立.天津水产,(1):10—14
黄剑南,林 蠡,翁少萍等,2005.赤点斑神经坏死病毒外壳蛋白全基因克隆与序列分析.水产学报,29(3):429—432
Chi S C,Lo B J,Lin S C,2001.Characterization of grouper nervous necrosis virus.Journal of Fish Diseases,24(1):3—13
Grove S,Johansen R,Dannevig B Het al,2003.Experimental infection of Atlantic halibutHippoglossus hippoglossuswith nodavirus:tissue distribution and immune response.Diseases of Aquatic Organisms,53(3):211—221
Hegde A,Chen C L,QIN Q Wet al,2002.Characterization,pathogenicity and neutralization studies of a nervous necrosis virus isolated from grouper,Epinephelus tauvina,in Singapore.Aquaculture,213(1):55—72
Johnson K N,Zeddam J L,Ball L A,2000.Characterization and construction of functional cDNA clones of pariacoto virus,the firstAaphanodavirusisolated outside Australasia.Journal of Virology,74(11):5123—5132
Krondiris J V,Sideris D C,2002.Intramolecular disulfide bonding is essential for betanodavirus coat protein conformation.Journal of General Virology,83(9):2211—2214
Lin L,He J,Mori Ket al,2001.Mass mortalities associated with viral nervous necrosis in hatchery-reared groupers in the People’s Republic of China.Fish Pathology,36(3):186—188
Munday B L,Langdon J S,Hyatt Aet al,1992.Mass mortality associated with a viral-induced vacuolating encephalopathy and retinopathy of larval and juvenile barramundi,Lates calariferBloch.Aquaculture,103(3):197—211
Tan C,Huang B,Chang S Fet al,2001.Determination of the complete nucleotide sequences of RNA1 and RNA2 from greasy grouper(Epinephelus tauvina)nervous necrosis virus,Singapore strain.Journal of General Virology,82(3):647—653
Tanaka S,Mori K,Arimoto Met al,2001.Protective immunity of sevenband grouper,Epinephelus septemfasciatusThunberg,against experimental viral nervous necrosis.Journal of Fish Diseases,24(1):15—22
