虾蛄肉酶法制备抗氧化肽的工艺优化和活性研究*
2014-03-08李云涛马剑茵
李云涛 陈 博 马剑茵
(浙江海洋学院 食品与药学学院 舟山316004)
将蛋白质通过酶解制备成生物活性肽是目前食品、药品科学界的研究热点,许多研究资料显示,多肽有很强的抗氧化活性及抗菌、免疫调节、抑制胰岛细胞凋亡、改善胰岛素抵抗、抗高血压、降血脂、诱导肿瘤细胞凋亡或分化、抗血管生成等作用(王导等,2011;王静凤等,2007),多肽对许多疾病的发生、发展和临床治疗有重要意义。抗氧化肽是一种重要的多肽,它具有清除人体内多余自由基,减轻机体所受损伤,抗衰老、抗肿瘤、解毒等作用(Je等,2005)。国内外的科学工作者以海洋生物蛋白为原料,通过酶解法制备抗氧化肽多有报道,如李志英等(2012)用木瓜蛋白酶水解虎纹海参(Holothuriapervicax),在加酶量12.0%,水解2h,温度55°C,pH8.0时得到的酶解液有很好的抗氧化作用。Kim等(2001)用链霉蛋白酶E水解阿拉斯加鳕鱼(Theragrachalcogramme)得到的多肽在亚油酸体系中有很高的抗氧化活性,可开发成一种天然的抗氧化剂。Qian等(2008)分别用多种酶水解牛蛙(Ranacatesbeiana)皮蛋白,从中提取并分离纯化得到多肽,有很高的抗氧化活性。Binsan等(2008)从白虾(Litopenaeusvannamei)头胸部提取出了抗氧化肽等。
虾蛄(Oratosquillaoratoria)属节肢动物门(Arthropoda)、甲壳纲(Crustacea)、口足目(Stomatopoda)、虾蛄科(Squillidae)、口虾蛄属(Oratosquilla),俗称“螳螂虾”、“琵琶虾”、“虾爬子”等,产量大,分布广,绝大多数种类生活于热带和亚热带,在中国南海已发现80余种。目前对虾蛄的药用研究主要集中在甲壳素和乙醇提取物抗肿瘤方面(顾帝水等,2004;杨丹等,2006),而对虾蛄肉酶解多肽的研究尚未见报道。
本研究以虾蛄肉为原料,用胰蛋白酶酶解制备抗氧化肽。并综合运用正交试验和响应面法分析优化虾蛄肉抗氧化肽的酶解条件,既可以让数据点分布均匀合理,又可以分析各项的显著性和影响因素之间的交互作用,使分析结果更可靠,更有说服性,从而为虾蛄肉抗氧化肽的开发提供理论依据。
1 材料与方法
1.1 材料及试剂
材料:新鲜虾蛄采集自浙江舟山近海海域,去壳、头部、背部,洗净用匀浆机搅碎为肉糜。
试剂:胰蛋白酶,邻二氮菲,1,1-二苯基-2-三硝基苯肼(DPPH);其它试剂均为分析纯。
仪器设备:85-2恒温磁力搅拌器;ZD-420不锈钢新型电热恒温水槽;FE20实验室pH计;BSA323S电子天平;JJ-2组织捣碎机;CF16RXII高速冷冻离心机;FD-1000冷冻干燥机;UV1100紫外分光光度计。
1.2 试验方法
1.2.1 虾蛄肉蛋白酶解多肽的制备工艺 精密称取虾蛄肉糜,调 pH值,在水浴保温条件下加入一定量的蛋白酶酶解,酶解到设定时间时将酶解液在100°C水浴中灭活15min,4000r/min离心20min,取上清液冷冻干燥得到虾蛄肉蛋白酶解物,取定量配制成5mg/ml的水解液样品,备用。
1.2.2 抗氧化能力的测定方法 DPPH自由基清除活性的测定是根据Bersuder等(1998)描述的方法稍作修改。取 1.5ml样品与 1.5ml含 0.02%DPPH的99.5%乙醇溶液混合,振荡,在暗室室温下放置30min,然后在波长 517nm处测吸光值。DPPH自由基清除率(R1)按公式(1)计算,其中,空白调零:1.5ml99.5%乙醇+1.5ml蒸馏水,Ac:1.5ml含0.02%DPPH的 99.5%乙醇溶液+1.5ml99.5%乙醇,Aj:1.5ml样品+1.5ml99.5%乙醇,Ai:1.5ml样品+1.5ml含0.02%DPPH的99.5%乙醇溶液。
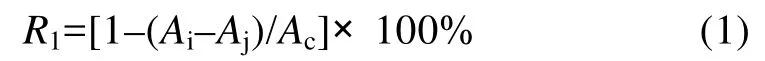
清除羟自由基能力的测定方法参考Elmastasa等(2006)和金铭等(1996)的工作。取0.75mmol/L的邻二氮菲 2.0ml于试管中,依次加入 2ml磷酸盐缓冲液(pH7.4)和2ml蒸馏水,充分混匀后,加入0.75mmol/L的硫酸亚铁溶液 2ml,混匀,加入 1ml 1.0%的 H2O2,37°C水浴6min,测定波长536nm处的吸光度Ap;用1ml蒸馏水代替 1mlH2O2,测得吸光度Ab;用样品代替1ml的蒸馏水,测得吸光度As。羟自由基清除率(R2)按公式(2)计算。

还原力的测定参考 Shon等(2004)的方法。2ml酶解液样品加入到 2ml的 0.2mol/L磷酸盐缓冲液(pH6.6)和2ml的1%铁氰化钾溶液的混合液中。混合物50°C水浴20min,在反应混合物中加入2ml的10%的 TCA(三氯乙酸),混合后以3000r/min离心10min,取上清 2ml,加入 2ml蒸馏水和 0.4ml的 0.1%FeCl3充分混匀反应,10min后测定其在700nm处的吸光值,值越大说明还原力越强。
超氧阴离子清除参考许申鸿等(2001)的工作。对照组:4.5m l50mmol/L的Tris-HCl+4.2ml蒸馏水混匀,于25°C恒温20min,再加入预热过的 3mmol/L邻三苯酚 0.3ml,迅速摇匀,立即倒入比色皿中,在波长325nm处每30s测定一次吸光度值A0,测4min,以时间为横坐标,A0为纵坐标进行线性回归分析,得到的直线斜率为反应速率ΔA0。
样品组:4.5ml 50mmol/LTris-HCl+3.2ml蒸馏水+1ml样品混匀,于 25°C恒温 20min,再加入预热过的3mmol/L邻三苯酚0.3ml,同上操作测定加样后的自氧化速率ΔA1。
空白调零:用9ml 10mmol/L的HCl调零。
清除超氧阴离子能力用R3表示,由公式(3)计算得到。
1.2.3 抗氧化肽的组成成分分析方法 水分含量按照 GB/T5009.3-2003测定,灰分含量按照 GB/T5009.4-2003测定,采用 BCA蛋白测定试剂盒测定蛋白质含量,脂肪含量按照GB/T5009.6-2003测定。
1.3 实验设计
1.3.1 正交试验 在初步确定酶解工艺的基础上,选择料液比(A)、pH值(B)、加酶量(C)、温度(T)、酶解时间(D)等因素设计 L16(45)正交表,优化以确定最佳工艺。选取因素和水平排列见表1,正交实验及结果见表3。

表1 因素和水平表Tab.1 Design of factors and levels in the experiments
1.3.2 响应面设计 在正交试验的基础上,按照Box-Behnken(操龙飞等,2012)中心组合实验设计原理,以pH值、温度、酶量为自变量,以R1为响应值,每一个自变量的高、中、低水平分别由1、0、–1编码表示,设计见表2。

表2 虾蛄肉酶解响应面实验因素水平表Tab.2 Coded variables and their coded levels in response surface analysis
2 结果与分析
2.1 正交试验结果
由表3可知,5个因素的极差大小顺序为:B>T>A>C>D,即 pH 值的影响最大,其次是温度和料液比,影响最小的是时间。对于每一个因素来说,Ti(i=1,2,3,4)是指该因素在表1所示的i水平条件下得到的R1值的均值,根据极差和均值可得出最优组合是︰料液比1︰4,pH 值7.0,加酶量1500u/g,温度50°C,时间 2h。
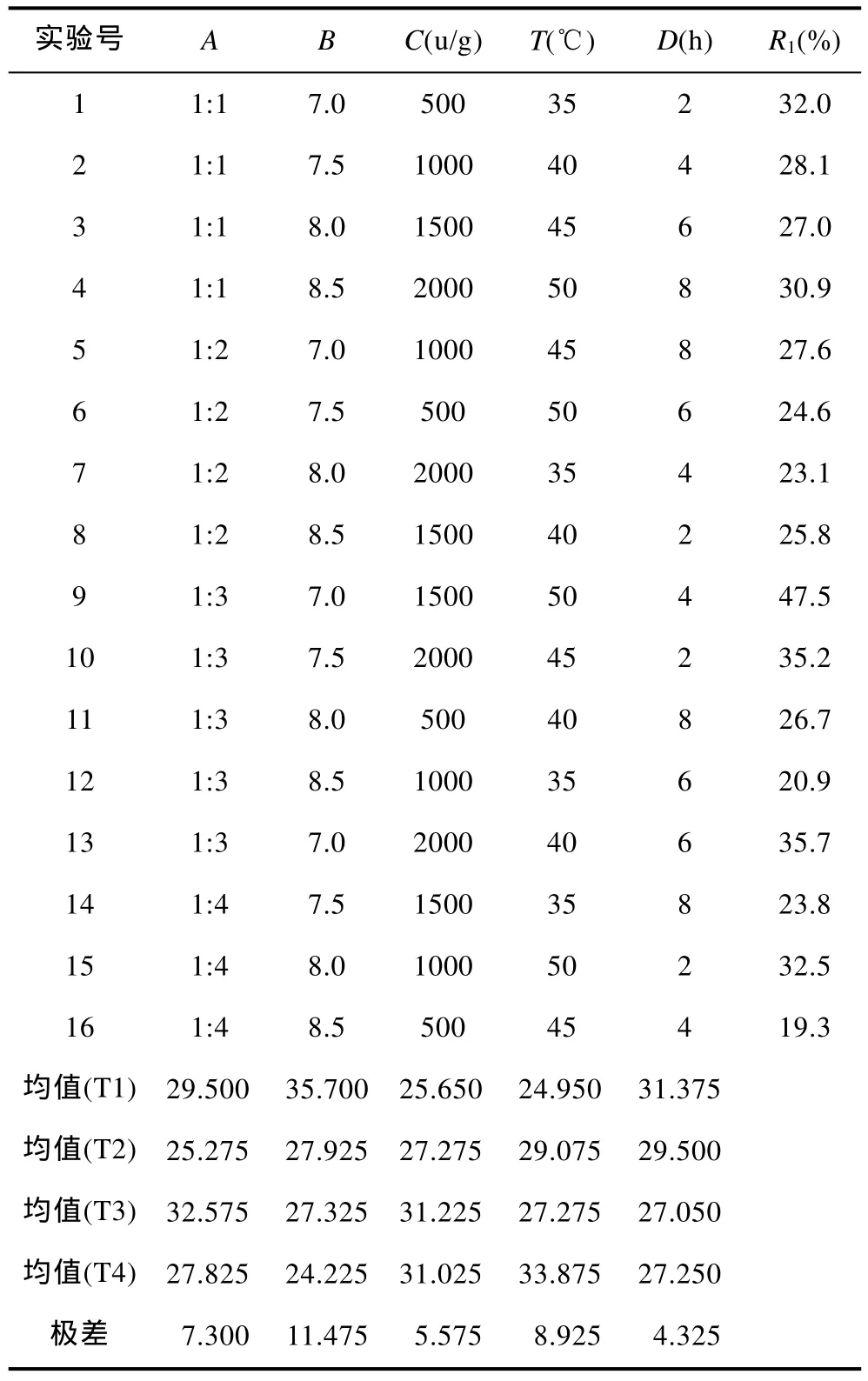
表3 L16(45)正交实验设计与结果Tab.3 L16(45)orthogonal design and results
利用SPSS软件对各因素进行回归分析,结果见表4和表5,采用逐步回归的方法,模型经方差分析检验得到:F=7.010,P=0.006,在α=0.05水平时,可认为实验结果和料液比、pH值和温度之间存在线性关系,则回归方程为Y=26.187–3.503A+2.498B+2.048T。回归系数经过t检验得到三个因素的P值分别为0.006,0.033,0.072,水平α=0.10时,三个因素均有显著性意义。分析结果与极差分析结果一致。由于显著性因素较多,所以需要通过响应面法进一步优化,获得最佳酶解方案。

表4 正交实验方差分析表Tab.4 ANOVA analysis of orthogonal design results

表5 正交实验回归系数Tab.5 Regression coefficients of orthogonal design
2.2 响应面分析结果
经过正交实验结果分析,得到料液比、pH值和温度是显著性因素,所以以这三个因素作为自变量,R1作为响应值,具体的因素和水平表见表2,实验结果见表6。

表6 虾蛄肉酶解多肽提取响应面实验设计与结果Tab.6 Experimental design and the results of responsesurface analysis
用Design Expert 8.0.6软件对表6中的实验数据进行多元回归拟合,显著性检验和回归模型系数见表7。回归模型的F=23.3,其P=0.0002,表明该模型极为显著,决定系数R2=0.9677,表明回归模型与实际情况拟合性良好,可以用于酶解工艺。模型中,T、T2对R1的影响极为显著,pH对R1的影响显著,得到pH值、料液比、温度的二元回归模型方程为Y=44.6800+2.10875B+1.23375A+8.11250T–1.21500BA+0.58250BT–0.41250AT–8.33000B2–4.60000A2–6.71750T2。
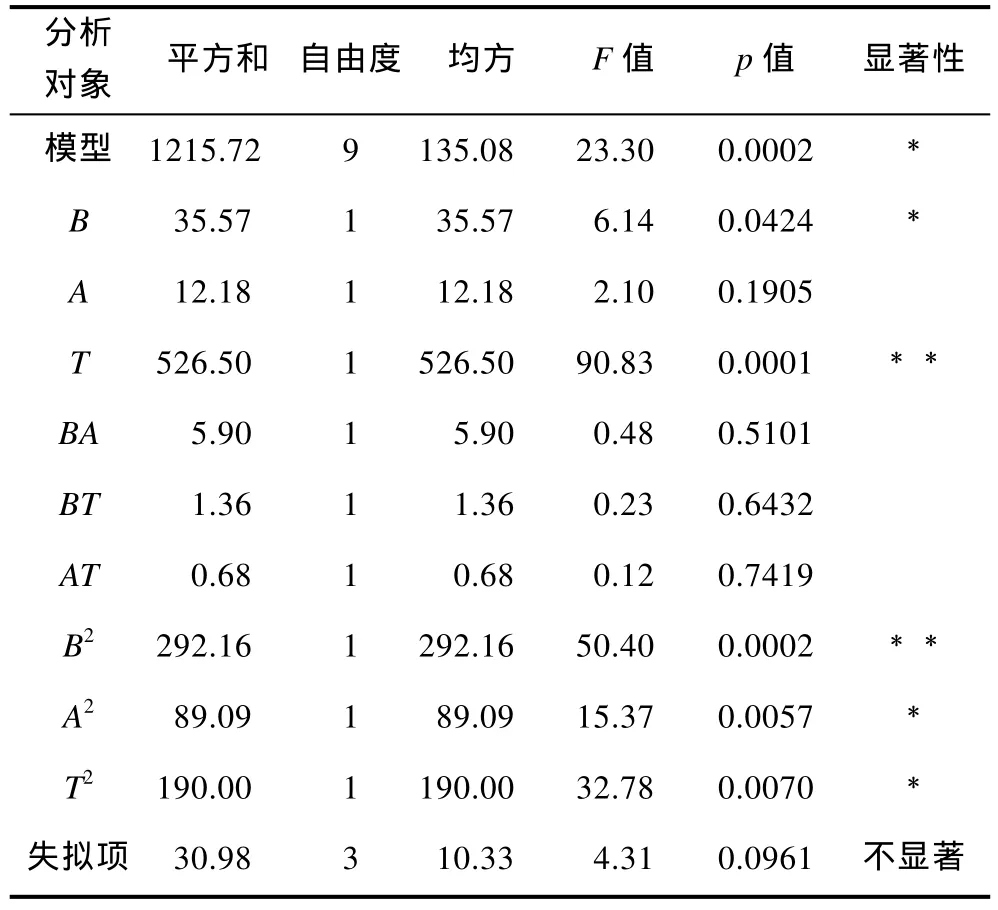
表7 响应面法方差分析(ANOVA)的分析结果Tab.7 The analysis of variance of the constructed regression model
利用软件分析各个因素的交互作用,并根据回归分析的结果绘制相应的响应面和等高线图,从图1—图3中可以看出各个因素均有极值点,对二元回归方程进行求导,用软件优化分析得到最佳的条件为B=7.070,A=1:3.09,T=51.10°C,R1=47.3466%,经验证,在响应面所得的最佳条件下得出的R1为49.02 %,与预测结果相比相对误差为 3.53%,与预测值基本相符,可以作为最佳酶解条件。
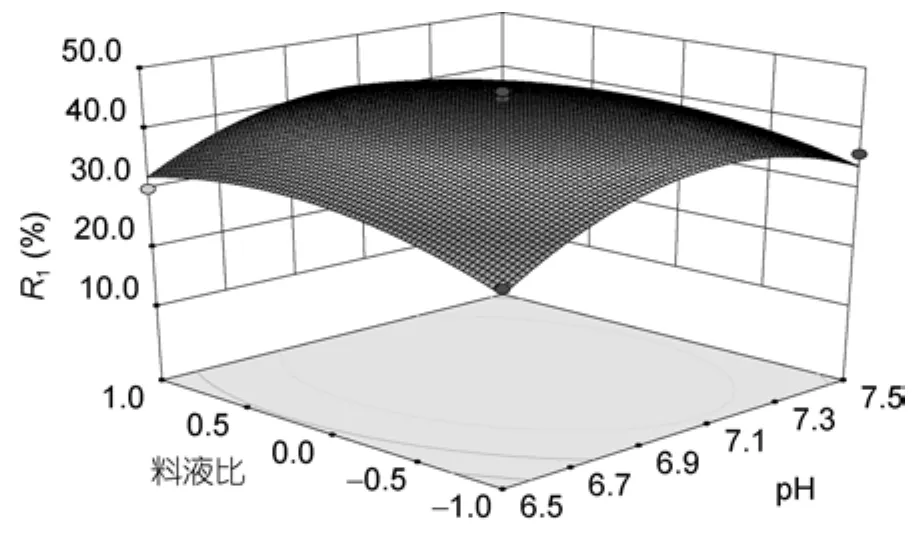
图1 pH和料液比对R1影响的响应面和等高线图Fig.1 Response surface and contour plot for the effect of cross-interaction between pH and S︰L on R1

图2 pH和温度对R1影响的响应面和等高线图Fig.2 Response surface and contour plot for the effect of cross-interaction between pH and temperature on R1

图3 料液比和温度对R1影响的响应面和等高线图Fig.3 Response surface and contour plot for the effect of cross-interaction between S︰L and temperature on R1
2.3 抗氧化肽的组成成分分析
按照 1.2.3中多肽的成分分析方法,测得虾蛄酶解多肽中水分、蛋白质、脂肪、灰分的含量见表8。

表8 原料成分含量分析Tab.8 Analysis of the ingredient of raw material
2.4 抗氧化实验结果
以0.1mg/ml维生素C作为阳性对照,R1为74.10%,R2为 38.64%,R3为 40.01%,还原力为A700为 0.265,样品超氧阴离子测定所得数据如图4和图5所示,ΔA0为0.5646,ΔA1为0.4001,R3为 29.13%,R2为88.9%,还原力A700为0.243。
3 讨论与结论
整个实验采用 L16(45)正交试验和三因素三水平的响应面分析法(牛瑞等,2011),综合分析最佳酶解工艺。在正交实验中存在3个显著因素,利用Box-Behnken设计原理设计三因素三水平的响应面分析方案,响应面法优化实验中建立的模型回归效果显著,拟合性良好,可以很好地预测实验结果,最终优化的最佳酶解条件为︰料液比1︰3.09,pH值7.07,加酶量1500u/g,温度51.10°C,时间2h。预测R1为47.3466%,经验证R1为 49.02%,与预测结果相比相对误差为 3.53 %,说明该方法可行,这可以为海洋生物提取抗氧化肽提供依据,对海洋虾蛄类生物的深加工和开发功能性食品有重要的意义。
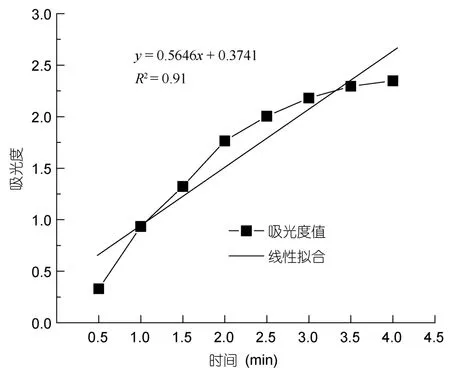
图4 对照组邻苯三酚自氧化速率Fig.4 The control group rate of pyrogallol auto-oxidation
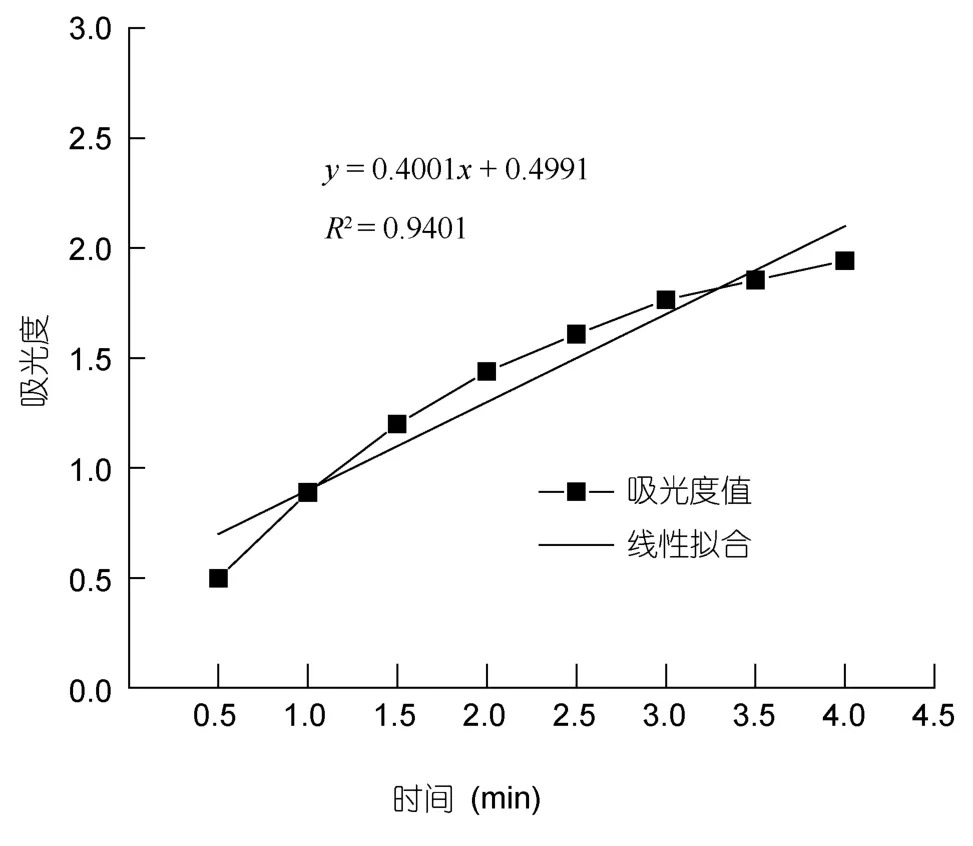
图5 样品组邻苯三酚自氧化速率Fig.5 Sample group rate of pyrogallol auto-oxidation
按照最佳条件提取得到的抗氧化肽粗品,经抗氧化能力的测定,得到R2为88.9%,R3为29.13%,还原力A700为 0.243,与维生素 C阳性对照组相比,表明虾蛄肉酶解多肽的抗氧化性较强,可以进一步对粗品进行分离纯化,利用凝胶渗透色谱、反相高效液相和质谱等分析技术获得具有较强抗氧化能力的单一多肽。
王 导,朱翠凤,2011.海洋生物活性肽的生理活性研究进展.医学综述,17(5):661—662
王静凤,王 奕,崔凤霞,2007.鱿鱼皮胶原蛋白多肽对B16黑素瘤细胞黑素合成的影响.国药理学通报,23(9):1181—1184
牛 瑞,孙 谧,于建生等,2011.扇贝裙边酶解制备抗氧化肽的实验研究.中国水产科学,18(1):214—221
许申鸿,杭 瑚,李运平,2001.超氧化物歧化酶邻苯三酚测活法的研究及改进.化学通报,8:516—519
李志英,许喜林,陈 健,2012.虎纹海参多肽酶解制备工艺及抗氧化性研究.食品研究与开发,33(6):159—161
杨 丹,何兰珍,刘 毅,2006.从虾蛄壳制备甲壳素和壳聚糖的研究.食品科学,27(12):437—438
金 鸣,蔡亚欣,李金荣等,1996.邻二氮菲-Fe2+氧化法检测H2O2/Fe2+产生的羟自由基.生物化学与生物物理进展,23(6):553—555
顾帝水,孔 霞,黄培春,2004.口虾蛄提取物对人鼻咽癌细胞基质金属蛋白酶-9的抑制作用.现代中西医结合杂志,13(21):2816—2818
操龙飞,游华军,陈子涵等,2012.响应面法优化罗非鱼鱼排蛋白分段酶解工艺.海洋与湖沼,43(6):29—32
Bersuder P,Hole M,Smith G,1998.Antioxidants from a heated histidine-glucose model system.Investigation of the antioxidant role of histidine and isolation of antioxidants by high performance liquid chromatography.J Am Oil ChemSoc,75(2):181—187
Binsan W,Benjakul S,Visessanguan Wet al,2008.Antioxidative activity of Mungoong,an extract paste,from the cephalothorax of white shrimp(Litopenaeus vannamei).Food Chem,106(1):185—193
Elmastasa M,Gulcin I,Isildak Oet al,2006.Radical scavenging activity and antioxidant capacity of bay leaf extracts.Journal of the Iranian Chemical Society,3(3):258—266
Je J Y,Park P J,Kim S K,2005.Antioxidant activity of a peptide isolated from Alaska pollack(Theragrachalcogramma)frame protein hydrolysate.Food Res Int,38:45—50
Kim S K,Kim Y T,Byun H Get al,2001.Isolation and characterization of antioxidative peptides from gelatin hydrolysate of Alaska pollack skin.J Agric Food Chem,49(4):1984—1989
Qian Z J,Jung W K,Kim S Ket al,2008.Free radical scavenging activity of a novel antioxidative peptide purified from hydrolysate of bullfrog skin,Rana catesbeiana Shaw.BioresourceTechnol,99(6):1690—1698
Shon M Y,Choi S D,Kahng G Get al,2004.Antimutagenic antioxidant and free radical scavenging activity of ethyl acetate extracts from white,yellow and red onions.Food and Chemical Toxicology,42:659—666
