经阴道超声造影对卵巢肿瘤鉴别诊断的应用研究
2014-03-08严富天胡辉明李晓莉毛亚锦
严富天,胡辉明,李晓莉,徐 丽,毛亚锦
(1.四川省广元市中心医院超声科 628000;2.四川省广元市中心医院医务科 628000;3.贵州省水城矿业集团总医院功能科,贵州六盘水553000)
卵巢肿瘤是女性生殖器官的常见疾病,其种类多,发病机制复杂,临床诊断难度较大。目前,对于无禁忌证的妇女普遍采用经阴道彩色多普勒超声检查辅助判断肿瘤的特点和性质,但是这项检查在肿瘤性质的判断及指导临床治疗方案的选择方面存在局限性[1-2]。超声造影技术是20世纪60年代逐渐发展起来的一项新型辅助检查手段,该技术不仅可以显著提高病变部位血流检测的敏感性,还能够显示微小的血流灌注情况[3-4]。本研究利用经阴道超声造影,观察不同类型的卵巢肿瘤病灶中超声造影的增强模式,并通过分析和比较病灶区域内的时间-强度曲线参数的差异,探讨经阴道超声造影在卵巢良恶性肿瘤的诊断及鉴别诊断中的应用价值,现报道如下。
1 资料与方法
1.1 一般资料 选取2010年1月至2012年12月在本院妇科收治的经阴道彩色多普勒超声提示可疑卵巢肿瘤但良恶性鉴别难度较大的患者共50例,年龄22~60岁,平均(38.4±12.7)岁。纳入标准:根据患者的妇科病史和体征,并对入选患者均行经阴道超声造影检查,并对其病变区进行时间-强度曲线(TIC)分析,且患者无严重的高血压病、心脏病史;无严重药物过敏史;无化学治疗、放射治疗病史。
1.2 主要仪器 采用Sequoia512型彩色多普勒超声诊断仪(德国西门子公司),配备有EV8-C4阴道探头(频率4.0~8.0 MHz),对比脉冲序列(CPS)实时成像软件和Axius自动跟踪对比量化(ACQ)软件,采用声诺维(Sono Vue)超声造影剂(意大利Braceo公司)。
1.3 方法
1.3.1 超声造影检查 (1)常规经阴道超声和彩色多普勒超声扫查附件区病灶,记录卵巢病变的位置、大小、边界、内部回声特点,应用彩色多普勒血流成像(CDFI)观察病变内及边界上的血流分布情况,将血流分为4级[5],即血流不明显,用“-”表示;血流稀少(1~2个点状血流信号),用“+”表示;血流较丰富(3~4个点状或1~2个条状血流信号),用“++”表示;血流丰富(大于2个条状血流信号),用“+++”表示。(2)选取肿瘤的实性部分、厚壁囊肿的壁、囊腔中含有乳头的切面及CDFI显示血供最丰富的部位作为最佳造影观察切面,进入CPS成像模式,造影时保持探头位置不变,保证机械指数(MI)小于0.16。(3)先用5.0mL生理盐水溶解造影剂,振荡混匀后抽取4.8mL经患者肘正中静脉快速注入,同时启动计时,随后用5.0mL生理盐水冲管。实时动态观察卵巢肿瘤灶内造影剂灌注的情况,持续3~5min,将该增强过程的图像保存,造影结束后进行分析;选取肿物内有显著增强且观察过程中位置较为稳定的区域,观察肿瘤内超声造影增强的情况,将其也分为4级,即增强不明显,用“-”表示;散在增强(点状信号),用“+”表示;部分增强(片状或条索状信号),用“++”表示;整体增强(信号覆盖几乎全部病灶),用“+++”表示。再用ACQ软件绘出TIC,获取卵巢肿瘤灶内造影增强的开始时间、造影剂灌注的峰值强度(PI)、达峰时间及曲线下面积(AUC)等参数。(4)所有患者在超声造影检查后均行开腹或腹腔镜探查术,根据术后病检结果确定卵巢肿瘤的最终性质。
1.3.2 诊断标准 (1)超声多普勒检查:对于附件区出现占位性病变,有血流信号增强,且形态规则,边界清楚的诊断为良性肿瘤;根据病变区域内回声,将强度均一的暗区归为囊性肿瘤,整体的增强回声区归为实性肿瘤,两者混合的为囊实性肿瘤;对于附件区的血流增强不均质,形态不规则,边界不清晰的占位诊断为恶性肿瘤[5]。(2)超声造影检查:对于造影后病变区出现囊壁环状增强信号,且囊壁形态和边界清晰的归为良性肿瘤;而造影后病变区域内部有出血坏死区,形态不规则,与周边组织分界模糊,且增强幅度明显升高的归为恶性肿瘤[6]。
1.4 统计学处理 采用SPSS18.0统计软件进行分析,计量资料以±s表示,组间比较采用独立样本t检验;计数资料以率表示,采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 卵巢肿瘤性质的鉴别与分析 术前经阴道彩色多普勒超声提示有25例呈现良性病变的血流分布,11例呈恶性病变分布,其余14例因技术原因较难鉴别;而使用经阴道超声造影,则准确显示有35例患者卵巢呈现良性病变的血流灌注,有13例患者呈恶性病变的改变;经开腹或腹腔镜手术后病理检查回示,50例患者中有36例为良性病变,14例为恶性病变。经阴道超声造影对于卵巢肿瘤性质的总体诊断准确率(96%)高于经阴道彩色超声多普勒法(72%),两者差异有统计学意义(χ2=9.003,P<0.05)。经术后分析,经阴道超声造影检查卵巢良性肿瘤病变时,有1例未能准确地显示血流灌注的情况,该例术后诊断为阔韧带肌瘤,大小约1.5cm×1.0cm×1.0 cm,与卵巢表面形成致密粘连,局部钙化明显;还有1例恶性肿瘤未能准确显示血流灌注情况,该例术后诊断为卵巢癌,卵巢表面的肿块大小约2.0cm×1.0cm,局部粘连严重,卵巢位置深在,且偏向道格拉斯窝。
2.2 不同类型、性质卵巢肿瘤经阴道超声多普勒血流特点和超声造影增强特点分析 50例不同类型和性质的卵巢肿瘤,在CDFI和造影增强检测时的特点不同。结合术后病理回示,共有36例良性肿瘤;其中囊性包块6例,其CDFI主要表现为围绕囊壁的血流信号,呈半环状或点状,而超声造影则表现为囊壁呈环状增强信号,病理结果提示卵巢子宫内膜异位囊肿5例,卵巢单纯性囊肿1例;共有囊实性包块14例,其CDFI主要表现为实性成分或乳头中呈细枝状或星点状散在的血流信号,超声造影后则表现为实性成分的整体增强和乳头结构的点状增强,肿瘤边界清楚,形态规则,其病理类型包括:卵巢囊腺瘤5例,卵巢成熟性囊性畸胎瘤5例,卵巢脓肿1例,结核1例,黄体伴出血2例;实性包块16例,其CDFI主要表现为包块内弥散或散在分布的血流信号,且无血流信号者占约半数(7/16),而超声造影可明确显示肿瘤内部树枝状、散在点状、环状或边缘点状的增强,呈类圆形或肾形,灌注强度低于周边正常的卵巢组织(图1A),病检回示:卵巢纤维瘤10例,卵巢颗粒细胞瘤3例,卵泡膜细胞瘤2例,其余1例为与卵巢表面致密粘连的阔韧带肌瘤。本研究中共有14例恶性肿瘤,其中卵巢肿瘤11例、卵巢转移癌3例,其超声特点:CDFI主要表现为肿瘤组织实性成分整体快速地或不均质的出现血流信号增强,可见粗大树状或扭曲状血管,超声造影的表现为瘤体实性部分整体、部分或点状的快速、非均质的增强信号,肿瘤内部可见出血坏死区,形态不规则,与周边组织分界模糊(图1B)。本研究中50例卵巢肿瘤的CDFI血流分布及造影剂灌注强化的特点总结,见表1。
2.3 经阴道超声造影检查的TIC分析 本研究针对每1例卵巢病变区域深入分析并用ACQ软件绘出TIC。结果提示,在造影剂注射后,恶性卵巢肿瘤增强显像的开始时间(12.9±4.5)s和达峰时间(21.7±6.6)s均分别显著早于良性肿瘤的(17.3±3.8)s和(28.4±6.9)s;而恶性肿瘤造影增强的峰值强度(19.1±4.9)dB和 TIC AUC(18.5±7.8)也分别高于良性卵巢肿瘤的(11.3±5.6)dB和(9.0±5.3),两者差异均有统计学意义(P<0.05),见表2、图2。
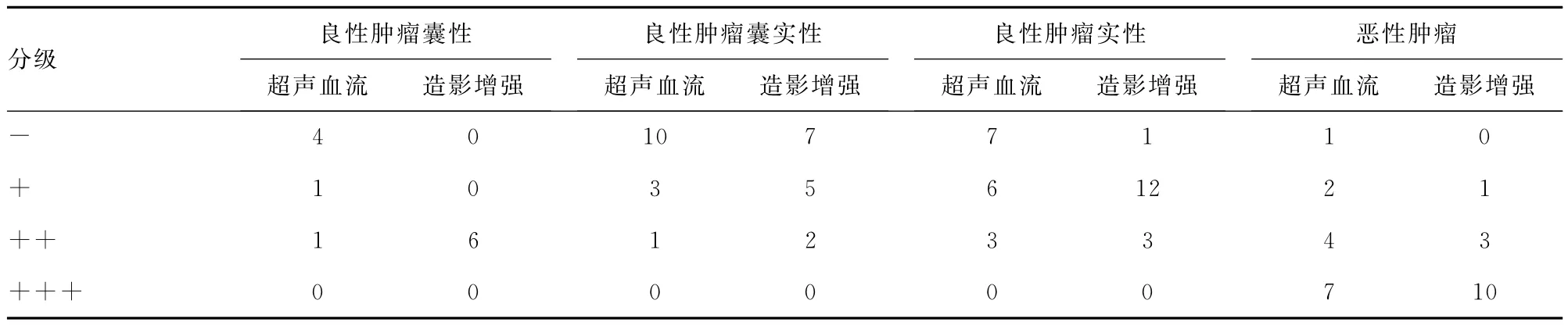
表1 卵巢肿瘤经阴道超声多普勒血流特点及经阴道超声造影增强特点(n)

图1 卵巢肿瘤经阴道超声造影增强
表2 卵巢肿瘤经阴道超声造影TIC分析(±s)

表2 卵巢肿瘤经阴道超声造影TIC分析(±s)
肿瘤性质 n 开始时间(s)曲线下36 17.3±3.8 28.4±6.9 11.3±5.6 9.0±5.3恶性 14 12.9±4.5 21.7±6.6 19.1±4.9 18.5±7.8 P<0.05 <0.05 <0.05 <0.05面积良性达峰时间(s)峰值强度(dB)

图2 经阴道超声造影检查的TIC分析
3 讨 论
卵巢肿瘤是妇科肿瘤中病理学分型最多、发病机制极为复杂的一类疾病,不同性质、不同类型的卵巢肿瘤超声的特征差异较大,使超声检测识别并鉴定肿瘤类型成为可能。既往研究表明,早期手术和辅助治疗对于卵巢恶性肿瘤患者的生存率具有明显的改善[6],因此,卵巢肿瘤的早期检出和正确的性质判定具有非常重要的临床意义[7]。卵巢恶性肿瘤的进行性增殖有赖于其血供网络的建立,瘤体内的微血管数目增多、形态不规则、血流丰富且分布不均,与良性肿瘤和正常组织的血流供应差异较大,超声影像技术可以据此对卵巢的良恶性肿瘤进行鉴别[8]。目前,经阴道彩色多普勒超声可以对大多数恶性肿瘤做出诊断,但由于该技术显示低速血流的能力较差,对于部分卵巢肿瘤中是否存在血流灌注及灌注程度的判断力有限。经阴道超声造影检查是在普通多普勒彩超基础上形成的新的影像学检测手段,由于提高了对瘤体内微小血管及低速血流的显像能力,因而对卵巢肿瘤性质的鉴别能力更强[9]。本研究应用经阴道超声造影技术对50例患者的卵巢肿瘤进行检查,发现良恶性肿瘤的血流增强特征各异,与以往国内外的报道相符,为后续临床工作的深入开展提供了资料储备,且对于肿瘤良恶性鉴别的准确性显著高于多普勒超声检查,在该领域中有推广价值[10-11]。
TIC是描述病灶组织中造影剂含量变化的重要指标,其开始时间反映了造影剂在瘤体内出现的时间,峰值强度和达峰时间分别反映了病灶血管床内造影剂微泡的最大量和达到最大量所需的灌注时间,而AUC则反映了进入病灶区域的造影剂的总量,这些均与肿瘤组织的血流灌注情况密切相关。本研究的结果提示:卵巢恶性肿瘤的峰值强度和AUC均显著大于良性肿瘤,可能是由于恶性肿瘤的血管多扭曲增粗、形成血管袢或血管网,且血管壁薄、通透性高,造影剂注入后,病灶局部血管中的微泡流速加快,导致峰值强度升高,病灶内微泡大量积累,并长时间停留,导致AUC显著增大[12]。而关于卵巢良恶性肿瘤超声造影过程中增强开始时间及达峰时间的差异,目前尚没有统一的意见,有研究认为恶性肿瘤造影后,增强开始时间和达峰时间均早于良性[13],也有研究认为两者无显著差异,可能是肿瘤的血供来源和流灌注形式不同,而且也受造影剂的注射剂量、推注速度、患者的全身因素(如心血管功能状态)等因素的干扰,因而个体差异较大[14]。根据以往的研究,恶性肿瘤的超声造影TIC总体上呈现“快进缓退”的模式,而良性肿瘤则多表现为“缓进快退”模式[15]。
与CT、MRI等其他影像学检查相比,超声造影具有较多的优点和应用价值,例如价格低廉、简便易行、无射线辐射,不受患者体内金属植入物(如宫内节育器)的影响,时间和空间分辨率也较高[2,16]。然而,超声造影也存在一定的局限性,不易区分与周围组织粘连严重的病变,对于位置较深在的病变也容易造成漏诊或误诊。因此,对于疾病的诊断必须结合患者的临床表现及相关辅助检查进行综合判断。
综上所述,与经阴道多普勒超声检查相比,经阴道超声造影能够更加敏感地显示卵巢肿瘤病灶区域的血流灌注情况,为卵巢肿瘤性质的判断提供更为丰富的影像学信息;同时,根据超声造影TIC的参数分析,可明显提高卵巢良恶性肿瘤鉴别诊断的准确性。
[1] 曹泽毅.中华妇产科学:卵巢肿瘤[M].2版.北京:人民卫生出版社,2007:2154-2167.
[2] Fleischer AC,Lyshchik A,Andreotti RF,et al.Advances in sonographic detection of ovarian cancer:depiction of tumor neovascularity with microbubbles[J].AJR Am J Roentgenol,2010,194(2):343-348.
[3] Kupesic S,Kurjak A.Contrast-enhanced,three-dimensional power Doppler sonography for differentiation of adnexal masses[J].Obstet Gynecol,2000,96(3):452-458.
[4] Saigusa S,Ohi M,Inoue Y,et al.Preoperative diagnosis by three-dimensional angiography of a leiomyosarcoma arising from the left ovarian vein[J].BMJ Case Rep,2013,2013:bcr2013008823.
[5] Sconfienza LM,Perrone N,Delnevo A,et al.Diagnostic value of contrast-enhanced ultrasonography in the characterization of ovarian tumors [J].J Ultrasound,2010,13(1):9-15.
[6] Gadducci A,Tana R,Landoni F,et al.Analysis of failures and clinical outcome of advanced epithelial ovarian cancer in patients with microscopic residual disease at secondlook reassessment following primary cytoreductive surgery and first-line platinum-based chemotherapy[J].Eur J Gynaecol Oncol,2013,34(3):213-217.
[7] Armstrong D.Update on treatment options for newly diagnosed ovarian cancer[J].Clin Adv Hematol Oncol,2010,8(10):675-678.
[8] Toh CH,Wu CH,Tsay PK,et al.Uterine artery embolization for symptomatic uterine leiomyoma and adenomyosis[J].J Formos Med Assoc,2003,102(10):701-706.
[9] Shaw D,Clamp A,Jayson GC.Angiogenesis as a target for the treatment of ovarian cancer[J].Curr Opin Oncol,2013,25(5):558-565.
[10] 刘真真,戴晴,姜玉新,等.附件区病变的超声造影时间强度曲线研究[J].中国医学影像技术,2007,23(9):1372-1375.
[11] Tombesi P,Di Vece F,Ermili F,et al.Role of ultrasonography and contrast-enhanced ultrasonography in a case of Krukenberg tumor[J].World J Radiol,2013,5(8):321-324.
[12] 王军燕,刘爱军,崔秋丽,等.卵巢肿瘤超声造影与微血管密度的相关性研究[J/CD].中华医学超声杂志:电子版,2011,8(1):103-111.
[13] Obeidat F,Mismar A,Shomaf M,et al.Gastric perforation secondary to metastasis from ovarian cancer:case report[J].Int J Surg Case Rep,2013,4(6):541-543.
[14] Fleischer AC,Lyshchik A,Jones HW 3rd,et al.Diagnostic parameters to differentiate benign from malignant ovarian masses with contrast-enhanced transvaginal sonography[J].J Ultrasound Med,2009,28(10):1273-1280.
[15] Orden MR,Jurvelin JS,Kirkinen PP.Kinetics of a US contrast agent in benign and malignant adnexal tumors[J].Radiology,2003,226(2):405-410.
[16] Carter JS,Koopmeiners JS,Kuehn-Hajder JE,et al.Quantitative multiparametric MRI of ovarian cancer[J].J Magn Reson Imaging,2013,38(6):1501-1509.
