辛伐他汀干预对大鼠肺动脉高压及其内皮祖细胞的影响*
2014-03-08刘俊峰康兴斌王华民
裴 芳,裴 华,刘俊峰,陈 植,康兴斌,黄 骥,黄 婕,王华民
(1.中国人民武装警察部队重庆市总队医院心血管内科,重庆400061;2.海南医学院免疫学教研室,海口571101;3.华北石油总医院儿科,河北任丘062552;4.首都医科大学附属北京儿童医院,北京100045)
肺动脉高压(pulmonary hypertension,PH)是一种病因各不相同的难治性恶性肺血管疾病,预后不佳,临床上目前药物治疗效果不甚理想。内皮祖细胞(endothelial progenitor cells,EPC)又称血管母细胞,是一种成年个体骨髓中的血管内皮前体细胞,它能迁移至外周血并分化成成熟血管内皮细胞,具有良好的增生潜能。近年来研究发现EPC能通过促进受损的肺动脉内皮修复及动脉重塑减低肺动脉压[1-2]。研究发现,辛伐他汀可促进EPC增殖,减少EPC凋亡,提高其迁移能力及趋化活性[3-4]。因此,本研究旨在探讨利用辛伐他汀治疗PH的可行性,现报道如下。
1 材料与方法
1.1 材料 收集24只8周龄雄性SD大鼠,体质量150~200 g,许可证号:SCXK(京)2005-0013。适应性饲养2周后,分为模型组、实验组及对照组,每组8只。
1.2 方法
1.2.1 实验方法 模型组及干预组于项背部皮下注射1%的野百合碱(monocrotaline,美国Sigma公司)50mg/kg以诱导形成PH模型[5];对照组注射等量磷酸盐缓冲液(PBS)。注射当天为第0天。实验组于第3天开始予辛伐他汀20mg/kg溶液灌胃,模型组以等量蒸馏水灌胃,直至实验结束。
1.2.2 循环EPC含量测定 第21天各组大鼠经尾静脉取血,予乙二胺四乙酸抗凝后取0.1mL,加入2μL小鼠抗大鼠血管内皮细胞生长因子受体-2(VEGFR-2)抗体(美国Santa Cruz公司),孵育15min,经红细胞裂解、PBS洗涤离心后,再加入5μL异硫氰酸荧光素(FITC)标记的山羊抗小鼠IgG(美国Santa Cruz公司),避光孵育15min,PBS洗涤离心后,依次加入5μL藻红素标记的小鼠抗大鼠CD34抗体(PE-CD34)、别藻蓝素标记的小鼠抗大鼠CD45抗体(APC-CD45,美国BD公司)避光孵育15min,PBS洗涤离心后,应用流式细胞仪计数每100 000个单个核细胞中CD34+VEGFR-2+CD45-的EPCs所占的比例。
1.2.3 心肺指标测定
1.2.3.1 右心室收缩压测定 经静脉采血后的大鼠以10%水合氯醛(3mL/kg)腹腔注射麻醉,自右侧颈外静脉插管至右心室,应用PM-8000型多参数监护仪测定右心室收缩压,以此间接反映肺动脉压力。
1.2.3.2 观察肺组织及肺血管病理变化 大鼠断头处死,分离右下肺叶,10%多聚甲醛固定,石蜡包埋,切片,HE染色,光镜下观察大鼠肺组织病理变化,并应用Leica QWinV3图像分析系统测量与终末细支气管伴行的小动脉管壁中膜厚度(MT)与血管外径(ED)的比值(MT/ED)、管腔面积(VA)与血管总面积(TAA)的比值(VA/TAA)。
1.2.4 循环EPC的体外培养及功能监测
1.2.4.1 循环EPC的体外培养 将经尾静脉采集的外周血,以淋巴分离液经密度梯度离心法获得单个核细胞,加入含5%胎牛血清(FBS)的内皮细胞生长培养基-2(EGM-2,瑞士Lonza公司),以2×106个/mL密度将细胞接种于纤维连接蛋白(美国Hematological Technologies公司)包被的24孔板中,每只大鼠设2个孔,置37℃、5%CO2。培养箱孵育,3d后以PBS洗去未贴壁细胞,更换新的培养液,以后隔日半量换液。
1.2.4.2 循环EPC的免疫荧光鉴定 细胞培养7d后,分别取1孔细胞加入Dil标记的乙酰化低密度脂蛋白(美国Molecular Probes公司)至终浓度5mg/L。继续孵育4h,吸弃培养液,用2%多聚甲醛固定细胞20min,PBS反复浸洗后,加入含5mg/L FITC标记的血凝素(美国Sigma公司)的PBS 0.5 mL,37℃孵育1h,PBS浸洗后予90%中性甘油封片,于共聚焦显微镜下观察。显示红色荧光者为Dil标记的乙酰化低密度脂蛋白阳性细胞,显示绿色荧光者为FITC标记的血凝素阳性细胞,双荧光阳性细胞被认为是EPC。
1.2.4.3 流式细胞仪检测EPCs特异性表面标志CD34、VEGFR-2表达情况体外培养的EPC于第14天各取1孔细胞应用0.25%胰酶消化细胞制备单细胞悬液,调整细胞密度为2×106个/mL,取0.1mL,加人2μL小鼠抗大鼠VEGFR-2抗体,孵育15min,经PBS洗涤离心后,再加入5μL FITC标记的山羊抗小鼠IgG,避光孵育15min,PBS洗涤离心后,加入5 μL PE-CD34,避光孵育15min,经PBS洗涤离心后,应用流式细胞仪检测EPCs相对特异性表面标志CD34、VEGFR-2的表达情况。
1.2.4.4 细胞增殖能力检测 将消化的EPC调整细胞密度为1×105个/mL,取0.2mL接种于预先铺有纤维连接蛋白的96孔板中,置于37℃、5%CO2培养箱培养96h,每孔加入20 μL四甲基偶氮唑蓝(5mg/mL,美国Duchfo公司),培养4h后加入100μL二甲基亚砜,应用酶标仪检测其在570nmol/L处的吸光度。
1.2.4.5 细胞黏附能力检测 将消化的EPC调整细胞密度为5×104个/mL,取1mL接种于预先铺有纤维连接蛋白的24孔板中,置37℃、5%CO2。培养箱中培养30min,以PBS冲洗3遍去除未贴壁细胞,200倍相差显微镜下选择3个不同视野进行细胞计数,取平均值。
1.2.4.6 细胞迁移能力检测 孔径为8μm的插入式培养皿置于24孔板中,在插入式培养皿外加入0.6mL含5.0%FBS的EGM-2,将消化的EPC应用含0.1%FBS不含细胞因子的EBM-2重新调整至细胞密度为5×105个/mL,取0.1mL加于皿内。37℃、5%CO2:培养箱培养24h后,取出插入式培养皿,用棉签擦净滤膜上层的细胞,应用4%多聚甲醛将膜下层细胞固定20min,PBS反复浸洗干燥后,经0.1%结晶紫染色,200倍相差显微镜下选择3个不同视野进行细胞计数,取平均值。
1.3 统计学处理 采用SPSS17.0统计软件进行分析。正态分布的计量数据以±s表示,多组样本之间的比较采用单因素方差分析,组间两两比较采用LSD检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 一般情况观察 模型组大鼠于第10天起较对照组大鼠活动明显减少,进食减少,体毛杂乱无光泽,呼吸急促。干预组大鼠除活动略有减少外,呼吸、进食及体毛情况均较对照组无明显的变化。
2.2 肺动脉压力及局部病变的比较 与对照组相比,模型组大鼠RVSP明显升高,且肺小动脉血管内皮细胞损伤明显。血小板黏附在损伤的内皮细胞及裸露的基底膜上,可见淋巴细胞浸润,肌型小动脉中膜厚度显著增加,MT/ED比值增大。管腔狭窄,甚至闭塞,VA/TAA比值减小。同时,与模型组相比,干预组大鼠RVSP明显降低,已接近对照组水平。肺部病变也相对较轻,MT/ED及VA/TAA比值明显改善并趋于正常,见图1、表1。
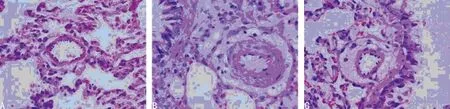
图1 不同组别大鼠肺组织病理表现(HE,×400)
表1 不同组别大鼠肺动脉压力指标的比较(±s)

表1 不同组别大鼠肺动脉压力指标的比较(±s)
a:P<0.01,与模型组比较。
?
2.3 循环EPCs数量及功能的比较
2.3.1 循环EPCs数量的变化 流式细胞仪检测显示,模型组大鼠循环EPCs在外周血单核细胞中所占比例(0.017±0.008)%较对照组(0.036±0.014)%明显减低(P<0.01)。干预组循环EPCs数量(0.039±0.012)%较模型组及对照组均明显增加(P<0.01)。
2.3.2 EPCs的体外生长情况 培养后7d,外周血单个核细胞可以见到大量梭形细胞(图2A),其具有结合FITC-lectin(图2B、2D)及吞噬Dil-acLDL(图2C、2D)的特性。模型组中同时结合FITC-lectin和吞噬Dil-acLDL双阳性细胞所占的比例(80.25±6.34)%较对照组(87.92±6.74)%略少(P<0.05)。干预组双阳性细胞的比例(88.05±6.92)%较模型组明显增多(P<0.05),与对照组差异无统计学意义(P>0.05)。

图2 循环EPC的培养及免疫荧光鉴定(×100)
2.3.3 EPC表面分子的表达 培养至第14天,模型组外周血单个核细胞CD34、VEGFR-2的表达明显低于对照组(P<0.01);而干预组表达显著上调,明显高于模型组(P<0.01),且与对照组比较差异无统计学意义(P>0.05),见表2。
表2 不同组别循环EPC表面分子表达的比较(±s,%)

表2 不同组别循环EPC表面分子表达的比较(±s,%)
a:P<0.01,与模型组比较;b:P>0.05,与对照组比较。
组别CD34 VEGFR-2对照组 30.17±4.62a 50.68±5.16a模型组 17.35±3.52 32.93±4.72干预组 31.62±4.86ab 49.75±5.04ab
2.3.4 EPC功能的变化 比较循环EPC在体外培养状态下的增殖、黏附、迁移能力,模型组与对照组比较均有所下降(P<0.01)。干预组各项功能指标较模型组显著上调(P<0.01),且与对照组比较差异无统计学意义(P>0.05),见表3。
表3 不同组别循环EPC功能指标的比较(±s)

表3 不同组别循环EPC功能指标的比较(±s)
a:P<0.01,与模型组比较;b:P>0.05,与对照组比较。
组别 增殖能力(OD值)黏附能力(细胞个数/HPF)迁移能力(细胞个数/HPF)对照组 0.65±0.08a 12.23±2.12a 13.19±2.67a模型组 0.44±0.05 7.35±1.68 7.36±2.13干预组 0.62±0.07ab 11.73±2.06ab 12.78±2.72ab
3 讨 论
PH是以肺血管阻力渐进性增加、右心后负荷渐进性增加、最终导致右心衰竭为特征的恶性疾病。近十余年来,虽然波生坦、西地那非等靶向药物的应用使得PH的临床症状能够在一定程度上得到改善,但远期预后依旧不佳。有研究认为,血管内皮细胞过度凋亡所引起的内皮损伤是PH的触发因素和起始环节[6-8]。因此,从病理基础角度来说,尽早修复受损的血管内皮,防止血管功能障碍的发生及血管重构将有可能从根本上阻止PH的进程,从而达到对PH治疗的目的。研究表明,EPC在血管内皮细胞损伤后的修复及维持正常功能方面都起着重要作用[9-10]。PH急性期循环EPC数量明显增加,而对于已经发生血管重构的病例,其循环EPC的数量及活性存在明显下降[11-13]。本实验结果显示,与对照组比较,模型组大鼠外周血中EPC的数量显著减少,其表面CD34、VEGFR-2的表达及各项功能指标也发生了明显的下调。在组织病理方面,模型组大鼠肺小动脉血管内皮细胞损伤明显、管壁增厚、管腔狭窄及肺循环压力增高。这说明PH的形成确实与EPC的数量及功能有关。
他汀类药物具有良好的调脂作用,在胆固醇水平相当的情况下,他汀类药物能显著降低心血管事件发生率。此外,他汀类药物还具有促进血管新生和内皮损伤后的修复作用。近年来,随着研究的深入,人们逐渐发现了他汀类的很多非干细胞的生物学作用。有研究报道,他汀类能增加EPC的增殖、迁移及分化,有利于改善EPC的功能,以实现血管损伤的修复及通过血管生成来增加和改善缺血区域的血液供应。本研究显示,干预组大鼠于实验第21天时,其循环EPC的数量较模型组增多,与对照组比较也在相对较高水平。在体外培养状态下,干预组EPC表面CD34、VEGFR-2的表达及增殖、黏附、迁移能力比模型组有显著上调,相应地,其肺小动脉的病变及肺循环压力的增高也得到了改善。这说明辛伐他汀对PH有一定的治疗效果。
综上所述,辛伐他汀能明显地增加循环EPC的数量,改善EPC的功能,达到促进血管新生和受损血管内皮修复的作用,以便在肺动脉内皮损伤的早期即有效地完成修复工作,维持内皮正常的结构和功能,防止因血管的舒张功能受损和平滑肌细胞、成纤维细胞过度增殖而造成的血管重构,达到对PH的治疗目的。然而,由于辛伐他汀治疗过程中的具体信号转导途径、EPC参与局部损伤修复的具体作用方式及机制尚不完全明了,因此应用辛伐他汀治疗PH尚需要对其远期疗效和可能存在的问题进行更加深入地研究和评估。
[1] Gallagher KA,Liu ZJ,Xiao M,et al.Diabetic impairments in NO-mediated endothelial progenitor cell mobilization and homing are reversed by hyperoxia and SDF-1alpha[J].J Clin Invest,2007,117(5):1249-1259.
[2] Nagaya N,Kangawa K,Kanda M,et al.Hybrid cell-gene therapy for pulmonary hypertension based on phagocytosing action of endothelial progenitor cells[J].Circulation,2003,108(7):889-895.
[3] Werner N,Junk S,Laufs U,et al.Intravenous transfusion of endothelial progenitor cells reduces neointima formation after vascular injury[J].Circ Res,2003,93(2):e17-24.
[4] Griese DP,Ehsan A,Melo LG,et al.Isolation and transplantation of autologous circulating endothelial cells into denuded vessels and prosthetic grafts:implications for cell-based vascular therapy[J].Circulation,2003,108(21):2710-2715.
[5] Liu JF,Du ZD,Chen Z,et al.Granulocyte colony-stimulating factor attenuates monocrotaline-induced pulmonary hypertension by upregulating endothelial progenitor cells via the nitric oxide system[J].Exp Ther Med,2013,6(6):1402-1408.
[6] Song Y.Association study of circulating endothelial progenitor cells and plasma prostacyclin levels in pulmonary hypertension rats[J].Genet Mol Res,2014,13(1):438-444.
[7] Qiao L,Nishimura T,Shi L,et al.Endothelial fate mapping in mice with pulmonary hypertension[J].Circulation,2014,129(6):692-703.
[8] Levy M,Bonnet D,Mauge L,et al.Circulating endothelial cells in refractory pulmonary hypertension in children:markers of treatment efficacy and clinical worsening[J].PLoS One,2013,8(6):e65114.
[9] Lin CP,Lin FY,Huang PH,et al.Endothelial progenitor cell dysfunction in cardiovascular diseases:role of reactive oxygen species and inflammation[J].Biomed Res Int,2013,2013:845037.
[10] Yang JX,Pan YY,Zhao YY,et al.Endothelial progenitor cell-based therapy for pulmonary arterial hypertension[J].Cell Transplant,2013,22(8):1325-1336.
[11] Diller GP,van Eijl S,Okonko DO,et al.Circulating endothelial progenitor cells in patients with Eisenmenger syndrome and idiopathic pulmonary arterial hypertension[J].Circulation,2008,117(23):3020-3030.
[12] Junhui Z,Xingxiang W,Guosheng F,et al.Reduced number and activity of circulating endothelial progenitor cells in patients with idiopathic pulmonary arterial hypertension[J].Respir Med,2008,102(7):1073-1079.
[13] Marsboom G,Pokreisz P,Gheysens O,et al.Sustained endothelial progenitor cell dysfunction after chronic hypoxia-induced pulmonary hypertension[J].Stem Cells,2008,26(4):1017-1026.
