重组人粒细胞集落刺激因子对脑缺血再灌注大鼠大脑皮质蛋白质的影响
2014-03-07刘宝华沙莹白光辉李勇邬伟商萍王小同
刘宝华,沙莹,白光辉,李勇,邬伟,商萍,王小同
(1.温州医科大学附属第二医院 康复中心,浙江 温州 325027;2.吉林大学第一医院 干部病房,吉林长春 130021;3.温州医科大学附属第二医院 影像科,浙江 温州 325027;4.温州医科大学附属第二医院 神经内科,浙江 温州 325027)
·论 著·
重组人粒细胞集落刺激因子对脑缺血再灌注大鼠大脑皮质蛋白质的影响
刘宝华1,沙莹2,白光辉3,李勇4,邬伟4,商萍1,王小同1
(1.温州医科大学附属第二医院 康复中心,浙江 温州 325027;2.吉林大学第一医院 干部病房,吉林长春 130021;3.温州医科大学附属第二医院 影像科,浙江 温州 325027;4.温州医科大学附属第二医院 神经内科,浙江 温州 325027)
目的:研究造血干细胞动员剂重组人粒细胞集落刺激因子(rhG-CSF)对脑缺血神经系统具有保护作用的蛋白质组学机制。方法:本实验利用脑缺血再灌注大鼠模型(tMCAO模型)在再灌注2 h后颈部皮下注射rhG-CSF,在灌注后14 d提取大脑皮质蛋白进行双向电泳。结果:缺血再灌注损伤(模型组)大鼠与假手术组大鼠比较,筛选到56个差异表达蛋白质点,其中17个上调,39个下调,应用基质辅助激光解吸电离飞行时间质谱仪(MALDI-TOF-MS)得到肽质量指纹图,输入美国国立生物技术信息中心(NCBI)蛋白质数据库进行检索,并在Swiss-Prot数据库中进一步验证,鉴定出其中19个为已知蛋白质。而经过人粒细胞集落刺激因子(G-CSF)治疗(G-CSF治疗组)大鼠与模型组大鼠比较,筛选出35个蛋白质点,其中16个下调,19个上调,其中鉴定为已知蛋白质的有6个,分别为二氢嘧啶酶相关蛋白2、胶质纤维酸性蛋白、内皮黏蛋白、Rho GDP解离抑制因子、Rab GDP解离抑制因子、鸟嘌呤核苷酸结合蛋白。结论:脑缺血后大鼠脑组织蛋白质表达发生变化,G-CSF在脑缺血亚急性期可能通过调节多种神经再生相关蛋白质的表达,参与保护脑缺血的神经元。
粒细胞集落刺激因子;脑缺血;蛋白质组;神经再生;大鼠
重组人粒细胞集落刺激因子(recombinate human granulocyte colony-stimulating factor,rhGCSF)具有促进粒细胞增殖分化,增加外周血中粒细胞的数目和功能,动员造血干细胞进入到外周循环的功能[1],临床已应用于骨髓移植[2]、粒细胞减少症[3]及感染性疾病[4]的治疗。研究证实粒细胞集落刺激因子(G-CSF)可以保护缺血脑组织[5-6],应用G-CSF治疗的局灶性脑缺血大鼠脑梗死面积明显降低、存活率增加[7],其可能通过抗凋亡、抗炎、促进血管神经发生、动员造血干细胞入脑等多种途径发挥作用[8],但具体作用机制尚未完全明确。因此,本实验应用蛋白质组学的方法,进一步在蛋白质水平探索rhG-CSF保护脑缺血神经组织的作用机制,为rhG-CSF更好地应用于缺血性脑血管疾病的临床治疗,提供理论基础。
1 材料和方法
1.1 实验动物及分组 清洁级健康8~10周龄雄性SD大鼠24只,体质量220~250 g,由吉林大学实验动物中心提供,室温分笼饲养,自由摄食及饮水,随机分为假手术大鼠(假手术组)8只,右侧大脑缺血再灌注损伤大鼠(模型组)8只,脑缺血再灌注后经rhG-CSF干预治疗的大鼠(G-CSF治疗组)8只,各组间暴露因素无差异。实验对动物的处理方法符合中华人民共和国科学技术部颁布的《关于善待实验动物的指导性意见》。
1.2 药物及主要仪器 rhG-CSF(国药准字S2006 3034),由长春金磊药业有限责任公司提供。等电聚焦仪(美国Amersham Biosciences公司),Image Scanner光学扫描仪(瑞典Pharmacia Biotech公司),Ettan picker斑点切胶仪(美国Amersham Biosciences公司,Pittsburgh,Pennsylvania),Ettan digester酶切仪(美国Amersham Biosciences公司),基质辅助激光解吸电离飞行时间质谱仪(MALDI-TOFMS,美国Amersham Biosciences公司)。
1.3 模型制作方法 根据Hayashi等[9]的方法建立大鼠短暂性大脑中动脉栓塞(transient middle cerebral artery occlusion,tMCAO)模型(脑缺血再灌注模型)。大鼠用10%水合氯醛(0.35 mL/100 g)腹腔注射麻醉后,颈部腹侧正中皮肤切口,分离出右侧颈总动脉(CCA)、颈外动脉(ECA)及颈内动脉(ICA),结扎ECA远端后,在近端插入直径约0.5 mm钝头尼龙线,经ICA到达大脑中动脉起始部。阻断右侧大脑中动脉,90 min后,把尼龙线拔出、ECA结扎,逐层缝合切口。模型建立后3 d内给予庆大霉素20 000 U腹腔注射。大鼠清醒后参照Longa等[10]的方法进行神经功能评定:0分,无神经缺损;1分,不能伸展对侧前肢;2分,向偏瘫侧转圈;3分,行走时向偏瘫侧跌倒;4分,意识丧失,不能自发行走。0分和4分动物剔除出实验。假手术组栓线仅进入ICA起始处,其余步骤相同。C-CSF治疗组在再灌注2 h后给予rhG-CSF 50μg·kg-1·d-1[11],连续5 d,颈部皮下注射,假手术组与模型组予相同方法皮下注射同等剂量的0.9%氯化钠溶液。各组均在再灌注后14 d时断头处死,冰上剥离缺血侧(右侧)大脑皮层。
1.4 蛋白质样本制备与定量 将各组右侧大脑皮质与液氮混合,在研钵中磨制成粉末,加入已预冷的玻璃匀浆器中,按1∶3.5比例加入样品裂解液{2 mol/L硫脲、7 mol/L尿素、40 mmol/L Tris-base、二硫苏糖醇、4% 3-[(3-胆酰胺丙基)-乙二胺]-1-丙磺酸CHAPS、10 mmol/L二硫苏糖醇、1 mmol/L苯甲基磺酰氟、1 mmol/L EDTA}后放在4 ℃冰浴中匀浆,以150 000×g超速离心60 min;吸取上清液,再以40 000×g离心45 min,用Bradford[12]的方法测定蛋白质浓度,分装于-80 ℃保存。
1.5 蛋白质双向凝胶电泳 第一向为固相pH等电聚焦电泳,选17 cm固相pH梯度干胶条(pH 3~10,NL),采用胶内泡胀法,样品和再水化液{8 mol/L尿素、2%(W/V)3-[(3-胆酰胺丙基)-乙二胺]-1-丙磺酸、20 mmol/L DTT(用前加)、2%固相pH梯度干胶条缓冲液、少量溴酚蓝}共350μL,上样1.2 mg。聚焦槽放于等电聚焦仪上,设置聚焦参数(30 V,12 h;200 V,1 h;500 V,1 h;1 000 V,1 h;5 000 V,1 h;8 000 V,10 h),总Vhrs为80 000[13]。等电聚焦电泳后,固相pH梯度干胶条取出,分别在SDS平衡液[6 mol/L尿素、2% SDS、50 mmol/L Tris-HCl(pH 8.8)、30%甘油、少量溴酚蓝,a∶10 mL平衡缓冲液加100 mg DTT;b∶10 mL平衡缓冲液加250 mg碘乙酰胺]中平衡1次,约15 min。后转入SDS-PAGE胶上,进行第二向电泳,参数设置(恒流20 mA,40 min;30 mA,4 h),溴酚蓝前沿至阳极约5 mm时停止电泳[14]。
1.6 凝胶染色 采用硝酸银染色方法,固定2 h(冰醋酸30 mL、甲醇150 mL、甲醛0.15 mL,并加入超纯水使容积达300 mL),硫代硫酸钠敏化2 min,超纯水漂洗3×5 min,银染25 min,漂洗3×1 min,Na2CO3显色0~8 min,甲醇冰醋酸混合液终止10 min。
1.7 图像分析 每组样品常规进行3次二维电泳,染色的凝胶利用Image Scanner光学扫描仪扫描并备份凝胶图像,用ImageMaster 2D Labscan V3.1软件(GE,Ann Arbor,Michigan,USA)进行图像分析,采用假手术组作为参考标准,其他组凝胶与之匹配,以蛋白表达水平上调或下调150%为目标点,寻找差异蛋白质点并进行质谱鉴定。
1.8 蛋白质鉴定 采用斑点切胶仪切取制备胶上匹配的差异蛋白点。r酶切仪对切取的胶块进行胰蛋白酶酶切,37 ℃下作用2 h,用50%乙腈-0.1%三氟乙酸溶液60μL溶解并提取肽段。Ettan spotter吸取0.3μL多肽样品与等体积a-氰基-4-羟基肉桂酸混匀后点样。应用MALDI-TOF-MS计算肽质量指纹图谱。将所得到的肽质量指纹谱输入美国国立生物技术信息中心(NCBI)蛋白质数据库(http∶//www. ncbi.nlm.nih.gov/protein)进行检索,鉴定的基本条件是覆盖率>20%,期望值<0.05。所得的肽段质量数在Swiss-Prot数据库(http∶//us.expasy. org/sprot)中检索,进行验证。
2 结果
2.1 蛋白质定量 Bradford法测得蛋白线性方程为y=0.0098x+0.2666,相关系数R2=0.7857,在595 nm处测定各组样品的吸光度,求出蛋白质浓度:假手术组15.6μg/μL,模型组14.3μg/μL,G-CSF治疗组16.1μg/μL。
2.2 双向凝胶电泳图谱 取等量假手术组、模型组及G-CSF治疗组大鼠缺血侧(右侧)大脑皮质蛋白质分别行双向电泳分离,经过图像分析,可以分辨出1 000个左右的蛋白质点(见图1)。

图1 大鼠大脑皮质蛋白质双向电泳凝胶图谱(硝酸银染色)
G-CSF治疗组与模型组比较有35个差异蛋白点,表达下调16个,表达上调19个;模型组和假手术组比较有56个差异蛋白质点,表达下调39个,表达上调17个(见图2)。具有代表性的差异蛋白质点局部见图3。
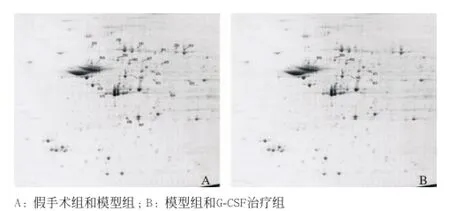
图2 不同组差异蛋白的分布
2.3 质谱鉴定 将所得到的肽质量指纹谱,输入NCBI数据库进行检索,并在Swiss-Prot数据库中验证,模型组与假手术组比较差异蛋白质点19个,表达上调12个,表达下调7个。表达上调的蛋白质为14-3-3蛋白、苹果酸脱氢酶、抑制素、异柠檬酸脱氢酶、热休克蛋白5前体、烯醇(化)酶、脑型肌酸激酶同功酶、泛醌-细胞色素C还原酶、胶质纤维酸性蛋白、ATP合酶、琥珀酸脱氢酶复合体亚单位A、热休克蛋白72。表达下调的蛋白质包括:Rho GDP解离抑制因子、肌动蛋白、Rab GDP解离抑制因子、内皮黏蛋白前体、内皮黏蛋白、鸟嘌呤核苷酸结合蛋白、二氢嘧啶酶相关蛋白2。G-CSF治疗组与模型组比较鉴定保护差异蛋白质6个,均表达上调(见图4)。差异蛋白质为Rho GDP解离抑制因子、二氢嘧啶酶相关蛋白2、Rab GDP解离抑制因子、内皮黏蛋白、胶质纤维酸性蛋白、鸟嘌呤核苷酸结合蛋白。

图3 各组间二氢嘧啶酶相关蛋白2(503号蛋白点)的差异表达

图4 肽质量指纹谱图(鉴定成功的6种G-CSF治疗组与模型组差异蛋白质)
3 讨论
G-CSF是骨髓造血细胞生长因子,存在于神经元和胶质细胞上,后者有粒细胞集落刺激因子受体(GCSFR)表达,外源性G-CSF可以通过血脑屏障,与神经细胞膜上的G-CSFR结合,在中枢神经系统发挥重要作用,与许多神经系统疾病有密切关系[15]。脑缺血时,G-CSF能提高外周血干细胞数量,促进缺血环境中干细胞向神经细胞分化,修复受损缺血低氧神经细胞,并有抗炎症及抗凋亡作用,促进神经功能的恢复[16]。随着蛋白质组学技术不断发展成熟,蛋白质水平的实验研究在揭示神经系统疾病的发病机制、诊疗用药方面体现出巨大潜力。由于G-CSF生物活性在体内外有很大区别,稳定性差,因此,本实验利用基因重组技术生产的rhG-CSF为实验用药,将蛋白质组技术应用于G-CSF脑保护机制研究中,为G-CSF应用于缺血性脑血管病提供蛋白质组学资料。
本实验建立正常SD大鼠脑组织蛋白质组蛋白质双向凝胶电泳图像,通过图像分析技术和计算机软件对蛋白质图像进行分析,模型组与假手术组比较表达上调的蛋白质为14-3-3蛋白、苹果酸脱氢酶、抑制素、异柠檬酸脱氢酶、热休克蛋白5前体、烯醇(化)酶、脑型肌酸激酶同功酶、泛醌-细胞色素C还原酶、胶质纤维酸性蛋白、ATP合酶、琥珀酸脱氢酶复合体亚单位A、热休克蛋白72。模型组大鼠中间代谢酶类苹果酸脱氢酶、异柠檬酸脱氢酶、琥珀酸脱氢酶复合体亚蛋白A、ATP合酶β亚基、烯醇化酶均表达上调,提示脑缺血能量代谢发生障碍,脑组织中ATP合酶活性的改变是神经元细胞质膜损害的标志,也是神经元继发损伤的重要环节[17]。脑肌酸激酶是在脑内催化ATP和肌酸转化为ADP和磷酸肌酸的特殊同工酶,脑缺血再灌注损伤后脑肌酸激酶释放增加可能是自体保护增加能量释放的体现。脑缺血再灌注损伤后可出现细胞凋亡,泛醌-细胞色素C还原酶是电化学潜能的呼吸链的组成成分。14-3-3蛋白参与神经细胞生长、分裂、分化、凋亡等生理病理过程[18],14-3-3蛋白及热休克蛋白72在脑缺血后表达上调,可能是脑缺血再灌损伤后神经细胞凋亡及再生的表现,提示缺血后氧化应激反应增强,脑缺血保护机制启动。二氢嘧啶酶相关蛋白可以通过调节微管的生成促进轴突生长和髓鞘稳定[19],内皮黏蛋白在肿瘤的血管发生中发挥作用[20],二者在模型组表达下调,G-CSF治疗组表达上调,提示G-CSF治疗后可能新生血管增多,轴突生长,从而起到促进神经功能恢复的作用。鸟嘌呤核苷酸结合蛋白、Rab GDP解离抑制因子、Rho GDP解离抑制因子在脑缺血发生后均表达变少,而在GCSF治疗组均有增多,但是由于它们具有多种生物学效应,推测这三种蛋白质可能在G-CSF治疗后能促进信号转导。
综上所述,本实验将蛋白组技术应用于脑缺血再灌注损伤,发现经G-CSF治疗后缺血再灌注损伤大鼠大脑皮层相关蛋白质改变,提示G-CSF对缺血性脑血管治疗作用与其能调节多种神经再生相关蛋白质的表达有关,但具体调节机制尚需进一步研究。
[1] Huang HQ, Wang XX. Advances in new clinical application of recombinant human granulocyte-macrophage colonystimulating factor[J]. Zhonghua Xue Ye Xue Za Zhi, 2012, 33(5): 429-431.
[2] Zhang XH, Huang XJ, Liu DH, et al. Randomized clinical study for two types of recombinant human granulocyte colony-stimulating factor mobilizing peripheral blood and bone marrow stem cells in patients receiving allogeneic hematopoietic stem cell transplantation[J]. Zhonghua Yi Xue Za Zhi, 2009, 89(30): 2116-2119.
[3] Gunzer K, Clarisse B, Lheureux S, et al. Contribution of glycosylated recombinant human granulocyte colony-stimulating factor (lenograstim) use in current cancer treatment: review of clinical data[J]. Expert Opin Biol Ther, 2010, 10 (4): 615-630.
[4] Gathwala G, Walia M, Bala H, et al. Recombinant human granulocyte colony-stimulating factor in preterm neonates with sepsis and relative neutropenia: a randomized, singleblind, non-placebo-controlled trial[J]. J Trop Pediatr, 2012, 58(1): 12-18.
[5] Lee WT. Potential application of granulocyte-colony stimulating factor in the treatment of neurological diseases[J]. Pediatr Neonatol, 2013, 54(6): 353-354.
[6] Ringelstein EB, Thijs V, Norrving B, et al. Granulocyte colony-stimulating factor in patients with acute ischemic stroke: results of the AX200 for Ischemic Stroke trial[J]. Stroke, 2013, 44(10): 2681-2687.
[7] Comim CM, Rezin GT, Scaini G, et al. Mitochondrial respiratory chain and creatine kinase activities in rat brain after sepsis induced by cecal ligation and perforation[J]. Mitochondrion, 2008, 8(4): 313-318.
[8] England TJ, Gibson CL, Bath PM. Granulocyte-colony stimulating factor in experimental stroke and its effects on infarct size and functional outcome: A systematic review[J]. Brain Res Rev, 2009, 62(1): 71-82.
[9] Hayashi T, Abe K, Itoyama Y. Reduction of ischemic damage by application of vascular endothelial growth factor in rat brain after transient ischemia[J]. J Cereb Blood Flow Metab, 1998, 18(8): 887-895.
[10] Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91.
[11] 田沈, 林佳才, 张朝东. rhG-CSF对糖尿病及非糖尿病大鼠缺血性脑卒中预后及神经生长因子表达的影响[J]. 华西药学杂志, 2012, 27(4)∶ 404-406.
[12] Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal Biochem, 1976, 72(7): 248-254.
[13] Görg A, Obermaier C, Boguth G, et al. The current state of two-dimensional electrophoresis with immobilized pH gradients[J]. Electrophoresis, 2000, 21(6): 1037-1053.
[14] Sauer K, Camper AK. Characterization of phenotypic changes in Pseudomonas putida in response to surface-associated growth[J]. J Bacteriol, 2001, 183(22): 6579-6589.
[15] Schneider A, Kruger C, Steigleder T, et al. The hematopoietic factor G-CSF is a neuronal ligand that counteracts programmed cell death and drives neurogenesis[J]. J Clin Invest, 2005, 115(8): 2083-2098.
[16] Schneider A, Kuhn HG, Schäbitz WR. A role for G-CSF (granulocyte-colony stimulating factor) in the central nervous system[J]. Cell Cycle, 2005, 4(12): 1753-7.
[17] Lipton P. Ischemic cell death in brain neurons[J]. Physiol Rev, 1999, 79(4): 1431-1568.
[18] Kleppe R, Toska K, Haavik J. Interaction of phosphorylated tyrosine hydroxylase with 14-3-3 proteins: evidence for a phosphoserine 40-dependent association[J]. J Neurochem, 2001, 77(4): 1097-1107.
[19] Johansson A, Ahrén B, Näsman B, et al. Cortisol axis abnormalities early after stroke-relationships to cytokines and leptin[J]. J Intern Med, 2000, 247(2): 179-187.
[20] Boyd-Kimball D, Poon HF, Lynn BC, et al. Proteomic identifcation of proteins specifcally oxidized in Caenorhabditis elegans expressing human Abeta (1-42): implications for Alzheimer's disease[J]. Neurobiol Aging, 2006, 27(9): 1239-1249.
(本文编辑:丁敏娇)
Effect of recombined granulocyte colony-stimulating factor on cerebral cortical proteins of ischemia-reperfusion injury rats
LIU Baohua1, SHA Ying2, BAI Guanghui3, LI Yong4, WU Wei4, SHANG Ping1, WANG Xiaotong1.
1.Department of Rehabilitation, the Second Affliated Hospital of Wenzhou Medical University, Wenzhou, 325027; 2.Department of Gerontology, the First Hospital of Jilin University, Changchun, 130021; 3.Department of Radiology, the Second Affliated Hospital of Wenzhou Medical University, Wenzhou, 325027; 4.Department of Neurology, the Second Affliated Hospital of Wenzhou Medical University, Wenzhou, 325027
Objective: To research the relation between difference protein with neuron protective effect of G-CSF in ischemia-reperfusion rats brain by using proteomics.Methods: Twenty-four experimental Wistar rats were divide into 3 groups, control group, rats cured by G-CSF group (G-CSF group), ischemia-reperfusion injured rats group (I/R group). Ischemia-reperfusion injury rats model was generated by using Koizumi's way in G group and I/R group, one nylon thread was used to block the rats middle cerebral artery and reperfused after 2 hours. G-CSF (50 μg/kg/d) was injected subcutaneously on rats' backs for successive 5 days in G-CSF group. Rats were executed and decapitated after 14 days after reperfusion to get the brain respectively. Sodium chloride injection was used in I/R group and control group. Cortex proteins were extracted in the 3 groups of rats. Then the maps of the proteins were established by DIGE (differential gel electrophoresis, DIGE). The altered protein spots were identifed with MALDI-TOF-MS and database searching.Results: Compared with the contrl group, the I/R group gained 56 differential protein spots, 39 spots expressed lowly, and 17 spots high. Compared with I/R group, the G-SCF group gained 35 differential protein spots, 16 spots expressed lowly, and 19 spots high, identifed 6 protein spots, including dihydropyrimidinase-associated protein 2, glial fbrillary acidic protein, endomucin, Rho GDP dissociation inhibitor, Rab GDP dissociation inhibitor and guanine-nucleotide-binding protein.Conclusion: G-CSF is involved in neuroprotection after brain ischemia, possibly by regulating the expression of various neural regeneration-associated proteins at the subacute stage.
granulocyte-colony stimulating factor; brain ischemia; proteome; neural regeneration; rats
R743
: A
: 1000-2138(2014)05-0329-06
2014-03-31
浙江省医药卫生平台骨干人才计划项目(2013RCA036)。
刘宝华(1976-),男,陕西丹凤人,主治医师,医学博士。
王小同,主任医师,教授,Email:wangxt22@163.com。
