小梁切除术后早期前房出血危险因素的临床分析△
2014-03-07季敏陆宏张黎明管怀进
季敏 陆宏 张黎明 管怀进
·临床研究·
小梁切除术后早期前房出血危险因素的临床分析△
季敏 陆宏 张黎明 管怀进
目的 探讨小梁切除术后早期前房出血的发生率、出血原因及预防处理。方法 回顾分析249例(355眼)青光眼小梁切除术后早期前房出血的情况,对各类型青光眼小梁切除术后前房出血发生率、出血量及术后积血吸收情况,全身相关因素等进行总结、分析。结果 355眼小梁切除术后,前房出血37眼(10.42%),其中新生血管性青光眼术后发生率为55.55%,急性闭角型青光眼小梁切除术后发生率为8.87%,慢性闭角型青光眼术后发生率为11.49%,原发性开角型青光眼术后发生率为9.24%。14.34%术前高眼压患者术后发生前房出血,伴有高血压病的小梁切除患者术后前房出血发生率为30.43%,伴有糖尿病的术后发生率为26.32%,术前有口服抗凝药物史的术后发生率为31.25%。卡方检验结果显示新生血管性青光眼,术前高眼压,伴有高血压、糖尿病以及术前有抗凝药物服用史的患者,前房出血发生率高。进一步回归分析发现新生血管性青光眼和术前高眼压是小梁切除术后前房出血的独立危险因子。前房出血量1级者19眼,2级者11眼,达3级者7眼,出血后眼压分别为(10.93±2.46)mm Hg(1 mm Hg=0.133 kPa)、(9.33±1.63)mm Hg、(24.75±12.76)mm Hg,出血量达3级者眼压显著性增高。前房出血组术前平均眼压(32.92±7.32)mm Hg,与未发生前房出血者眼压(28.10±7.70)mm Hg相比,差异有统计学意义。结论 前房出血是小梁切除术后常见并发症,术前高眼压、新生血管性青光眼是术后发生前房出血的危险因素;合并高血压、糖尿病和口服抗凝药物患者较无合并全身疾病者,术后前房出血发生率高。少量前房出血对术后眼压无明显影响。(中国眼耳鼻喉科杂志,2014,14:367-370)
前房出血;小梁切除术;青光眼
青光眼是常见的不可逆致盲性眼病, 也是我国重要的致盲原因之一。降低眼压治疗是目前唯一被临床证实有效的青光眼治疗方法[1]。降眼压治疗方法包括药物、激光及手术治疗[2]。小梁切除术是目前临床最常用的抗青光眼手术方式[3]。近年来虽然有引流阀、引流钉等新技术的应用,但是经典的小梁切除术仍是经济、有效的滤过性手术方法之一。前房出血是小梁切除术后的常见并发症,如早期处理不当可导致高眼压甚至角膜血染、滤过通道瘢痕化等严重后果[4]。本文就我院施行的249例( 355眼)小梁切除术病例的术后早期发生前房出血情况进行总结、分析, 并提出我们的认识和处理、预防措施。
1 资料与方法
1.1 资料 回顾分析2012年1月~2013年12月于我院行小梁切除术的所有青光眼患者,记录患者性别、年龄,青光眼类型、分期,合并全身疾病,术前检查是否有凝血功能障碍,术前眼压等。
1.2 手术方法 所有患者术前常规局部应用抗生素不少于2 d,手术均由同一名高年资主任医师完成。单纯小梁切除手术步骤: ①球旁利多卡因注射麻醉;②作上穹隆为基底的结膜瓣;③作以角巩膜缘为基底的板层巩膜瓣, 约4 mm×4 mm,深约1/2巩膜厚度;④颞侧角膜缘辅助穿刺切口, 轻压切口后唇,缓慢引流房水降眼压,可分次放房水以防止眼压骤降导致的前房出血及虹膜晶状体隔前移;⑤切除1.5 mm×1. 5 mm小梁组织;⑥全层切除相应根部虹膜;⑦10-0缝线缝合巩膜瓣, 并检查滤过情况;⑧水密缝合结膜瓣;⑨球旁注射地塞米松2.5 mg;⑩术后常规给予妥布霉素地塞米松滴眼剂滴眼。
1.3 术后观察 术后1周内每日观察患者,记录前房情况,依据前房出血量分为3级[5]:1级为前房血性混浊,或者虹膜表面少量血凝块,无明显血-液平面;2级为下方积血不超过1 mm;3级为积血量超过2级。1级、2级出血患者予半卧位包扎双眼、制动;3级患者除以上措施,予静脉滴注止血药物,合并高眼压患者予全身20%甘露醇静脉滴注,局部使用降眼压药物治疗。所有患者均待前房出血完全吸收后出院,出院后2周门诊复查眼压及前房情况。
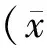
2 结果
本组病例数249例(355眼),其中男性98例、女性151例;年龄5~89岁,平均(62.45±13.28)岁。其中原发性急性闭角型青光眼97例(124眼)、原发性慢性闭角型青光眼58例(87眼)、原发性开角型青光眼72例(119眼)、新生血管性青光眼(neovascular glaucoma,NVG)9例(9眼)、房角后退性青光眼4例(5眼)、发育性青光眼4例(6眼)、晶状体半脱位导致青光眼3例(3眼)、葡萄膜炎继发性青光眼2例(2眼)。全部患者中合并高血压16例(23眼)、合并糖尿病12例(19眼),术前口服抗凝药物史13例(16眼)。所有患者术前平均眼压(28.62±7.91)mm Hg(1 mm Hg=0.133 kPa),术前眼压高于21 mm Hg者共251眼,其中慢性闭角型青光眼78眼(31.08%)、原发性急性闭角型青光眼73眼(29.08%)、原发性开角型青光眼75眼(29.88%)、其他类型青光眼25眼(9.96%)。抗凝药物停用至少3 d,包括阿司匹林、华法林等。术前检查血小板计数及凝血酶原时间和活化部分凝血活酶时间均在正常范围内,术前血压控制在140/90 mm Hg以下,血糖控制在8.3 mmol/L以下。术后1周内有35例(37眼)发生前房出血,具体分布情况见表1。
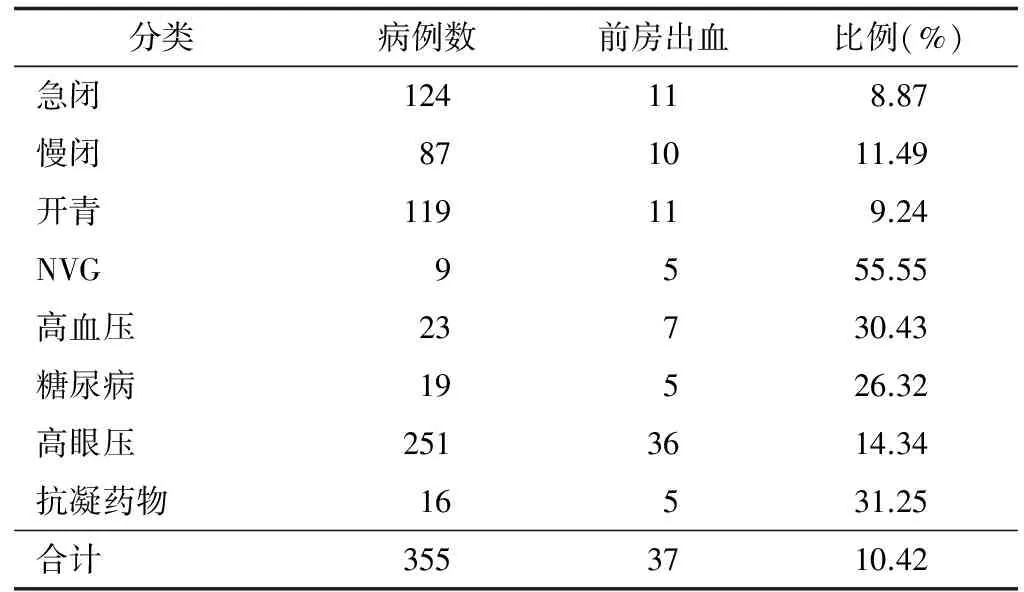
表1 小梁切除术后前房出血分布情况(眼)
注:急闭:原发性急性闭角型青光眼,慢闭:原发性慢性闭角型青光眼,开青:原发性开角型青光眼,NVG:新生血管性青光眼,高眼压:术前眼压>21 mm Hg,抗凝药物:术前短期内有抗凝药物服用史
在前房出血的35例(37眼)中,患者年龄25~72岁,平均(58.39±15.25)岁,术前平均眼压为(32.92±7.32)mm Hg,未发生前房出血眼的平均眼压为(28.10±7.70)mm Hg,两者差异有统计学意义(P<0.01)。其中原发性急性闭角型青光眼11例(11眼),原发性开角型青光眼10例(11眼),原发性慢性闭角型青光眼9例(10眼),NVG 5例(5眼)。小梁切除术后早期前房出血总发生率为10.42%,各种类型青光眼中NVG术后前房出血发病率最高,为55.55%,与非NVG患者比较差异有统计学意义(P<0.01)。术前高眼压患者术后前房出血发生率显著增高(P<0.01),高血压患者和糖尿病患者术后前房出血的发生率也显著增高(P<0.01和P<0.05)(表2)。做进一步Logistic回归分析发现NVG和术前高眼压是术后前房出血危险因素(OR>1,P<0.05)(表3)。

表2 小梁切除术后前房出血统计分析
注:急闭:原发性急性闭角型青光眼,慢闭:原发性慢性闭角型青光眼,开青:原发性开角型青光眼,NVG:新生血管性青光眼,高眼压:术前眼压>21 mm Hg,抗凝药物:术前短期内有抗凝药物服用史
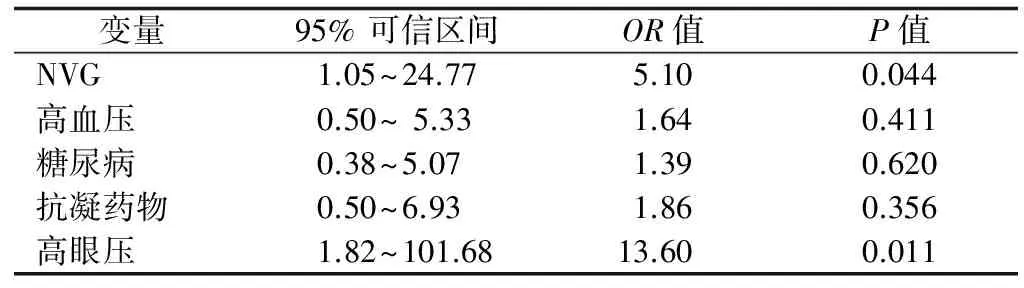
表3 小梁切除术后前房出血危险因素分析
注:NVG:新生血管性青光眼,高眼压:术前眼压>21 mm Hg,抗凝药物:术前短期内有抗凝药物服用史
术后发生前房出血的37眼,观察至术后1个月时,出血量1级19眼,平均吸收时间为(1.62±0.61)d,术后平均眼压(10.93±2.46)mm Hg;出血量2级11眼,平均吸收时间(2.1±1.1)d,平均眼压(9.33±1.63)mm Hg;出血量3级7眼,平均吸收时间(9.25±8.09)d,平均眼压(24.75±12.76)mm Hg,明显高于1级和2级出血组,差异有统计学意义(P<0.05,图1)。高眼压病例术后使用止血药物、甘露醇静脉滴注、局部药物降压治疗后积血吸收、眼压正常且稳定,予以出院。
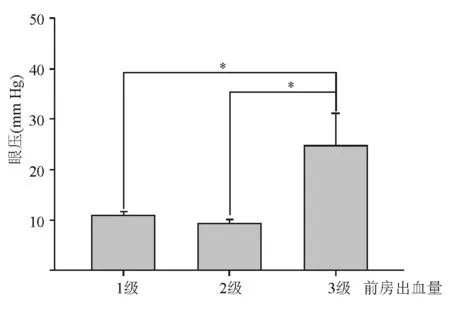
图1. 前房出血量与眼压关系 *示差异有统计学意义(P<0.05)
3 讨论
3.1 小梁切除术后前房出血发生率 国外大型多中心研究Collaborative Initial Glaucoma Treatment Study (CIGTS)报道小梁切除术后前房出血发生率为10%[6]。芬兰学者[7]在高加索人群中的研究随访发现小梁切除术后早期前房出血发生率为17%。上述研究均以高加索人群为研究对象,国内学者报道单纯小梁切除术后前房出血发生率为4.4%~15.2%[8-10]。我们选取了249例(355眼)青光眼患者,由同一位主任医师行单纯小梁切除手术,前房出血发生率为10.42%,差异可能和各医疗机构手术患者选择、手术时机把握等差异有关。
3.2 前房出血的危险原因分析
1)眼部因素。一方面由于术后进入前房血液增多,导致前房积血。首先,由于术前高眼压,术中及术后短期内前房低压力状态,加上术后早期咳嗽、打喷嚏等屏气活动,都可能使静脉压瞬间增高,巩膜上静脉血液反流导致前房出血;其次,由于术后低眼压等原因,巩膜床层间电凝血痂脱落,特别在有些病例中可表现为前房自上方切口处线状活动性出血,是此种类型前房出血的特征性表现。再次,术后早期前房压力偏低,虹膜表面的新生血管扩张、破裂所导致[11]。本文分析发现3种原发性青光眼中,慢性闭角型青光眼的前房出血发生率稍高,术前高眼压患者中慢性闭角型青光眼比例也稍高,推测慢性闭角型青光眼发现时多数已是中晚期,术前长时间高眼压,明确诊断后短期内就施行手术治疗,且降眼压药物治疗效果常常欠佳,导致术后前房出血发生率较高,而急性闭角型青光眼短期内眼内压升高,常在眼压控制后手术,术后前房出血发生率反而较慢性闭角型青光眼小。另一方面,青光眼患者长期高眼压状态,Schlemm管塌陷[12],前房角红细胞及碎片排出功能受损也可能导致前房积血。由Logistic回归分析结果可知排除混杂因素后术前高眼压OR>13,且P<0.05,可见术前高眼压患者术后前房出血风险明显高于术前眼压已控制的患者。同时NVG也是术后前房出血的危险因素。因此,眼部因素较全身因素是术后前房出血更重要的危险因素。
2)全身因素。小梁切除术后前房出血首先和全身因素有关,如高血压、糖尿病等血管性疾病,因虹膜、睫状体血管病变,以及口服抗凝药物等导致的凝血功能障碍,可导致术中易出血。本组病例中高血压、糖尿病和术前口服抗凝药物患者,前房出血发生率明显高于总体发生率。本文单因素分析结果显示,高血压、糖尿病及术前抗凝药物的使用都可增加术后前房出血发生率,但是回归分析结果却提示高血压、糖尿病及抗凝药物的使用作为前房出血独立的危险因子均无统计学意义,主要是由于这3个协变量相关性较大而样本量相对较小。今后工作中需增加病例的积累,进一步观察全身因素对术后前房出血的影响。
3)手术操作因素。有研究[13]发现小梁切除术中易导致虹膜、睫状体损伤,也是小梁切除术后早期前房出血非常重要的原因。这种前房出血多由于术中前房出血未能及时吸收,术后可见前房积血。
3.3 前房出血处理及预防建议 本组病例中,术后发生前房出血2级以下时,对患者术后早期眼压无明显影响,仅增加住院时间,嘱患者半卧位休息,一般很快自行吸收,无须特殊处理。出血量2级以上者,加用止血药和高渗剂,促进积血吸收,且必须监测眼压,前房积血量大、持续时间长可引起高眼压、角膜内皮功能异常,导致角膜血染等严重并发症。本组病例均通过积极的休息和必要的制动,止血、积极降眼压治疗后积血吸收。针对上述前房出血的危险因素,我们提出如下预防措施:①小梁切除术后前房出血与高血压、糖尿病及全身用抗凝药物等因素有关,术前需严格把握手术适应证,控制血糖、血压,全身情况允许条件下应停用抗凝药物,具体停用时间根据不同抗凝药物种类而异;②鉴于术前高眼压是小梁切除术后前房出血最重要的危险因素,术前需积极降低眼压,全身及局部联合用药,如术前眼压控制不良,可在术中前房穿刺,需少量多次放房水;③NVG也是前房出血危险因素,术前降低眼压的同时,手术时应避开房角新生血管部位,术中尽量使眼压平稳,避免眼压骤降导致的虹膜及小梁表面新生血管破裂出血;④术中电凝充分,减少术后巩膜层间血痂脱落;⑤术中切除巩膜瓣下小梁组织时尽量偏前,以减少伤及虹膜根部或睫状体引起的前房出血。
前房出血是小梁切除术后早期较为常见的并发症,针对上述发病原因,术中应尽量保持眼压平稳,巩膜瓣充分电凝止血,切除小梁组织时尽量靠前。少量的前房出血对眼压影响不大,出血量多时要警惕高眼压等并发症,一旦发现活动性大量出血,应及时处理,避免由此导致的非计划再次手术或者抗青光眼手术失败。
[ 1 ] Chang EE, Goldberg JL. Glaucoma 2.0: neuroprotection, neurore-generation, neuroenhancement[J]. Ophthalmology, 2012, 119(5):979-986.
[ 2 ] Crawley L, Zamir SM, Cordeiro MF, et al. Clinical options for the reduction of elevated intraocular pressure[J]. Ophthalmol Eye Dis, 2012, 4(11):43-64.
[ 3 ] 孙兴怀. 青光眼手术治疗的评价[J]. 眼外伤职业眼病杂志, 2003, 25(11):723-724.
[ 4 ] Tanihara H, Nakayama Y, Honda Y. Intraocular pressure elevation caused by massive and prolonged hemorrhage after trabeculotomy ab externo[J]. Acta Ophthalmol Scand, 1995, 73(3):281-282.
[ 5 ] Konstas AG, Jay JL. Modification of trabeculectomy to avoid postoperative hyphema. The guarded anterior fistula operation[J]. Br J Ophthalmol, 1992, 76(6):353-357.
[ 6 ] Jampel HD, Musch DC, Gillespie BW, et al. Perioperative complications of trabeculectomy in the collaborative initial glaucoma treatment study (CIGTS) [J]. Am J Ophthalmol, 2005, 140(1):16-22.
[ 7 ] Liang YB, Wang NL, Rong SS, et al. Initial treatment for primary angle-closure glaucoma in China[J]. J Glaucoma, 2014. [Epub ahead of print]
[ 8 ] 冯英策.探讨青光眼小梁切除术后早期并发症处理[J].中外医学研究, 2013, 11(24):163.
[ 9 ] 王淑霞,支洪峰,张铭,等.1 791眼小梁手术后早期并发症分析及处理[J].中国实用眼科杂志,2006,24(2):153-154.
[10] 赵安利,周海松.青光眼小梁切除术后并发症分析[J].实用医学杂志,2002,18(2):149.
[11] Nakatake S, Yoshida S, Nakao S, et al. Hyphema is a risk factor for failure of trabeculectomy in neovascular glaucoma: a retrospective analysis[J]. BMC Ophthalmology, 2014, 14(1):55.
[12] Kagemann L, Wang B, Wollstein G, et al. IOP elevation reduces Schlemm's canal cross-sectional area[J]. Invest Ophthalmol Vis Sci, 2014, 55(3):1805-1809.
[13] Ehrnrooth P, Lehto I, Puska P,et al. Effects of early postoperative complications and the location of trephined block on long-term intraocular pressure control after trabeculectomy[J]. Graefes Arch Clin Exp Ophthalmol, 2003, 241(10):803-808.
(本文编辑 诸静英)
Risk factors of hyphema early after trabeculectomy
JIMin,LUHong,ZHANGLi-ming,GUANHuai-jin.
DepartmentofOphthalmology,AffiliatedHospitalofNantongUniversity,Nantong226001,China
Corresponding author: GUAN Huai-jin,Email:guanhjeye@126.com
Objective To investigate the incidence, causes and prevention of hyphema early after trabeculectomy. Methods The incidence, grade and severe complications of hyphema in 355 eyes of 249 glaucoma patients who had undergone trabeculectomy were retrospectively analyzed. Results In the first week after operation, hyphema occurred in 37 eyes (10.42%). The incidence of hyphema after trabeculectomy in neovascular glaucoma patients was 55.55%, in primary acute angle-closure glaucoma patients was 8.87%, in primary chronic angle-closure glaucoma patient was 11.49%, in primary open angle glaucoma was 9.24%, while in patients with introcular pressure(IOP) higher than 21 mm Hg (1 mm Hg=0.133 kPa) was 14.34%. Seven out of 23 glaucoma patients with high blood pressure developed hyphema after trabeculectomy, and 5 out of 19 patients with diabetic mellitus developed hyphema. Thirty-one point two five percent of the anticoagulants used patients developed hyphema. Chi square test showed hyphema easily happened in neovascular glaucoma patients, high IOP patients, high blood pressure patients, diabetic mellitus patients and patients with anticoagulants used. Regression analysis showed that the high preoperative IOP and neovascular glaucoma were the risk factors of hyphema. Among the 37 hyphema patients, 19 of them were grade 1 hyphema, 11 patients were grade 2, and 7 were grade 3 hyphema. The mean IOP of grade 1 hyphema was (10.93±2.46)mm Hg, of grade 2 was (9.33±1.63)mm Hg, while the IOP of grade 3 was (24.75±12.76)mm Hg, significantly higher than that of grade 1 and grade 2 group. The mean IOP of hyphema patients was (32.92±7.32)mm Hg, which was significantly higher than that of non-hyphema patients. Conclusions Hyphema is a common complication early after trabeculectomy. Neovascular glaucoma and high preoperative IOP are the risk factors of hyphema. Hyphema happen more often in glaucoma patients with high blood pressure, diabetic mellitus and anticoagulants used than in those without such systematic complications. Mild hyphema has little impact on postoperative IOP. (Chin J Ophthalmol and Otorhinolaryngol,2014,14:367-370)
Hyphema; Trabeculectomy; Glaucoma
国家自然科学基金(81200680)
南通大学附属医院眼科 南通 226001
管怀进(Email: guanhjeye@126.com)
2014-06-28)
