鲨鱼再生肝组织差异表达基因的筛选
2014-03-06朱爱萍吴小华于晓惠常秀峰徐清华焦保权
朱爱萍,吴小华,于晓惠,张 敏,常秀峰,徐清华,焦保权,张 洁
肝脏是动物体内最大的器官,具有十分复杂的功能,包括代谢、合成和储存功能及调节和维持内部环境稳定等。肝脏再生能力极其强大,肝细胞受损24 h后开始增殖,这期间是由G0期细胞向G1/S转变,肝部分切除48 h后小血管开始形成,薄壁组织、肝小叶逐渐形成,肝脏逐渐长大并恢复功能[1]。肝部分切除模型[2]的建立推动了肝脏再生机制的研究工作。大量研究结果显示,肝脏的再生过程受到多种细胞因子和生长因子的调控,包括血管内皮生长因子(VEGF-A)[3]、白介素(IL)-6[4]、肝细胞生长因子(HGF)[5]、肿瘤坏死因子-α(TNF-α)[6]、转化生长因子-β(TGF-β)[7]、表皮生长因子(EGF)[8]及肝刺激物质(HSS)[9]等,这些细胞因子和生长因子在动物体内形成了一个复杂的信号传导和调控网络,保证机体组织和器官的正常重建并维持其正常生长。鲨鱼的肝脏约占内脏重量的75%,许多研究者已从鲨鱼体内分离克隆了多种与肝再生和免疫调节相关的刺激因子[10-16]。本研究通过条纹斑竹鲨肝脏2/3部分切除模型建立获得正常和24 h再生肝组织,利用差别显示逆转录 -聚合酶链反应(differential display reverse transcription polymerase chain reaction,DDRT-PCR)技术进行肝再生过程中差异表达基因的筛选,为进一步研究肝再生过程中差异表达的相关功能基因奠定基础,促进肝病药物作用新靶点及肝再生机制的研究。
1 材料与方法
1.1 材料 条纹斑竹鲨鱼(280 g),编号4,为中科院南海海洋所海洋生物学实验室馈赠;无菌注射器、吸收性明胶海绵、非吸收性外科缝线、医用缝合针、手术剪、手术刀均购自杭州华东医药器材公司。
1.2 试剂 麻醉剂:2%水合氯醛溶液,按每公斤鲨鱼体重注射15 ml即300 mg水合氯醛配制。大肠杆菌E.coli TG1菌株由本实验室保存;Taq DNA聚合酶及相应PCR反应试剂购自上海莱枫生物公司;AxyPreTMDNA Gel Extraction Kit购自 AXYGEN公司;pMD®18-T Simple Vector购自 Takara公司;Trizol、Reverse Transcription Reaction(First-Strand cDNA Synthesis)试剂盒购自Promega公司。
1.3 肝脏2/3部分切除模型建立 将4 ml麻醉剂注射鲨鱼腹部皮下,2 ~3 min 补加 1 ml[17],待鲨鱼失去运动能力后开始手术。沿腹部中线剪开鲨鱼皮肤,切开肌层,切除肝脏右叶2/3部分为正常肝组织,将其迅速放入液氮中冷冻后移至-70℃冰箱保存备用。在创伤处滴加链霉素(0.1 g)和青霉素(10万单位),缝合肌层和皮肤伤口,将鲨鱼继续饲养24 h后拆除伤口缝线取剩余肝组织的切除边缘部分为再生肝组织[12]。
1.4 总RNA提取及逆转录 采用Trizol法分别提取正常及再生24 h肝组织的total RNA,1%甲醛变性琼脂糖凝胶电泳检测RNA完整性,紫外分光光度计检测其纯度。采用Promega公司逆转录试剂盒(First-Strand cDNA Synthesis Reverse Transcription Reaction)进行逆转录,反应条件:1250 ng total RNA,RT primer/olig(dT)15 2.5 μl/1.25 μl,70℃ 10 min,迅速冰浴2~5 min;后依次加入MgCl2(25 mmol/L)5.0 μl,dNTP Mix(10 mmol/L)2.5 μl,10 × RT buffer 2.5 μl,RNase inhibitor 0.625 μl,AMV Reverse Transcriptase 0.625 μl,总反应体系为 25 μl,42℃50 min,95℃ 5 min,立即置于冰上冷却,-20℃保存备用。
1.5 差异显示PCR 采用莱枫公司2×Taq PCR Master Mix试剂,将2条锚定引物和20条随机引物配对形成40种组合对正常和再生24 h肝组织cDNA进行PCR,2种组织共80个PCR反应,引物序列见表1。每个反应体系如下:2×Taq PCR Master Mix 5 μl,锚定引物(50 μmol/L)0.1 μl,PCR Reverse Primer(10 μmol/L)0.5 μl,cDNA 溶液 0.5 μl,ddH2O 3.9 μl,总体积 10 μl。反应程序:95℃5 min;95℃ 30 s,40℃ 2 min,72℃ 1 min,40 个循环;72℃ 10 min。参照《分子克隆》方法配制5%非变性聚丙烯酰胺凝胶,取PCR产物8μl上样,电泳100 V,至溴酚蓝到达凝胶底部停止;银染显色,直至条带清晰,区分差异电泳条带。

表1 鲨鱼再生肝组织差别显示逆转录-聚合酶链反应引物
1.6 差异条带回收及二次扩增 采用压碎与浸泡法进行目的片段回收,具体操作如下:将差异条带切下压碎后转移至离心管中,加入150μl 1×TBE,37℃摇床温浴过夜;离心收集上清,再向原管中加入50μl 1×TBE,37℃摇床温浴 15 min,离心合并上清;将上清用无水乙醇沉淀过夜,75%乙醇洗涤沉淀,产物溶于10μl ddH2O,-20℃保存备用;以回收的差异基因为模板,以相应锚定引物和相应下游引物进行PCR反应,体系和程序同前;1.2%琼脂糖凝胶电泳检测,核对条带大小并割胶回收目的差异条带。
1.7 目的片段克隆及序列分析 将回收的差异条带与载体连接,反应条件:Solution I 5μl,目的片段2 μl,pMD®18-T Simple Vector 1 μl,ddH2O 2 μl,总计10μl,16℃连接过夜。将5μl连接产物转化E.coliTG1感受态细胞,利用载体通用引物菌落PCR鉴定阳性克隆,反应体系:2×Taq PCR Master Mix 5 μl,PCR Forward Primer(10 μmol/L)0.4 μl,PCR Reverse Primer(10 μmol/L)0.4 μl,总计10 μl;反应程序:95℃ 5 min;95℃ 30 s,60℃ 30 s,72℃1 min,30个循环;72℃ 10 min。序列测定采用正向测序,由上海桑尼公司完成。然后将所得目的差异基因序列与国家生物技术信息中心已表达序列标志(NCBI EST)库进行Blast比对。
2 结果与分析
2.1 RNA提取 Total RNA用1%甲醛变性琼脂糖凝胶电泳检测,结果显示5s RNA条带较暗,28s RNA/18s RNA的比值约为2∶1,可见提取的RNA完整性较高(图1);用紫外分光光度计检测总RNA的 OD值,经计算 OD260/OD280的比值为 1.8~2.0,提取的RNA可用于下一步实验。

图1 RNA 1%甲醛变性琼脂糖凝胶电泳检测1.正常肝组织;2.再生肝组织
2.2 PCR扩增目的片段 40对PCR产物经5%聚丙烯酰胺凝胶电泳银染显示,条带清晰可辨。图2为6对PCR产物银染显示结果,其中有2条差异比较明显的条带,表明这2条差异条带在肝再生过程表达增强。综合分析,共获得了10条差异较明显的序列片段。
2.3 目的片段条带琼脂糖凝胶电泳检测 将选取的10条差异表达的片段用原引物对进行二次PCR扩增鉴定,产物经琼脂糖凝胶电泳核对条带,显示目的差异条带大小与预期值相符,见图3。
2.4 差异基因序列分析 10条差异序列通过Blast检测,其中3条与NCBI EST库的序列有较高相似性,为已知序列,其他7条序列与已报道基因无同源性,为新发现的功能序列。RF1-6l与33条灰斑竹鲨cDNA克隆序列同源性达到100%,NF2-2与2条猫鲨胚胎 cDNA文库的序列同源性为80%以上,RF2-6s与狗鲨干细胞系SAE的序列同源性为88%。NF2-2和RF2-6s的比对结果见图4。10条差异序列的比对及差异表达情况见表2,其中有8条大小为100~500 bp,5条序列在肝再生过程表达上调,另5条表达下调。
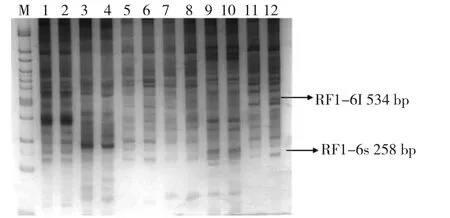
图2 鲨鱼再生肝组织差别显示逆转录-聚合酶链反应结果M.100bp DNA ladder marker;1 ~12.分别为 NF1-1,RF1-1,NF1-2,RF1-2,NF1-3,RF1-3,NF1-4,RF1-4,NF1-5,RF1-5,NF1-6,RF1-6;N表示正常肝组织,R表示再生肝组织,F1表示锚定引物1,最后的数字编号表示随机引物编号
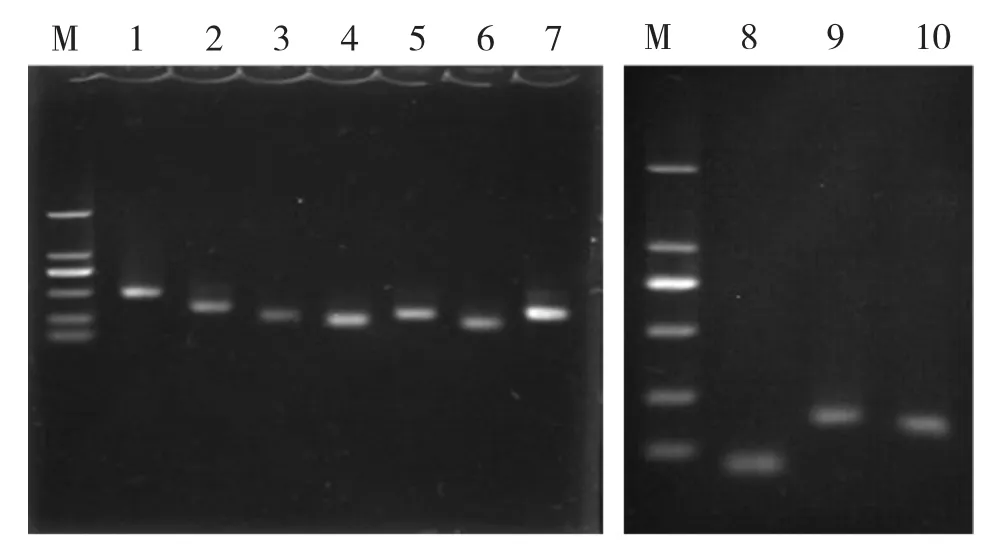
图3 鲨鱼再生肝组织差异表达的目的片段琼脂糖凝胶电泳检测M.DL2000 DNA分子量标准;1~10.分别为条带 RF1-6l 534 bp,NF1-19 326 bp,RF1-6s 258 bp,RF2-6s 244 bp,RF2-6l 278 bp,NF1-7 236 bp,RF2-8 283 bp,NF2-19 77 bp,NF1-9 208 bp,NF2-2 173 bp,N表示正常肝组织,R表示再生肝组织,F1表示锚定引物1,F2表示锚定引物2,最后的数字编号表示随机引物编号
3 讨论
mRNA差异显示PCR技术(differential display PCR,DD-PCR)是由Liang等在1992年建立的一种寻找差异表达基因的方法。真核生物基因的mRNA 3'端多数都带有一段多聚腺苷酸结构,其有12种组合:5'-NMAAA…AA-3',其中 N 代表 A、G、C、T 任意一种碱基,M代表G、C、T任意一种碱基。根据此序列特征,按碱基配对的原则,人工合成Poly(dT)引物时在其3'末端加上两个锚定碱基:5'-TTT…TTTMN-3'(M、N同上),此引物可将 mRNA反转录成cDNA(又称为第1链),用此引物锚定cDNA第2条链3'端,用5'端随机引物与cDNA第1条链互补进行PCR,随机扩增cDNA片段,将PCR产物在变性聚丙烯酰胺凝胶上电泳分离,即可显示不同的条带位置,比较不同组间的显示结果,将差异条带回收再扩增,通过杂交验证、克隆测序等,进一步分析其结构与功能[18]。DDRT-PCR技术经过多年的推广和不断完善,现已非常成熟,所需RNA量少,操作简便,灵敏度高,实验周期短,能同时比较多种样品,避免了同位素的污染,可以直接从凝胶上切除肉眼可观察到的条带,并且能在任何配备了标准分子生物学试剂和仪器的实验室进行,所以目前大多数研究人员采用DDRT-PCR技术研究功能基因的筛选与克隆[19-21],但DDRT-PCR操作中有两个关键问题需要注意:一是如何得到稳定、丰富和清晰的差异条带,二是如何有效地从差异片段中筛选出真正差异表达的片段。
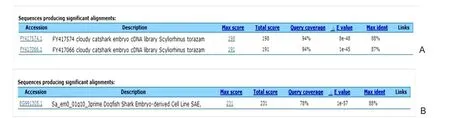
图4 NF2-2和RF2-6s序列与已表达序列标志库比对结果A.NF2-2 Blast;B.RF2-6s Blast
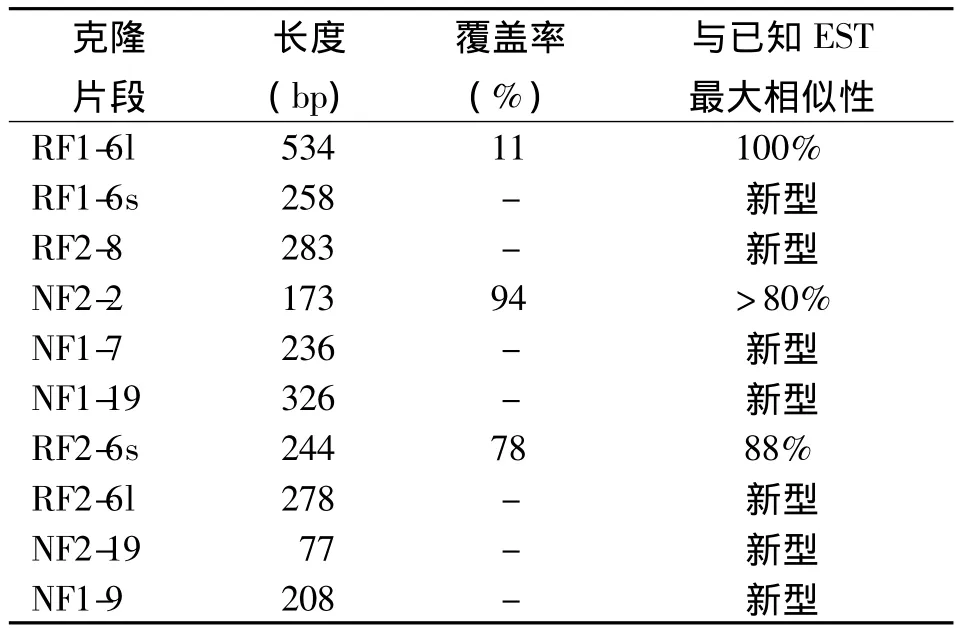
表2 鲨鱼再生肝组织表达差异序列分析
本实验采用DDRT-PCR技术进行鲨鱼肝脏再生过程中差异表达基因的筛选,应用垂直电泳槽非变性聚丙烯酰胺胶电泳、实验室常规试剂配制的银染溶液,能够取得良好的差异显示效果,由于所用试剂及配制银染溶液的水质差别,具体操作中应根据PCR产物的效率对分离上样量及银染时间做适当调整,才能得到清晰带型。本实验采用2条锚定引物、20条10碱基随机引物,样本为正常和再生24 h条纹斑竹鲨肝组织,获得10条差异片段,其中3条与NCBI EST库的序列有较高相似性,另外7条为新发现的功能序列片段;5条序列在肝再生过程中表达上调,另5条表达下调,这一结果为进一步研究肝再生相关功能新基因及肝再生机制提供了有效信息。
[1] Zimmermann A.Regulation of liver regeneration[J].Nephrol Dial Transplant,2004,19(Suppl 4):6-10.
[2] Maros T,Seres Sturm L,Lakatos O,et al.Data regarding the restorative effects of the partial removal of the liver in advanced stages of toxic cirrhosis[J].Morphol Embryol(Bucur),1975,21(3):213-217.
[3] Bonninghoff R,Schwenke K,Keese M,et al.Effect of different liver resection methods on liver damage and regeneration factors VEGF and FGF-2 in mice[J].Can J Surg,2012,55(6):389-393.
[4] Yang H,Zhu Y L,Liu Q N,et al.The impact of ischemic postconditioning on the tumor necrosis factor-alpha/IL-6/signal transducers and activators of transcription-3 signal pathway of liver regeneration[J].Zhonghua Wai Ke Za Zhi,2012,50(10):909-913.
[5] Lehwald N,Duhme C,Wildner M,et al.HGF and SDF-1-mediated mobilization of CD133+BMSCfor hepatic re-generation following extensive liver resection[J].Liver Int,2014,34(1):89-101.
[6] Riehle K J,Haque J,McMahan R S,et al.Sustained Glutathione Deficiency Interferes with the Liver Response to TNF-alpha and Liver Regeneration after Partial Hepatectomy in Mice[J].J Liver Disease Transplant,2013,1(2):1000105
[7] Nejak Bowen K N,Orr A V,Bowen WCJr,et al.Gliotoxin-induced changes in rat liver regeneration after partial hepatectomy[J].Liver Int,2013,33(7):1044-1055.
[8] Liu S,Wierod L,Skarpen E,et al.EGF activates autocrine TGFalpha to induce prolonged egf receptor signaling and hepatocyte proliferation[J].Cell Physiol Biochem,2013,32(3):511-522.
[9] Jiang Y,Zhao M,An W.Increased hepatic apoptosis in high-fat diet-induced NASH in rats may be associated with downregulation of hepatic stimulator substance[J].J Mol Med(Berl),2011,89(12):1207-1217.
[10]Xie Z,Chen G,Huang Y,et al.Study on immune activity of shark liver extracts[J].Zhongguo Sheng Hua Yao Wu Za Zhi,1999,20(3):126.
[11] Huang F J,Wu WT.Purification and characterization of a new peptides(S-8300)from shark liver[J].JFood Biochemistry,2010,34(5):962-970.
[12]Zhou F,Wang Y,Guan Y,et al.Construction and characterization of a cDNA library from shark regenerated hepatic tissue[J].Fish Shellfish Immunol,2011,30(4-5):1170-1177.
[13] Shimizu T,Togo S,Kumamoto T,et al.Gene expression during liver regeneration after partial hepatectomy in mice lacking type 1 tumor necrosis factor receptor[J].J Surgical Research,2009,152(2):178-188.
[14]Wang Y,Chen B,Ke Y,et al.Molecular characterization and expression analysis of the complement factor I(CpFI)in the whitespotted bamboo shark(Chiloscyllium plagiosum)[J].Fish Shellfish Immunol,2014,40(2):414-423.
[15]Wang Y,Zhang M,Wang C,et al.Molecular cloning of the alpha subunit of complement component C8(CpC8alpha)of whitespotted bamboo shark(Chiloscyllium plagiosum)[J].Fish Shellfish Immunol,2013,35(6):1993-2000.
[16]Shin D H,Webb B M,Nakao M,et al.Characterization of shark complement factor I gene(s):genomic analysis of a novel shark-specific sequence[J].Mol Immunol,2009,46(11-12):2299-2308.
[17]梁婕,毕穗磊.影响医学实验动物麻醉的几个因素[J].中国卫生产业,2011,8(8 下):19.
[18] Liang P,Pardee A B.Differential display of eukaryotic messenger RNA by means of the polymerase chain reaction[J].Science,1992,257(5072):967-971.
[19]于建春,陆明霞,于涛,等.用DDRT-PCR技术分析快速老化膜型鼠衰老相关基因的差异表达及针刺的作用[J].中医杂志,2002,43(6):431-432.
[20]张春,刘军,蒋宏传,等.乳腺癌相关差异表达基因的筛选及分析[J].首都医科大学学报,2013,34(1):1-5.
[21]李佩国,张艳英,贾青辉,等.鸡柔嫩艾美耳球虫石家庄多重耐药虫株差异基因的表达[J].中国兽医学报,2013,33(9):1373-1377.
