红景天苷对力竭大鼠心肌线粒体呼吸功能的影响
2014-03-06张龙飞崔玉娟曹雪滨
张龙飞,崔玉娟,平 政,曹雪滨
运动是一种特殊的生理、病理过程,适量的运动有助于维持人体的健康以及提升运动能力,但过度的力竭运动则导致机体损伤,特别是力竭性心脏损伤[1]。力竭运动导致的心肌损伤临床较多见,表现为各种形式,包括心脏性猝死、严重心律失常、心力衰竭等。线粒体是真核细胞的主要供能细胞器,是细胞发生呼吸作用的主要场所,通过电子传递呼吸链的氧化磷酸化反应产生三磷腺苷(ATP),供细胞利用。线粒体呼吸功能下降会导致能量代谢障碍,影响正常生理功能。目前的研究发现运动及耐力训练与线粒体的功能之间有密切关系[2-4]。考察线粒体呼吸链复合物的功能普遍采用将线粒体分离后测定单个线粒体复合物活性的方法,但氧化磷酸化必须在完整的线粒体中进行,因此分离线粒体的方法不能揭示复合物如何相互作用。本课题提供一种原位分析线粒体功能的方案,可保留在细胞内原位置和装配条件下的线粒体功能的特征及与其他细胞器的交互作用。红景天苷(Salidroside,SAL)是从植物红景天中提取的一种有效成分,具有抗心肌缺血、保护缺血再灌注损伤、抗缺氧等作用,通过增加肝糖原含量,提高红细胞和肝脏的过氧化物歧化酶活性,降低血浆、心肌、脑的过氧化脂质含量等途径,有效提高机体耐缺氧能力和抗疲劳能力[5-6]。本研究拟通过研究力竭运动及红景天苷对大鼠心肌线粒体结构和线粒体呼吸功能的影响,探讨红景天苷对大鼠心肌的保护作用及机制。
1 材料与方法
1.1 动物、试剂与仪器 清洁级雄性SD大鼠[军事医学科学院实验动物中心提供,许可证号:SCXK(京)2003-1-003],体重(120±20)g。98%红景天苷粉剂(南京泽朗医药科技有限公司),所有用于测定线粒体呼吸功能的试剂均购自美国Sigma公司,高分辨率线粒体呼吸仪 Oxygraph-2k(奥地利Oroboros)。
1.2 方法
1.2.1 分组及给药:将40只雄性SD大鼠随机分为对照(C)组、力竭(EE)组、低剂量SAL(LS)组、高剂量SAL(HS)组,每组10只。将SAL粉剂用0.9%氯化钠注射液分别配制成浓度为0.1 g/L及0.3 g/L的 SAL溶液,LS组与 HS组分别给予 100、300 mg/(kg·d)灌胃2周,C组与EE组给予生理盐水10 ml/(kg·d)灌胃2周。
1.2.2 模型制备及取材:采用经典的Thomas方法[7]制备力竭心脏损伤模型。大鼠游泳采用清洁的塑料圆桶(高55 cm,直径50 cm),水温(32.0±0.5)℃,水深50 cm。正式实验时,除C组外,其他各组均参加一次力竭性训练。力竭标准参考Thomas力竭标准[7]:①大鼠沉入水下无法返回水面超过10 s;②大鼠协调运动消失,在水中无方向性地乱窜,虽未达到10 s亦定为力竭。如果大鼠在短时间内就达到力竭状态,将其捞出后休息5 min,再继续游泳运动,保证大鼠的游泳时间在2 h以上。在大鼠游泳过程中观察其游泳状态,防止因呛水而导致的意外死亡。
1.3 观察指标
1.3.1 光镜及电镜观察大鼠心室肌组织:EE、LS、HS组于力竭游泳运动后即刻取材,C组同时在安静状态下取材。取大鼠心尖部心室肌组织,用10%甲醛固定,制做5μm连续切片,HE常规染色,光镜下观察及照相。另取同一部位心肌组织用4%戊二醛溶液固定,磷酸缓冲液冲洗,再用1%四氧化锇后固定,梯度丙酮脱水后用包埋剂浸透,用超薄切片机将样品切成厚约50 nm的超薄切片,然后用醋酸双氧铀及柠檬酸铅电子染色,最后使用投射电镜进行观察及照相。
1.3.2 线粒体呼吸功能测定:①大鼠心肌的分离及透化。使用眼科剪及镊子将心肌沿心肌纤维走行分离成束,每个束包含6~8个肌纤维(称湿重5~7 mg),尽量将肌纤维束相互分离。称取5 mg Saponin加入到1 ml BIOPS分离介质中配制成Saponin母液,然后取21μl Saponin母液加入到2 ml BIOPS分离介质中配制成Saponin透化溶液[8]。将分离好的肌纤维放入saponin透化液中。轻微震荡30 min使肌纤维充分透化,将透化好的肌纤维转移到装有MIR06呼吸介质的试管中,轻微震荡5 min,重复3次以洗脱透化液。②高分辨率线粒体呼吸仪测定线粒体呼吸功能[9-11]。在Oxygraph-2k高分辨率线粒体呼吸仪反应仓中加入呼吸介质MIR06 2 ml,将透化好的肌纤维放入反应仓内,加入苹果酸(Malate,Mal)10 μl以及谷氨酸钠(Glutamate,Glu)12.5 μl,待呼吸速率平稳后再加入二磷腺苷(ADP)10μl,可得到复合物Ⅰ的态3呼吸速率。加入底物琥珀酸(Succinate,Suc)20μl激活线粒体呼吸链复合物Ⅱ,待呼吸速率平稳后加入复合物Ⅰ的特异抑制剂鱼藤酮(Rotenone,Rot)10μl,抑制了线粒体呼吸链复合物Ⅰ的活性,得到复合物Ⅱ的呼吸速率。加入线粒体呼吸链复合物Ⅲ的特别抑制剂抗霉素A,待呼吸速率平稳后加入5μl TMPD和5μl抗坏血酸盐激活线粒体呼吸链复合物Ⅳ,得到复合物Ⅳ的呼吸速率。
1.4 统计学分析 应用SPSS 17.0软件进行统计学分析,所有数据用均数±标准差(x±s)表示。各组符合正态、方差齐性(α>0.1),采用单因素方差分析,方差不齐时采用Dunnertt法,α=0.05为检验水准。
2 结果
2.1 大鼠心肌显微结构 C组:心肌结构完整,肌纤维排列整齐,间质无水肿,肌膜无破损,无肌纤维断裂、变性、坏死;EE组:可见肌纤维断裂、排列紊乱,间质纤维增生、水肿,心肌细胞肿胀明显,大量炎细胞浸润;LS组、HS组:偶见肌纤维断裂,间质水肿较轻,可见变性病变,少量炎细胞浸润,HS组大鼠心肌纤维的完整性要好于LS组,整体形态更接近C组。见图1。
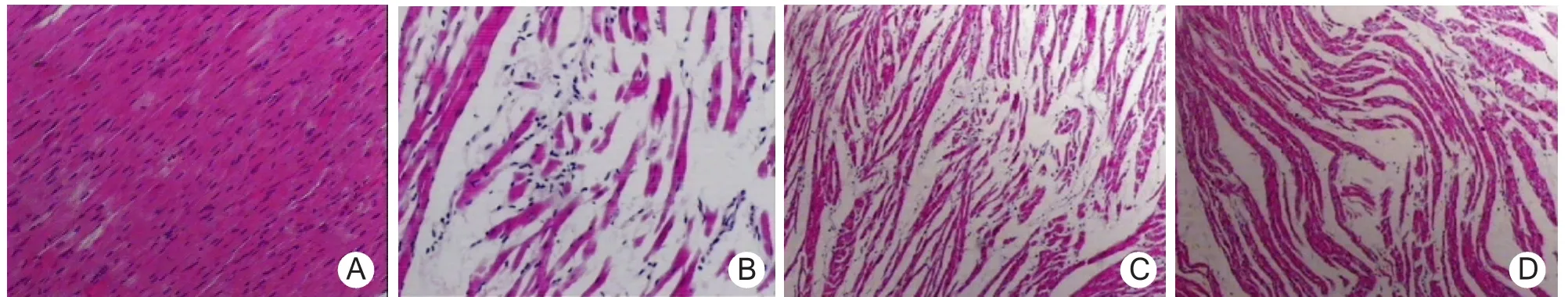
图1 4组大鼠心肌显微结构(HE×400)A.对照组;B.力竭组;C.低剂量红景天苷组;D.高剂量红景天苷组
2.2 大鼠心肌超微结构 C组:可见完整的细胞核、线粒体,线粒体数量和形态正常,核仁明显、肌节清晰;线粒体完整无损,无肿胀、融合、变形等。EE组:线粒体体积增大,可见畸形的线粒体,核端基质内线粒体部分嵴和少部分膜融合、模糊不清并且嵴有断裂。LS组:线粒体周边水肿,膜嵴融合,局部缺损。HS组:线粒体个别轻度融合,核周隙轻度扩张,偶见线粒体膜破损。见图2。
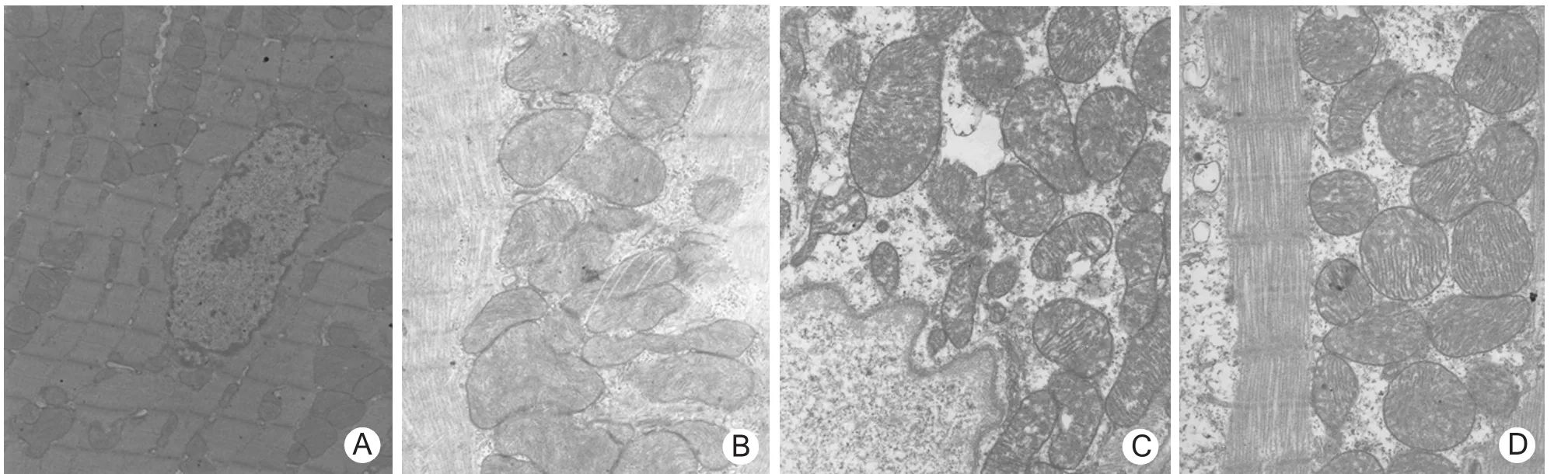
图2 4组大鼠心肌超微结构(×12 000)A.对照组;B.力竭组;C.低剂量红景天苷组;D.高剂量红景天苷组
2.3 心肌线粒体呼吸功能测定结果
2.3.1 各组大鼠心肌线粒体呼吸链复合物Ⅰ的态3呼吸速率比较:与C组相比,EE组大鼠心肌线粒体呼吸链复合物Ⅰ的态3呼吸速率明显降低,而LS、HS组明显高于EE组,其中HS组又明显高于LS组,差异均有统计学意义(P<0.05),见表1。
2.3.2 各组大鼠心肌线粒体呼吸链复合物Ⅱ的态3呼吸速率比较:与C组相比,EE组大鼠心肌线粒体呼吸链复合物Ⅱ的态3呼吸速率明显降低(P<0.05),而 HS组明显高于 EE组以及 LS组(P<0.05),LS组与 EE组差异无统计学意义(P>0.05),见表1。
2.3.3 各组大鼠心肌线粒体呼吸链复合物Ⅳ的态3呼吸速率比较:与C组相比,EE组大鼠心肌线粒体呼吸链复合物Ⅳ的态3呼吸速率明显降低,HS组明显高于LS组与EE组,差异均有统计学意义(P<0.05),而LS组与EE组差异无统计学意义(P>0.05),见表1。

表1 4组大鼠心肌线粒体呼吸功能比较[x ± s,pmol/(s·mg)]
3 讨论
3.1 红景天苷对力竭大鼠心肌线粒体结构的影响有研究表明力竭运动会对心肌的结构产生影响[12],国内也有研究证实,大强度运动时骨骼肌线粒体肿胀,个别膨大成絮状,而超大强度运动会导致线粒体体积显著增大,体表面积与体积的比值降低,嵴断裂,基质密度普遍降低,甚至会出现空泡等退行性变化[13-14]。
本研究在观察大鼠的显微结构时发现,EE组大鼠心肌结构遭到破坏,心肌细胞肿胀明显,大量肌纤维发生断裂、排列紊乱,细胞间质纤维增生、水肿,大量炎细胞浸润。其超微结构同样变化明显,大鼠心肌核周基质高度水肿,核周隙变宽,并且可以发现肿胀变大的线粒体,核端基质内线粒体部分嵴和少部分膜融合、模糊不清或缺失,少量肌纤维坏死。而SAL组大鼠心肌显微结构相对于EE组明显好转,偶见肌纤维断裂,间质水肿较轻,可见变性病变,少量炎细胞浸润。此外,LS组超微结构示,线粒体周边水肿,膜嵴融合,局部缺损。HS组超微结构示,线粒体个别轻度融合,核周隙轻度扩张,偶见线粒体膜破损。总体观察HS组相对于LS组线粒体变异程度较轻,线粒体膜结构相对完整。
3.2 红景天苷对力竭大鼠心肌线粒体呼吸功能的影响 人类的心脏每天要消耗大概30 kg ATP以支持收缩活动[15],其中 90% 来源于线粒体[16]。线粒体是真核细胞的主要供能细胞器,是细胞发生呼吸和氧化磷酸化产生ATP的主要场所。线粒体的基本功能就是转换底物的氧化还原势能为质子电化学势能,质子电化学势能再转化为ATP的高能磷酸键[17]。线粒体中物质脱下的氢,经一系列酶及其辅酶辅基连续的传递作用,最后与激活的氧化合成水并释放能量的过程与细胞摄取氧的呼吸过程有关,故称电子传递呼吸链。电子传递链参与将食物转化成化学能的过程,将能量以ATP的形式储存供细胞利用。线粒体呼吸链的电子传递是由5个酶呼吸链复合物(呼吸链复合物Ⅰ~Ⅴ)构成,其中呼吸链复合物Ⅰ(NADH-CoQ还原酶)、呼吸链复合物Ⅱ(琥珀酸-CoQ还原酶)、呼吸链复合物Ⅲ(CoQ-细胞色素C还原酶)及呼吸链复合物Ⅳ(细胞色素氧化酶)是构成酶呼吸链复合物的重要组成部分,其活性变化能直接或间接地反映线粒体的功能变化,线粒体不能充足地供应ATP就会导致能量衰竭[18]。
既往对线粒体功能的分析多采用体外分离法[19-20],即通过离心的方法将线粒体从组织中提取出来,然后通过Clark氧极法[21]来测定线粒体的呼吸功能。虽然该方法也能够通过测定线粒体不同呼吸状态时的耗氧量反映其氧化磷酸化能力,但是体外提取法有如下弊端:①线粒体性质容易受到分离步骤的影响,尤其是从病理损伤组织中提取的线粒体,这种影响体现得更加显著[22]。②需要大量的细胞(200×106)或组织(湿重500 mg以上),以分离出高质量的线粒体。③一些提取方法可能会导致对某一种线粒体族群的特别选择。肿胀的线粒体密度会降低,因此离心提取线粒体时可能会导致对完整细胞器的优先选择,从而使得病理的细胞器所占比例下降。④分离提取线粒体会破坏正常的线粒体间的相互作用。大量的研究证明,正常线粒体间的相互作用对于代谢通道、内部能量转换等至关重要[23]。本实验采用原位法测定线粒体的功能,即通过透化细胞膜而不破坏线粒体膜结构,使得各种底物可以直接参与线粒体的呼吸过程。应用原位法不仅可以避免体外分离法的弊端,同时可以实现在完整细胞系统中、正常的细胞器位置和装配下,保留与细胞骨架、细胞核和内质网的相互作用,完成对线粒体的分析。因此,原位分析法比体外分离法更能接近正常细胞的生理状态。
既往有研究指出,在动物心脏中,线粒体的缺陷将导致线粒体呼吸链复合物Ⅰ~Ⅳ以及ATP合成酶活性的降低[24-26]。本研究发现EE组大鼠线粒体呼吸链复合物Ⅰ、Ⅱ、Ⅳ的态3呼吸速率明显低于C组,说明力竭大鼠的线粒体呼吸链复合物的活性降低,线粒体的呼吸功能下降。其可能的机制有氧化应激[27-28]、钙超载[29]、电子漏引起质子漏等假说[30-31]。应用SAL后,大鼠心肌线粒体呼吸链复合物Ⅰ、Ⅱ、Ⅳ的态3呼吸速率明显升高,说明此时线粒体呼吸链复合物的活性增加。在ADP充足的态3呼吸时,通过线粒体呼吸链的氧化磷酸化反应,ATP大量生成以供细胞利用,并维持细胞的正常生理功能,从而实现了SAL对大鼠心肌的保护作用。其中,HS组线粒体呼吸链复合物Ⅰ、Ⅱ、Ⅳ的态3呼吸速率均明显高于LS组,则说明SAL对大鼠心肌的保护作用呈剂量依赖性。
综上所述,SAL能够预防力竭运动对大鼠心肌结构产生的损伤,提高心肌线粒体的呼吸功能,从而发挥对心肌的保护作用,并且高剂量SAL的效果要优于低剂量,但SAL更深层次的心肌保护机制还有待于进一步研究。
[1] Wallace D C.Diseases of the mitochondrial DNA[J].Annu Rev Biochem,1992,61(1):1175-1212.
[2] Wallace D C.Mitochondrial diseases in man and mouse[J].Science,1999,283(5407):1482-1488.
[3] Lin M T,Beal M F.Mitochondrial dysfunction and oxidative stress in neurodegenerative diseases[J].Nature,2006,443(7113):787-795.
[4] Schapira A H.Mitochondrial dysfunction in Parkinson's disease[J].Cell Death Differ,2007,14(7):1261-1266.
[5] Vielhaber S,Kunz D,Winkler K,et al.Mitochondrial DNA abnormalities in skeletal muscle of patients with sporadic amyotrophic lateral sclerosis[J].Brain,2000,123(7):1339-1348.
[6] Balaban R S,Nemoto S,Finkel T.Mitochondria,oxidants,and aging[J].Cell,2005,120(4):483-495.
[7] Thomas DP,Marshall K I.Effects of repeated exhaustive exercise on myocardial subcellular membrane structures[J].Int J Sports Med,1988,9(4):257-260.
[8] Veksler V I,Kuznetsov A V,Sharov V G,et al.Mitochondrial respiratory parameters in cardiac tissue:a novel method of assessment by using saponin-skinned fibers[J].Biochim Biophys Acta,1987,892(2):191-196.
[9] Kay L,Nicolay K,Wieringa B,et al.Direct evidence for the control of mitochondrial respiration by mitochondrial creatine kinase in oxidative muscle cells in situ[J].JBiol Chem,2000,275(10):6937-6944.
[10]Letellier T,Malgat M,Coquet M,et al.Mitochondrial Myopathy Studies on Permeabilized Muscle Fibers[J].Pediatr Res,1992,32(1):17-22.
[11]Kuznetsov A V,Schneeberger S,Seiler R,et al.Mitochondrial defects and heterogeneous cytochrome c release after cardiac cold ischemia and reperfusion[J].Am J Physiol Heart Circ Physiol,2004,286(5):H1633-H1641.
[12] Lucena M C,Paniagua R.Effects of exercise to exhaustion in rat myocardium.A stereological study[J].Acta Cardiol,1984,39(6):463-477.
[13]王文成,刘克敏.力竭运动对小鼠心肌线粒体自由基代谢和线粒体功能的影响[J].广州体育学院学报,2008,28(1):106-107.
[14]赵敬国,王福文.力竭性运动后不同时相大鼠心肌形态结构的改变观察[J].中国运动医学杂志,2001,20(3):316-317.
[15] Ferrari R,Cargnoni A,Ceconi C.Anti-ischaemic effect of ivabradine[J].Pharmacol Res,2006,53(5):435-439.
[16] Murray A J,Edwards L M,Clarke K.Mitochondria and heart failure[J].Curr Opin Clin Nutr Metab Care,2007,10(6):704-711.
[17] Wikström M,Saraste M.The mitochondrial respiratory chain[J].New Compr Biochem,1984,6:49-94.
[18] Neubauer S.The failing heart-an engine out of fuel[J].N Engl JMed,2007,356(11):1140-1151.
[19]杨柳青,喻田,刘兴奎,等.含吡那地尔的心脏保存液对大鼠离体心脏线粒体呼吸功能的影响[J].中华麻醉学杂志,2010,30(7):850-854.
[20] Frezza C,Cipolat S,Scorrano L.Organelle isolation:functional mitochondria from mouse liver,muscle and cultured filroblasts[J].Nat Protoc,2007,2(2):287-295.
[21] Poderoso JJ,Fernandez S,CarrerasM C,et al.Liver oxygen uptake dependence and mitochondrial function in septic rats[J].Circ Shock,1994,44(4):175-182.
[22] Piper H M,Sezer O,Schleyer M,et al.Development of ischemia-induced damage in defined mitochondrial ubpopulations[J].J Mol Cell Cardiol,1985,17(9):885-896.
[23] Kay L,Nicolay K,Wieringa B,et al.Direct evidence for the control of mitochondrial respiration by mitochondrial creatine kinase in oxidative muscle cells in situ[J].JBiol Chem,2000,275(10):6937-6944.
[24] Lesnefsky E J,Moghaddas S,Tandler B,et al.Mitochondrial dysfunction in cardiac disease:ischemia-reperfusion,aging,and heart failure[J].J Mol Cell Cardiol,2001,33(6):1065-1089.
[25] Marín García J,Goldenthal M J.Mitochondrial centrality in heart failure[J].Heart Fail Rev,2008,13(2):137-150.
[26] Gnaiger E.Isolated Mitochondria or Permeabilized Tissues and Cells[J].Mitochondr Physiol Network,2007,11:1-4.
[27] Zorov D B,Juhaszova M,Sollott SJ.Mitochondrial ROS-induced ROSrelease:an update and review[J].Biochim Biophys Acta,2006,1757(5-6):509-517.
[28]Sun H Y,Wang N P,Kerendi F,et al.Hypoxic postconditioning reduces cardiomyocyte loss by inhibiting ROSgeneration and intracellular Ca2+overload[J].Am J Physiol Heart Circ Physiol,2005,288(4):H1900-H1908.
[29] Moreno Sánchez R.Regulation of oridativephoshorylation in mitchonodria by external free Ca2+concentratio[J].J Biol Chern,1985,260(7):4028-4034.
[30]徐建兴.呼吸链的电子漏路径和线粒体的超氧自由基代谢及其生物学意义[J].基础医学与临床,2001,21(5):389-394.
[31] Murphy M P.Slip and leak in mitochondrial oxidative phosphorylation[J].Biochim Biophys Acta,1989,977(2):123-141.
