红景天苷对力竭大鼠心肌线粒体生物发生关键调控因子的影响
2014-03-06崔玉娟张龙飞曹雪滨
崔玉娟,张龙飞,平 政,曹雪滨
线粒体是真核细胞进行氧化代谢产生能量的场所,对心肌收缩功能的维持起着至关重要的作用。冷暴露、饥饿、运动等刺激会诱导线粒体数量增加和功能改变,即线粒体生物发生[1]。线粒体生物发生能够提高细胞的能量代谢能力,从而满足心肌持续收缩所需能量。目前研究表明线粒体生物发生的主导协调因子——过氧化物酶增殖物激活受体γ辅助激活因子-1α(Peroxisome proliferator-activated receptorγ coactivator 1α,PGC-1α)在线粒体活动中发挥了中心作用,它是控制线粒体生物发生转录通路上游的调节共激活因子,能通过强烈地诱导核呼吸因子-1(nuclear respiratory factor-1,NRF-1)和核呼吸因子-2(nuclear respiratory factor-2,NRF-2)基因的表达刺激线粒体生物合成,因此,PGC-1α-NRF-1-NRF-2是调控线粒体生物发生的关键级联信号通路[2]。运动是一种病理生理刺激,适度运动能够诱导 PGC-1α、NRF-1、NRF-2 的表达[3],从而刺激线粒体生物发生。而力竭运动会对机体心脏功能造成负面影响,引起线粒体功能障碍[4],但其分子机制是否与线粒体生物发生有关尚不明确。红景天苷(Salidroside,SAL)是中药红景天中的主要有效成分之一,具有抗心肌缺血缺氧、抑制心肌细胞凋亡、促进血管再生、抗动脉粥样硬化等作用[5-7]。本实验拟通过研究SAL对力竭大鼠心肌线粒体生物发生关键调控因子 PGC-1α、NRF-1、NRF-2在不同时相的表达,为SAL的临床应用提供参考依据。
1 材料与方法
1.1 动物、试剂与仪器 清洁级SD雄性大鼠104只[军事医学科学院实验动物中心提供,许可证号:SCXK(京)2003-1-003]。98%提纯红景天苷粉(南京泽朗植提技术有限公司),兔抗PGC-1α抗体、兔抗NRF-1抗体及兔抗NRF-2抗体(英国Abcam公司),兔抗β-Actin抗体(美国CST公司),HRP标记山羊抗兔IgG(H+L)(中国中杉金桥公司)。凝胶成像系统 Fluor Chem E(美国 Cell Biosciences公司)。Image J 1.44图像分析软件(National Institutes of Health)。
1.2 方法
1.2.1 分组:将104只SD大鼠随机分对照(C)组、力竭(EE)组、低剂量SAL力竭(LS)组、高剂量SAL力竭(HS)组,对照组8只,其余组分4个时间点即即刻、6 h、12 h、24 h 观察,每个时间点8 只。
1.2.2 造模及取材:C及EE组给予生理盐水10 ml/kg灌胃 2周,LS和 HS组给予 SAL 100、300 mg/kg灌胃2周。EE、LS和HS组灌胃结束后分别予以建立一次性力竭游泳模型,C组无需特殊处理。一次性力竭游泳模型建立方法:使用塑料圆桶(高60 cm、直径55 cm)作为大鼠的游泳场地,注意保证水的清洁,水深约 50 cm,水温保持在(32.0±0.5)℃。模型建立前大鼠均进行适应性的无负重游泳练习,每次10 min,造模前大鼠需禁食12 h,造模时大鼠尾部负为体重3%的铅块。一次性力竭游泳运动所达到的力竭状态参考Thomas力竭标准[8]:①大鼠超过10 s沉入水下后无法再返回水面;②大鼠的协调运动消失,出现了无方向性的乱窜,虽少于10 s亦可定为大鼠已力竭。对于短时间(2 h)内就出现了运动不协调的大鼠,将其捞出休息5 min后,继续进行游泳运动至其力竭。达到力竭标准后,将大鼠捞出,吹干皮毛,并记录结束时间。力竭后即刻、6、12、24 h,立即摘除3个模型组大鼠心脏,去除心房,于缓冲液中洗去心脏残留血渍,装入2 ml离心管中,做好标记,置于液氮中冷冻后于-80℃冰箱中保存。同时期相同方法处理 C组大鼠。
1.3 观察指标
1.3.1 大鼠一般状况及游泳时间:观察3个模型组力竭运动前后的一般状况,记录并比较EE、LS、HS组力竭游泳时间。
1.3.2 大鼠心肌 PGC-1α、NRF-1、NRF-2的蛋白表达测定:以 β-actin作为内参。提取心肌蛋白,用BCA蛋白测定法测定蛋白浓度。取15μg蛋白质样品行SDS-PAGE电泳,电泳后转移至PVDF膜,1%脱脂奶粉稀释一抗 PGC-1α、NRF-1、NRF-2、β-actin分别按照1∶1000、1∶500、1∶500、1∶1000 的比例稀释4℃孵育过夜,漂洗3次,HRP标记山羊抗兔IgG按照1∶10 000的比例稀释,漂洗3次。使用ECL试剂盒发光显影,放入凝胶成像系统 Fluor Chem E中曝光显影,使用Image J 1.44图像分析软件计算蛋白表达量。
1.4 统计学分析 应用SPSS 13.0软件进行统计学分析,所有数据均用均数±标准差(x±s)表示。各组间数据符合正态、方差齐(α>0.1)时采用单因素方差分析,方差不齐时采用Dunnertt法,α=0.05为检验水准。
2 结果
2.1 一般状况及游泳时间 各模型组大鼠力竭运动前活动自如,皮毛光亮,一般状况可;力竭游泳运动后表现为极度疲劳的状态:呼吸急促,运动迟缓,对刺激的反应不灵敏,部分动物甚至出现了结膜充血、血尿等征象。EE、LS及HS组游泳时间分别为(500.8 ± 18.0)、(580.9 ± 17.5)、(675.9 ±20.2)min,LS及HS组游泳时间较EE组明显延长(P<0.05),HS组游泳时间较LS组明显延长(P<0.05)。
2.2 各组心肌蛋白表达量比较
2.2.1 心肌PGC-1α蛋白表达量:EE、LS及HS组PGC-1α蛋白表达量均为即刻最低,6 h最高,差异有统计学意义(P<0.05)。与C组比较,EE组各时相心肌PGC-1α蛋白的表达量均降低(P<0.05)。与相同时相的EE组比较,LS组即刻、6、24 h,HS组各时相心肌PGC-1α蛋白表达量均显著增高(P<0.05)。与相同时相的LS组比较,HS组即刻、24 h PGC-1α蛋白的表达量显著降低,6、12 h显著增高,差异有统计学意义(P<0.05)。见表1、图1。
2.2.2 心肌NRF-1蛋白表达量:各组不同时相心肌NRF-1蛋白表达比较,LS组6 h表达量最高,即刻表达量最低;HS组6 h表达量最高,24 h表达量最低。与C组比较,EE组即刻、6 h、24 h心肌NRF-1蛋白表达量显著降低(P<0.05)。与相同时相的EE 组比较,LS组6、12、24组,HS组即刻、12 h心肌NRF-1蛋白表达量显著增高(P<0.05)。与相同时相的LS组比较,HS组各时相心肌NRF-1蛋白表达量均显著降低(P<0.05)。见表1、图1。
2.2.3 心肌NRF-2蛋白表达量:EE、LS及HS组NRF-2蛋白表达量均为12 h表达量最高,即刻表达量最低(P<0.05)。与C组比较,EE组即刻、6 h、24 h心肌NRF-2蛋白表达量显著降低(P<0.05)。与相同时相的EE组比较,LS组即刻、6 h、12 h,HS组各时相心肌NRF-2蛋白表达量均显著增高(P<0.05)。与相同时相的LS组比较,HS组6、12、24 h心肌NRF-2蛋白表达量均显著增高(P<0.05)。见表1、图1。
3 讨论
在真核生物体内,细胞呼吸、能量产生及其他代谢过程均发生在线粒体内。线粒体是细胞代谢活动的重要调节器,是真核生物的糖、脂肪和氨基酸进行氧化最终释放能量的场所。力竭运动后心肌耗氧量增加,细胞内三磷腺苷(ATP)减少,影响细胞内各种生化反应的进行,从而使心肌正常功能受到损害。PGC-1a作为线粒体生物合成的关键调节因子,对维持生物活动的能量平衡起到重要的生理意义[9]。Ventura Clapier等[10]通过对降低心肌氧化能力在心脏衰竭的发病机制中作用的研究表明,心脏及骨骼肌在压力超负荷下由于PGC-1a及其下游的NRF-2等因子的表达下调而引起线粒体功能减弱。本研究结果显示,所有力竭运动后大鼠的PGC-1α、NRF-1和NRF-2的蛋白表达量均低于对照组,表明力竭运动会降低心肌线粒体的功能。此外,很多研究表明在接触外源性氧化应激[11-13]或应答氧化损伤[14]时,线粒体生物生成会增加。本研究中各组PGC-1α和NRF-2蛋白均在力竭后即刻的表达量最低,随时间延长蛋白表达量有所升高,PGC-1α在6 h升到最高,NRF-2在12 h达高峰,无进一步升高趋势。表明线粒体生物发生是力竭大鼠应对心肌缺血缺氧的氧化应激反应。
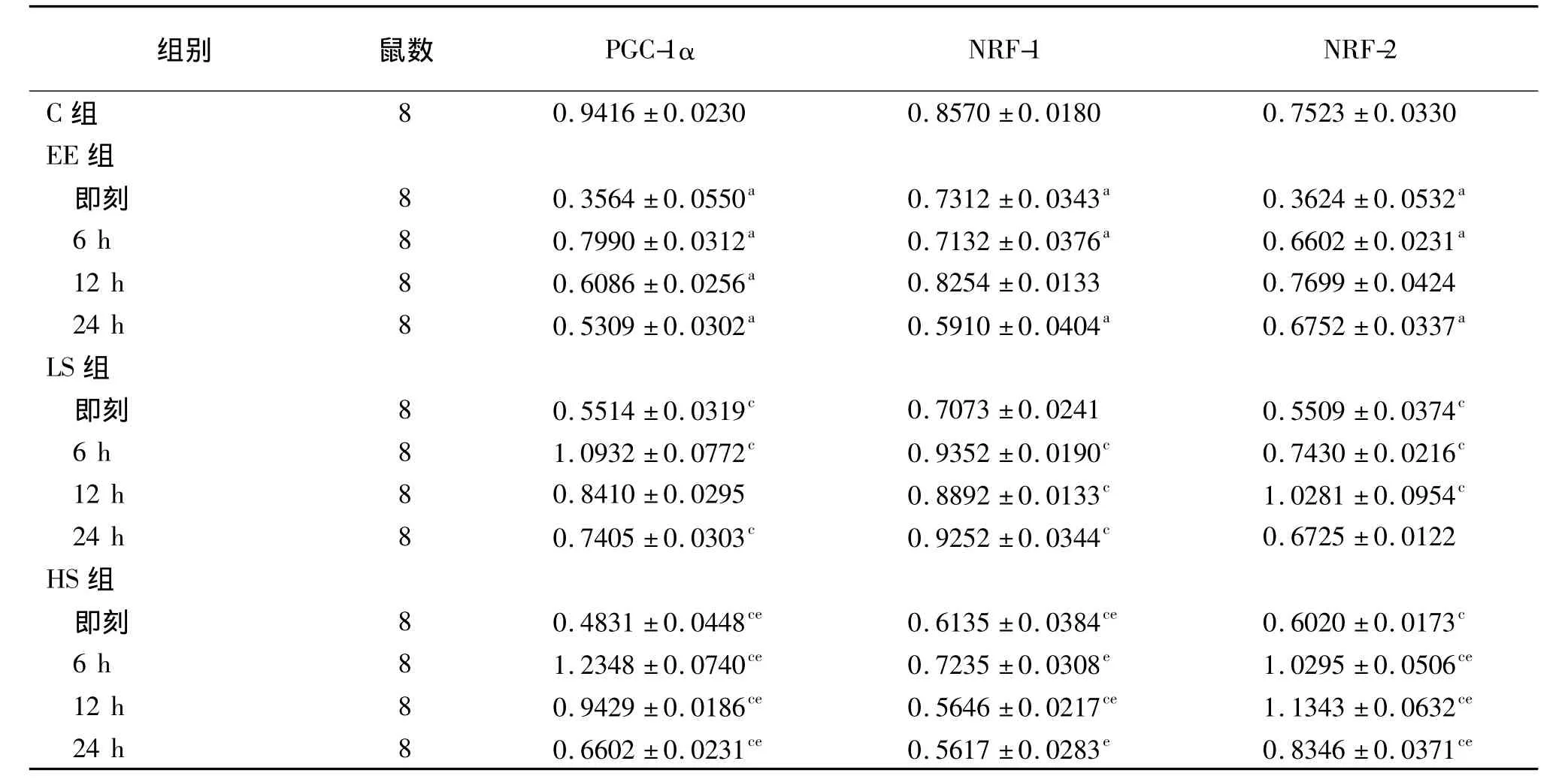
表1 各组大鼠心肌PGC-1α、NRF-1、NRF-2蛋白表达量比较(x±s)

图1 各组大鼠心肌PGC-1α、NRF-1、NRF-2蛋白表达PGC-1α.过氧化物酶增殖物激活受体γ辅助激活因子-1α,NRF-1.核呼吸因子-1,NRF-2.核呼吸因子-2;C组.对照组,EE组.力竭组,LS组.低剂量红景天苷力竭组,HS组.高剂量红景天苷力竭组
红景天是多年生草本植物,多生长于亚洲的高海拔地区与欧洲北极地区的干燥沙地,在恶劣的生长环境中表现出耐寒、耐干旱、耐强紫外线照射等特性,这表明红景天对环境的适应能力很强,生命力非常旺盛。作为红景天主要活性物质SAL的临床药用价值很高,尤其在心血管疾病治疗方面,近些年来对其研究越来越多。有研究表明,SAL对缺氧诱导的心肌细胞损伤有保护作用[15]。杨雷等[16]的研究表明,SAL能促进心肌梗死后大鼠心肌组织血管的再生。而本研究中LS及HS组力竭游泳时间均明显高于EE组,说明SAL能够增强大鼠的运动耐力。LS组PGC-1α、NRF-1和 NRF-2及 HS组的 PGC-1α和NRF-2蛋白表达量显著高于EE组,说明SAL能够上调线粒体生物发生调节关键因子PGC-1α和NRF-2的表达,低剂量SAL能够上调NRF-1的表达,从而刺激线粒体的生物发生,对力竭运动产生的心肌损伤起保护作用。但HS组的NRF-1蛋白表达未见上调,可能是高剂量SAL通过对其他因子的调节影响了NRF-1的蛋白表达,具体机制仍需进一步研究。
综上所述,力竭运动会造成心肌损伤,影响线粒体的功能,而SAL能通过刺激线粒体的生物发生形成对心肌的保护作用。SAL具有很好的开发前景,但其对心脏疾病的作用机制尚未完全清楚,仍需深入研究。
[1] Diaz F,Moraes C T.Mitochondrial biogenesis and turnover[J].Cell calcium,2008,44(1):24-35.
[2] Scarpulla R C.Metabolic control of mitochondrial biogenesis through the PGC-1 family regulatory network[J].Biochim Biophys Acta,2011,1813(7):1269-1278.
[3] Baar K,Wende A R,Jones T E,et al.Adaptations of skeletal muscle to exercise:rapid increase in the transcriptional coactivator PGC-1[J].FASEB J,2002,16(14):1879-1886.
[4] Davies K J,Quintanilha A T,Brooks G A,et al.Free radicals and tissue damage produced by exercise[J].Biochem Biophys Res Commun,1982,107(4):1198-1205.
[5] Zhong H,Xin H,Wu L X,et al.Salidroside attenuates apoptosis in ischemic cardiomyocytes:a mechanism through a mitochondria-dependent pathway[J].JPharmacol Sc,2009,114(4):399-408.
[6] Wu T,Zhou H,Jin Z,et al.Cardioprotection of salidroside from ischemia/reperfusion injury by increasing N-acetylglucosamine linkage to cellular proteins[J].Eur J Pharmacol,2009,613(1):93-99.
[7] Qian E W,Ge D T,Kong SK.Salidroside promotes erythropoiesis and protects erythroblasts against oxidative stress by up-regulating glutathione peroxidase and thioredoxin[J].J Ethnopharmacol,2011,133(2):308-314.
[8] Thomas D P,Marshall K I.Effects of repeated exhaustive exercise on myocardial subcellular membrane structures[J].Int J Sports Med,1988,9(4):257-260.
[9] Scarpulla R C.Metabolic control of mitochondrial biogenesis through the PGC-1 family regulatory network[J].Biochim Biophys Acta,2011,1813(7):1269-1278.
[10]Ventura Clapier R,Garnier A,Veksler V.Transcriptional control of mitochondrial biogenesis:the central role of PGC-1α[J].Cardiovasc Res,2008,79(2):208-217.
[11] Arany Z,He H,Lin J,et al.Transcriptional coactivator PGC-1αcontrols the energy state and contractile function of cardiac muscle[J].Cell Metab,2005,1(4):259-271.
[12] Irrcher I,Ljubicic V,Hood D A.Interactions between ROSand AMPkinase activity in the regulation of PGC-1α transcription in skeletal muscle cells[J].Am J Physiol Cell Physiol,2009,296(1):C116-C123.
[13] Suliman H B,Carraway M S,Welty Wolf K E,et al.Lipopolysaccharide stimulates mitochondrial biogenesis via activation of nuclear respiratory factor-1[J].JBiol Chem,2003,278(42):41510-41518.
[14] Rasbach K A,Schnellmann R G.Signaling of mitochondrial biogenesis following oxidant injury [J].J Biol Chem,2007,282(4):2355-2362.
[15]宋月英,闫玉仙,韩慧文.红景天苷药理研究进展[J].武警医学院学报,2008,17(7):635-637.
[16]杨雷,刘暖,毛秉豫,等.红景天苷上调大鼠心肌梗死后心肌组织VEGF的表达[J].南阳理工学院学报,2013,5(6):120-124.
