黄檗叶片内酚酸质量分数的时序变化及其抗虫性1)
2014-03-05张凯王琪
张 凯 王 琪
(东北林业大学,哈尔滨,150040) (黑龙江省森林保护研究所)
何冬明 李媛媛 严善春 曲凤静 宋大北
(青岛冠中生态股份有限公司) (东北林业大学) (内蒙古克什克腾旗林业局)
在昆虫与植物的相互作用中,植物形成了一套完整的防御体系,化学防御在植物抵抗外界压力中发挥着重要作用[1],其中次生代谢物质被认为是昆虫主要的化学防御物质[2]。酚酸是植物与抗虫性有关的重要次生物质[3-4],也是合成植物毒素的前体物质[5]。植物体内酚酸类物质含量的高低与昆虫数量及虫害侵染程度存在一定的相关性[6-7]。植物受外界胁迫时能够引发其酚酸类化合物的合成[8-10]。
黄檗(Phellodendron amurense Rupr.)又称黄波椤,是东北三大硬阔之一。一直以来有关黄檗病虫害大发生和危害的报道很少。在本研究的前期调查过程中发现,黄波椤丽木虱(Calophya nigra Kuwayama)[11]对黄檗的危害较重,其若虫在叶部刺吸树液致使树叶萎缩变形,同时若虫从肛门不断排出大量的含糖粪便,由此诱发煤污病造成大量叶片萎缩溃烂,影响树木生长和发育。6月份,黄檗的植株及叶片危害率相对较低,7月份被害率明显升高,雌株被害率甚至高达90%以上(见表1)。可见,黄檗同样会遭受虫害侵染,且不同生长时期的受害程度有明显差别。本研究测定不同性别、不同树龄及不同生长时期的健康和受害黄檗叶片内酚酸质量分数的变化,分析酚酸质量分数与黄檗抗虫性之间的关系,为黄檗人工林的有效管理和害虫防治提供理论参考。
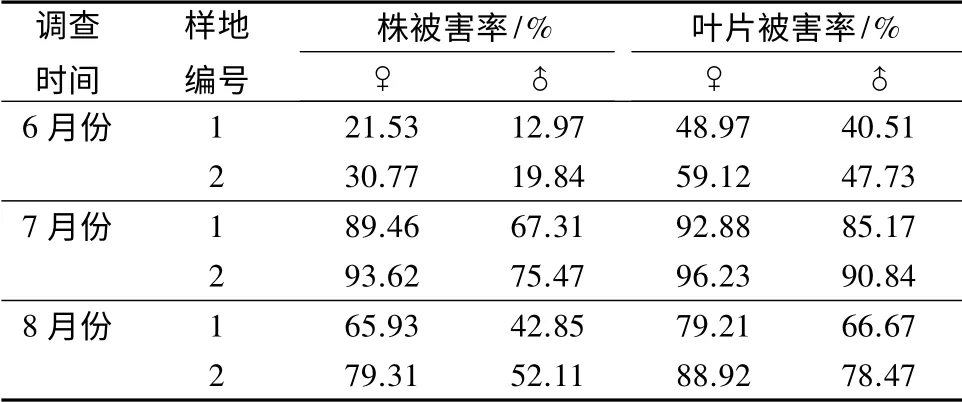
表1 不同月份调查样地的黄檗植株被害率
1 材料与方法
1.1 植物材料
由于在5月底,黄波椤丽木虱的若虫较少,对植株没有造成明显的危害,而9月底黄檗已开始大量落叶[12-13],且此时若虫已发育为成虫,不再对黄檗进行危害。因此,本研究将6月、7月和8月3 个月份的样叶作为试验材料。共设2 块调查样地,样地1 位于黑龙江省哈尔滨市香坊区松乐公园,黄檗林龄为37年生,伴生树种为白桦、榆树、紫丁香、榆叶梅,郁闭度为0.6。样地2 位于东北林业大学哈尔滨实验林场,黄檗林龄为56年生,伴生树种为樟子松、蒙古栎、榆树、乌苏里鼠李、暖木条荚蒾,郁闭度为0.7。在样地内随机抽取健康和受害的黄檗雌雄植株各6 株,在每株样树树冠的上、中、下3 个层次的东、南、西、北4 个方向,即12 个方位采摘健康叶片,将同株样树上所采摘的叶片充分混合后,装入夹链袋内,并迅速放入冰盒,带回实验室放入冰柜中-40 ℃保存待测。
1.2 酚酸测定
酚酸提取:参照文献[14]略做改动。取黄檗叶片干样1 g 立即置于25 mL 三角瓶中,加入1 mol/L NaOH 15 mL,密封,超声振荡3 h,过滤。用1 mol/L HCl 将滤液pH 值调至2,加NaCl 达到饱和,用乙醚将其经高速冷冻离心机抽提3 次(0 ℃条件下8 000 r/min 离心6 min,重复3 次),合并乙醚相,加无水硫酸钠脱水至无结晶析出,用旋转蒸发器旋转至干,加入2 mL 色谱纯甲醇,使其干物质完全溶解,用0.22 μm 微孔滤膜过滤,作为待测提取液。
酚酸标样配制:分别称取12 种酚酸标准样品各1 mg,用色谱纯甲醇定容至10 mL 配成12 种酚酸混合标样母液。
色谱分析条件:参照文献[15]略做改动,采用Waters 高效液相色谱测定待测提取液中的酚酸。色谱柱为C18柱,柱温为室温,二极管阵列检测器,检测波长254 nm,自动进样,流速0.45 mL/min。流动相A 为V(甲醇)∶V(水)∶V(冰乙酸)= 10 ∶88 ∶2;B为V(甲醇)∶V(水)∶V(冰乙酸)= 90 ∶8 ∶2。洗脱程序:0 ~20 min,A 为100%~98%;20 ~55 min,A为98%~50%;55~60 min,A 为50%~100%。
酚酸的定性与定量:根据酚酸标准品的保留时间及其在254 nm 的紫外吸收光谱对样品中的酚酸定性,用Waters 色谱工作站测定纯度后,依据外标曲线计算酚酸质量分数(mg·g-1)。每个样品测定重复3 次。酚酸总量为每个样品中所有酚酸质量分数的总和。
1.3 数据分析
数据处理使用SPSS16.0 软件,采用Univariate模型对性别、树龄、健康状况和生长时期进行交互效应分析(α=0.05 或α=0.01);以One-Way ANOVA(单向方差分析法)和Paired-Sample T Test(配对样本t 检验)进行差异显著性分析,以最小差异显著法LSD 对性别、树龄、健康状况和生长时期的影响进行多重比较分析。
2 结果与分析
2.1 黄檗被害率
由表1可见,黄檗植株被害率在不同生长时期受害程度有明显差异;在6月份被害率最低,在7月份被害率最高,达96.23%;在8月份被害率较7月份有所下降,但仍然高于6月份。雌雄株之间、株被害率和叶片被害率存在明显差异,两个样地中不同月份的被害率均是雄株低于雌株,且都是株被害率低于叶片被害率。比较不同样地雌雄性植株被害率,发现在性别相同的情况下,样地1 植株被害率在调查的3 个月份中均小于样地2。
调查结果表明,黄檗植株被害率在不同生长时期受害程度有明显差异;且雌雄株之间、株被害率和叶片被害率也有明显差异。由表1可见:在6月份被害率程度最低,在样地1 和样地2 中株被害率最低可达12.97%,叶片被害率最低可达40.51%。在7月份被害率程度最高,样地1 和样地2 中株被害率最高可达93.62%,叶片被害率最高可达96.23%。在8月份被害率位于6、7月份中间,样地1 和样地2 中株被害率为42.85%~79.31%介于6、7月份之间,叶片被害率为66.67%~88.92%介于6、7月份之间。各个月份和各个样地中的被害率均是雄株低于雌株,且都是株被害率低于叶片被害率,6—8月份样地1 和样地2 的株被害率、叶片被害率均是雄株低于雌株,且株被害率低于叶片被害率(见表1)。
2.2 不同生长时期黄檗健康和受害植株的叶片内酚酸种类的差异
在不同生长时期黄檗健康和受害植株的叶片内检测到原儿茶酸、绿原酸,咖啡酸、香豆酸、水杨酸、苯甲酸、苯乙酸、阿魏酸和肉桂酸9 种酚酸(见表2)。从表2中可看出,6月份,健康和受害植株的叶片内都检测到香豆酸和肉桂酸。56年生的健康雄株的酚酸种类最少,仅检测到3 种酚酸;7月份,健康和受害植株的叶片内均检测到绿原酸、香豆酸、苯甲酸、苯乙酸和肉桂酸。37年生的受害雌株的酚酸种类最多,检测到9 种;8月份,健康和受害植株的叶片内共同检测到香豆酸、苯甲酸、苯乙酸和肉桂酸。3 个月份中,受害植株的酚酸种类均多于健康植株,如原儿茶酸、水杨酸或阿魏酸多出现在受害植株中。在检测到的酚酸中原儿茶酸的质量分数最低。
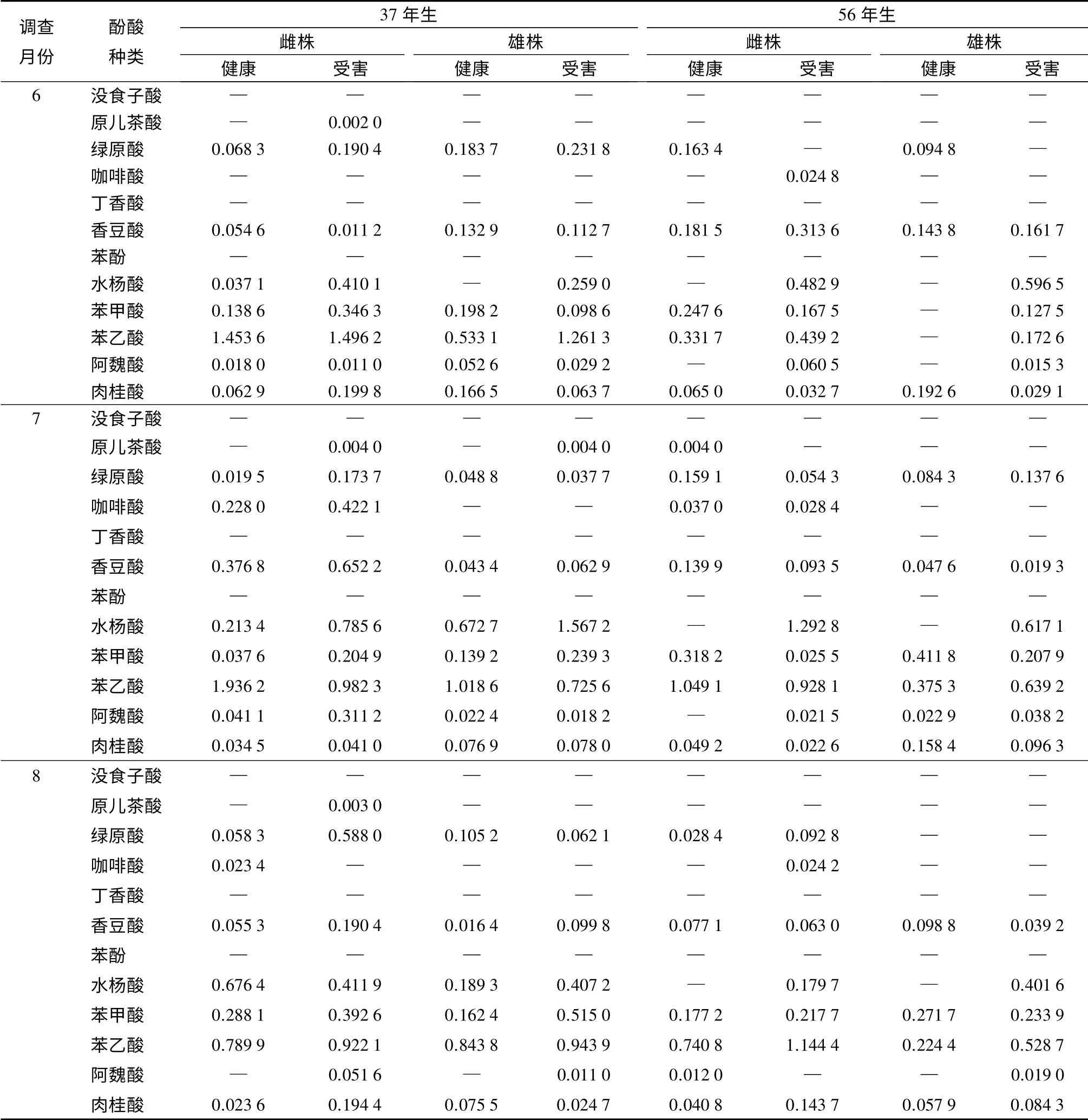
表2 不同生长时期黄檗健康和受害植株的叶片内酚酸质量分数及种类 mg·g-1
2.3 黄檗性别、树龄、健康状况和生长时期对叶片内酚酸总量的影响
从表3中可看出,性别对叶片内酚酸总量的影响差异显著(P<0.05),而树龄、健康状况及生长时期对叶片内酚酸总量的影响差异均极显著(P<0.01)。
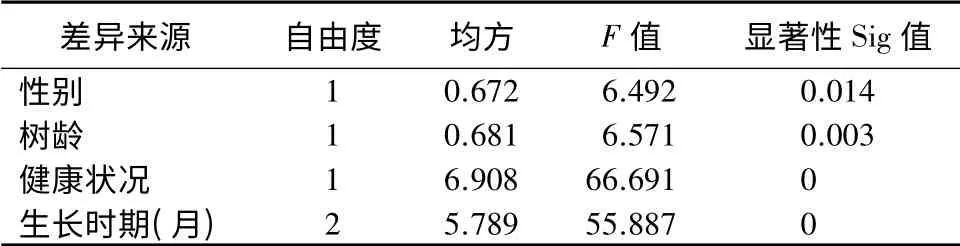
表3 影响黄檗叶片内酚酸总量的四因素方差分析
2.4 不同生长时期黄檗健康和受害植株的叶片内酚酸总量的时序变化
从表4中可看出,不同树龄的健康和受害雌雄株叶片内酚酸总量,从大到小依次为7月份、8月份、6月 份,且7月 份 均 与6月 和8月 差 异 极 显 著(P<0.01),健康和受害植株酚酸总量之间的差异均显著(P<0.05)。3 个月份中,不同树龄的健康和受害雌株的酚酸总量均极显著高于雄株的(P<0.01),且不同树龄之间酚酸总量的差异也均极显著(P<0.01)。

表4 不同生长时期黄檗健康和受害植株叶片内酚酸总量的时序变化 mg·g-1
3 结论与讨论
植物和昆虫在长期的协同进化过程中不断相互作用,形成了各种防御及适应机制。植物体内酚酸含量的变化是其适应昆虫作用产生的初级代谢和次级代谢相互协调的结果[16]。植物体内酚酸的积累与其抗性有关[17-18]。本研究结果表明,在6、7、8月份中,健康和受害的黄檗叶片内酚酸总量,从大到小依次为7月份、8月份、6月份,这一变化趋势与其害虫黄波椤丽木虱的种群数量变化趋势相吻合。说明黄檗在长期与黄波椤丽木虱的协同进化过程中形成了独特的随时序调整抗虫性的机制。比较分析健康与受害黄檗叶片酚酸种类,发现受害黄檗叶片酚酸种类较多。7月份,总酚酸的质量分数最高,37年生受害植株叶片检测到咖啡酸、香豆酸、水杨酸质量分数显著高于健康植株,并新增加了原儿茶酸;绿原酸、苯甲酸、苯乙酸、阿魏酸质量分数下降,由此推测黄檗是通过改变自身各酚酸组份及含量来防御丽木虱的危害。
植物对昆虫的防御是通过害虫胁迫引起植物生理的应激反应,即植物体内产生不同保护防御性物质的变化来实现的。37年生的黄檗雌雄叶片内总酚酸质量分数显著高于56年生,前者受害虫危害率明显低于后者;56年生受害叶片的多种酚酸质量分数显著低于健康叶片,而37年生受害叶片的多种酚酸质量分数显著高于健康叶片,表现出更强的可诱导性。说明黄檗在不同林龄等级其自身的抗性应激能力发生了变化。Wang 等[19]对剪叶及虫害处理的兴安落叶松防御酶的研究也表明,兴安落叶松的幼嫩组织在损伤处理后能够表现出更强的可诱导性,而衰老组织相对较弱。
黄檗为雌雄异株[20],雌株叶片内酚酸总量显著高于雄株,且受害后雌株叶片内多种酚酸质量分数也显著高于雄株,这与二者的生理特点有关。雌株具有结实的生理特性,其在结实过程中需要吸收大量的养分,其本身的生理代谢机能较雄株更为旺盛,储备的能量源也更为丰富[21]。在防御外界危害时,植物储备的能量源,将一部分分配于其防御系统,以抵御危害,其代价往往是生长速率[22]的降低。相对雄株而言,雌株在遭遇害虫危害时可用于防御的能量源相对较多,因此表现其防御物质的可诱导性也相对较强。
由此可见,黄檗酚酸的种类和含量在不同性别、树龄以及不同健康状况的植株上的表现有所不同,说明其抗性强弱与这3 个因素非常密切,因此可以根据这一变化规律对抗性较弱的黄檗,采取适当的管理措施维护林木的正常生长,达到防虫抗虫的目的。
[1] 严善春,袁红娥,王琪,等.叶损伤诱导兴安落叶松针叶中10 种酚酸的变化[J].应用生态学报,2010,21(4):1000-1006.
[2] Xu Jing,Ebada S S,Proksch P. Pestalotiopsis a highly creative genus:chemistry and bioactivity of secondary metabolites[J].Fungal Diversity,2010,44(1):15-31.
[3] Kang Wenyi,Li Caifang,Liu Yuxin. Antioxidant phenolic compounds and flavonoids of Mitragyna rotundifolia (Roxb.)Kuntze in vitro[J]. Medicinal Chemistry Research,2010,19(9):1222-1232.
[4] Maddox C E,Laur L M,Li Tian. Antibacterial activity of phenolic compounds against the phytopathogen Xylella fastidiosa[J]. Current Microbiology,2010,60(1):53-58.
[5] Myster R W. Foliar pathogen and insect herbivore effects on two landslide tree species in Puerto Rico[J]. Forest Ecology and Management,2002,169(3):231-242.
[6] Adams J M,Rehill B,Zhang Yangjian,et al. A test of the latitudinal defense hypothesis:herbivory,tannins and total phenolics in four North American tree species[J]. Ecological Research,2009,24(3):697-704.
[7] Massey F P,Ennos A R,Hartley S E. Herbivore specific induction of silica-based plant defenses[J]. Oecologia,2007,152(4):677-683.
[8] 赵颖,黄凤宽,童晓立,等.水稻品种中抗褐飞虱抗原次生物质的分析[J].应用生态学报,2004,15(11):2161-2164.
[9] 左彤彤,迟德富,王牧原,等.不同品系杨树酚酸类物质对青杨脊虎天牛的驱避作用[J].植物保护学报,2008,35(2):160-164.
[10] An Yu,Shen Yingbai,Wu Lijuan,et al. A change of phenolic acids content in poplar leaves induced by methyl salicylate and methyl jasmonate[J]. Journal of Forestry Research,2006,17(2):107–110.
[11] 许雄山,侯爱菊,刘景全.黄波椤丽木虱的初步研究[J].东北林业大学学报,1991,19(增刊):197-207.
[12] 田厚军.温度对小菜蛾咬食后菜心释放挥发物及其功能的影响[D].福州:福建农林大学,2009.
[13] 王文杰,李文馨,祖元刚,等.紫茎泽兰茎和叶片色素及叶绿素荧光相关参数对不同温度处理的响应差异[J].生态学报,2009,29(10):5424-5433.
[14] Louband M,Van Doorn W G. Wound-induced and bacteria-induced xylem blockage in roses,Astibe and Viburnum[J]. Postharvest Biology and Technology,2004,32(3):281-288.
[15] Christeller J T. Evolutionary mechanisms acting on proteinase inhibitor variability[J]. European Journal of Biochemistry,2005,272(22):5710-5722.
[16] Kestring D,Menezes L C C R,Tomaz C A,et al. Relationship among phenolic contents,seed predation,and physical seed traits in Mimosa bimucronata plants[J]. Journal of Plant Biology,2009,52(6):569-576.
[17] Baque M A,Lee E J,Paek K Y. Medium salt strength induced changes in growth,physiology and secondary metabolite content in adventitious roots of Morinda citrifolia:the role of antioxidant enzymes and phenylalanine ammonia lyase[J]. Plant Cell Reports,2010,29(7):685-694.
[18] Kováˇcik J,Klejdus B,Štork F,et al. Prey-induced changes in the accumulation of amino acids and phenolic metabolites in the leaves of Drosera capensis L.[J]. Amino Acids,2012,42(4):1277-1285.
[19] Wang Qi,Yan Shanchun,Shi Lei,et al. Effects of needle cutting and larval herbivory on systemic induction of antioxidant defense enzymes in Larix gmelinii[J]. Scandinavian Journal of Forest Research,2011,26(1):61-68.
[20] 傅立国.中国红皮书:稀有濒危植物[M].北京:科学出版社,1991:527-528.
[21] 张健,严善春,王琪.落叶松结实量对其防御酶和蛋白酶抑制剂活力的影响[J].林业科学,2009,45(8):96-100.
[22] Coley P D,Bryant J P,Chapin F SⅢ. Resource availability and plant antiherhivore defens[J]. Seience,1985,230:895-899.
