盐胁迫对3 种外生菌根真菌生长的影响1)
2014-03-05张峰峰谢凤行孙海波李亚玲赵玉洁
张峰峰 谢凤行 周 可 孙海波 李亚玲 赵玉洁
(天津市农业生物技术研究中心,天津,300192)
盐渍土是地球陆地上分布广泛的一类土壤,目前全世界约有9.54 亿hm2,我国约有9 913 万hm2[1],并且有逐年增加的趋势,土壤盐渍化已成为影响农林业生产和植物分布的重要因素。如何采取措施降低盐分对植物的胁迫或提高植物的耐盐能力,是盐渍土生物改良的核心问题。近年来,通过生物改良技术提高植物耐盐性的思想已被人们所接受。外生菌根真菌是与植物根系共生的土壤真菌,其宿主植物主要是被子植物和裸子植物中的乔木,具有较高的生产力。大量研究表明,外生菌根真菌可扩大宿主根系的吸收面积,提高宿主植物吸收营养和水分的能力,减少盐离子对宿主的毒害等,从而具有提高植物的耐盐性[2-4]、促进宿主植物在干旱盐碱环境生长的作用,对生态系统的恢复和重建具有十分重要的意义。天津滨海新区作为我国三大经济特区之一,在开发的过程中,面临着盐碱地绿化难的问题。本研究选用红绒盖牛肝菌(Xerocomus chrysenteron)、灰环粘盖牛肝菌(Suillus laricinus)、灰鹅膏菌(Amanita vaginata)3 种外生菌根真菌在培养基上进行耐盐性试验,通过分析盐胁迫对3 种外生菌根真菌生长的影响,研究外生菌根真菌的抗盐性,为其在盐碱地区的开发利用提供科学依据。
1 材料与方法
1.1 供试菌种和培养基
红绒盖牛肝菌、灰环粘盖牛肝菌、灰鹅膏菌为天津市农业生物技术研究中心微生物实验室保藏菌种。采用PDA 培养基和MMN 培养液。
1.2 盐胁迫对菌根真菌菌丝生长速度的测定
在pH=7.0 的PDA 培养基中,分别加入0.2、0.4、0.6、0.8 mol·L-1的NaCl,以不加NaCl 为对照。将培养基经高压湿热灭菌(121 ℃,20 min),取20 mL 倾入直径为90 mm 的培养皿内。在PDA 培养基上培养7 d 的菌根真菌上,取菌落边缘直径为6 mm 的菌饼,分别接种于不同浓度NaCl 的培养皿中,置于恒温箱内25 ℃培养。每个菌种重复4 次,处理数为3×5×4。每天按垂直方向测量菌落直径,直到菌落长满培养皿为止。在pH=7.0 的PDA 培养基中,分别加入0.1、0.2、0.3、0.4 mol·L-1Na2SO4,以不加Na2SO4为对照。灭菌接种,测量方法同NaCl 处理。
1.3 盐胁迫对菌根真菌菌丝生物量的测定
在pH=7.0 的MMN 培养液中,分别加入0.2、0.4、0.6、0.8 mol·L-1NaCl,以不加NaCl 为对照。分装250 mL 的三角瓶内(100 mL·瓶-1),高压湿热灭菌(121 ℃,20 min)。在PDA 培养基上培养7 d的菌根真菌上,取菌落边缘直径为6 mm 的菌饼,分别接种于不同浓度NaCl 的培养液中,置于恒温摇床上25 ℃培养,转速为100 r·min-1。每个菌种重复3 次,处理数为3×9×3。10 d 后将培养液中的菌丝体过滤,用去离子水冲洗,置于烘箱内105 ℃烘至恒质量,干燥器内冷却后,用AL204 型电子天平称菌丝体干质量。在pH=7.0 的MMN 培养液中,分别加入0.1、0.2、0.3、0.4 mol·L-1Na2SO4,以不加Na2SO4为对照。灭菌接种,测量方法同NaCl 处理。
1.4 菌丝体Na+质量分数的测定
将称质量后的菌丝体置于50 mL 的烧杯中,向烧杯中滴加5 mL HNO3溶液,在电热板上300 ℃加热消解15 min,然后逐滴滴加H2O2,直到溶液中的菌丝体残留物全部消解,继续加热15 min,使剩余酸溶液挥发,冷却后将菌丝体消化液定容至50 mL。用6400A 型火焰光度计测定菌丝体消化液中的Na+质量分数[3]。
1.5 数据处理
用SPSS 15.0 软件进行方差分析。
2 结果与分析
2.1 盐胁迫对外生菌根真菌菌丝生长的影响
2.1.1 红绒盖牛肝菌
由图1可知,红绒盖牛肝菌的菌丝生长较为缓慢。在不同浓度的NaCl 处理下接菌14 d 后(图1A),其菌落直径最高仅为33.7 mm。不同浓度NaCl 处理并未影响菌丝的生长,各个浓度下,第14 d 的菌落直径无显著差异(P>0.05)。在不同浓度Na2SO4处理下,接菌14 d 后,其菌落直径最大仅为47 cm(图1B),各浓度Na2SO4处理间的菌落直径无显著差异(P>0.05)。总之,红绒盖牛肝菌的菌丝生长较为缓慢,不同浓度不同种类的盐分胁迫并未影响其生长。
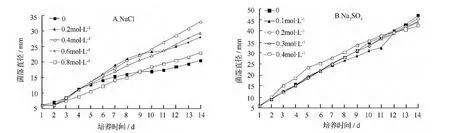
图1 不同盐浓度胁迫下红绒盖牛肝菌的菌落直径增长曲线
2.1.2 灰环粘盖牛肝菌
灰环粘盖牛肝菌在对照中,生长14 d 后其菌落直径为52.5 cm,而在加入不同浓度NaCl 后,其生长受到显著抑制。在低浓度(0.2 mol·L-1)NaCl 胁迫下,接种14 d 后,其菌落直径均低于对照的50%,说明该菌种对NaCl 的胁迫较为敏感(图2A)。在0.6~0.8 mol·L-1NaCl 胁迫下,灰环粘盖牛肝菌生长量均较小,因此,其最大的NaCl 耐受浓度应为0.6 mol·L-1。在各浓度Na2SO4胁迫下,灰环粘盖牛肝菌受到的抑制较大(图2B)。与对照相比,Na2SO4和NaCl 胁迫类似,也严重影响了灰环粘盖牛肝菌菌丝的生长,说明此菌种对Na+比较敏感,低浓度的盐胁迫(0.2 mol·L-1)就可显著抑制其菌丝的生长。
2.1.3 灰鹅膏菌
灰鹅膏菌在NaCl 胁迫下(图3A),对照接种11 d 后长满整个培养皿,生长速度较快。随着NaCl 浓度的增加,其生长受到抑制。在0.8 mol·L-1NaCl处理下生长完全受到抑制,在0.6 mol·L-1NaCl 胁迫下生长量也较少(图3A)。灰鹅膏菌在不同浓度Na2SO4胁迫下(图3B),对照在接种12 d 后长满整个培养皿,随着Na2SO4浓度的增加,其生长也受到抑制,在设定的最大Na2SO4浓度0.4 mol·L-1条件下,其生长虽然受到抑制,但生长量较其在0.8 mol·L-1NaCl 处理下高,说明该菌在加入NaCl 和Na2SO4钠离子浓度相同的情况下,生长受到NaCl 的抑制更大,说明NaCl 中的Cl-也对该菌的生长具有很强的抑制作用。
2.2 盐胁迫对外生菌根真菌日平均扩展速度的影响
由表1可见,红绒盖牛肝菌在0.2、0.4、0.6 mol·L-1NaCl胁迫下,其生长速度显著高于对照(P <0.05),说明NaCl 胁迫并未抑制该菌株的生长,反而有很大的促进作用。灰环粘盖牛肝菌在不同浓度NaCl 胁迫下菌丝生长速度均显著低于对照(P <0.05),低浓度的NaCl 胁迫(0.2 mol·L-1)即可显著抑制其生长速度,说明该菌株对NaCl 的存在较为敏感。灰鹅膏菌则随着NaCl 浓度的逐渐增大其生长速度逐渐降低,在高浓度(0.8 mol·L-1)胁迫下则不生长,各个处理间差异显著(P<0.05)。比较同浓度下不同菌株的生长速度,发现在0、0.2、0.4 mol·L-1NaCl 胁迫下,灰鹅膏菌的生长速度均高于其他2 种菌株,而在0.6、0.8 mol·L-1NaCl 胁迫下,红绒盖牛肝菌的生长速度则高于其他2 种菌株。说明在低浓度NaCl 胁迫下,灰鹅膏菌的生长速度较快,而在高浓度NaCl 胁迫下,红绒盖牛肝菌的生长速度较快。

图2 不同盐浓度胁迫下灰环粘盖牛肝菌的菌落直径增长曲线
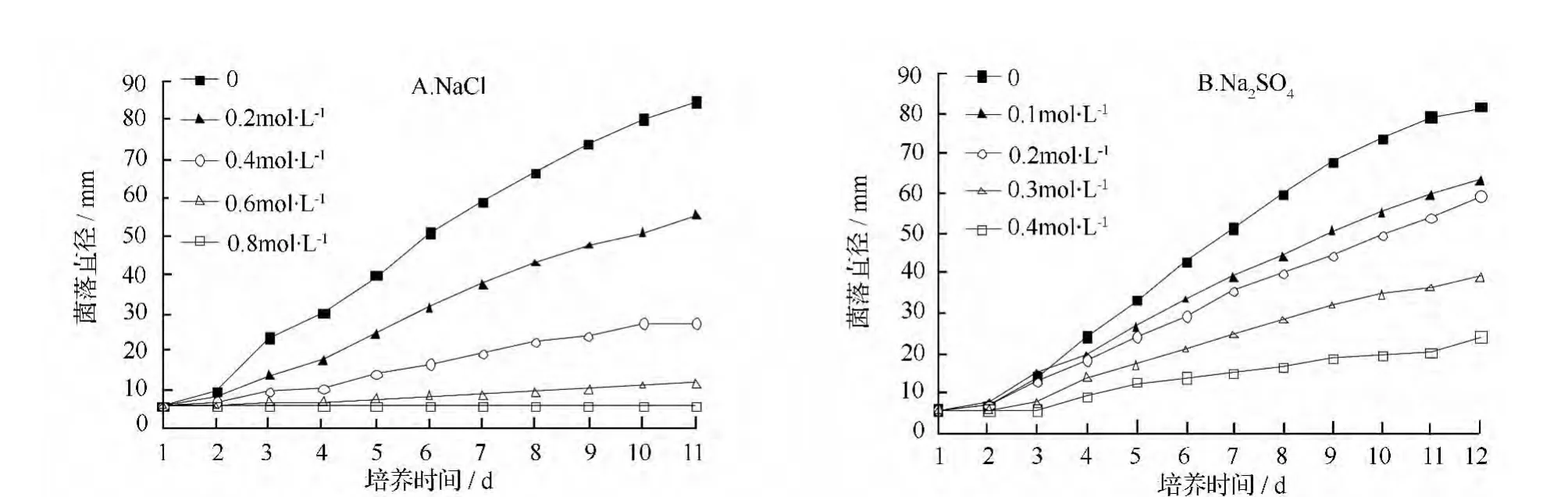
图3 不同盐浓度胁迫下灰鹅膏菌的菌落直径增长曲线
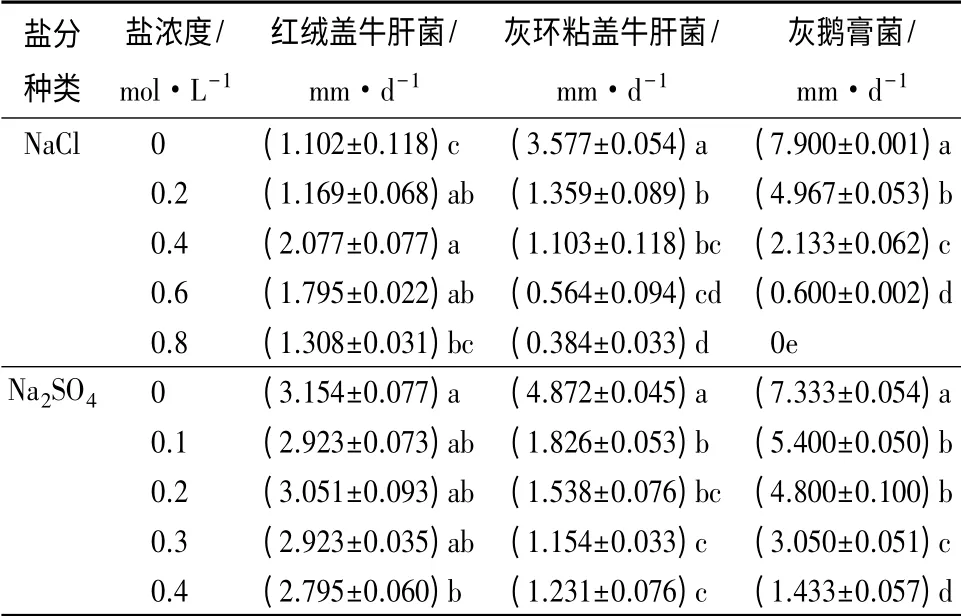
表1 盐胁迫对3 种外生真菌日平均扩展速度的影响
对不同浓度Na2SO4处理下,同一菌株的生长速度进行比较(表1)。结果表明:红绒盖牛肝菌在0.1、0.2、0.3 mol·L-1Na2SO4胁迫下,其生长速度和对照相比无显著差异(P>0.05),而在0.4 mol·L-1Na2SO4胁迫下,其生长速度显著低于对照(P<0.05)。说明低浓度Na2SO4并未抑制其生长。灰环粘盖牛肝菌在Na2SO4胁迫的条件下,菌丝生长速度均显著低于对照(P<0.05),低浓度(0.1 mol·L-1)的Na2SO4胁迫都可显著抑制其生长速度,说明该菌株对Na2SO4的存在较为敏感。灰鹅膏菌的生长速度则随着Na2SO4浓度增大逐渐降低。比较同浓度下不同菌株的生长速度,发现在0.1、0.2、0.3 mol·L-1Na2SO4胁迫下,灰鹅膏菌的生长速度均高于其他2 种菌株,而在0.4 mol·L-1Na2SO4胁迫下,红绒盖牛肝菌的生长速度则高于其他2 种菌株。说明在低浓度Na2SO4胁迫下,灰鹅膏菌的生长速度较快,而在高浓度Na2SO4胁迫下,红绒盖牛肝菌的生长速度较快,这和NaCl 胁迫下的结果类似。
相同盐浓度胁迫下,Na2SO4处理的生长速度均高于NaCl处理,以灰鹅膏菌为例:同为C(Na+)=0.8 mol/L 的条件下,在Na2SO4胁迫下生长速度可达到1.43 mm·d-1,而在NaCl 胁迫下则不生长。这可能由于NaCl 中的Cl-也对菌株的生长具有很强的抑制作用。
2.3 盐胁迫对外生菌根真菌菌丝生物量的影响
不同浓度NaCl 胁迫对3 种外生菌根真菌的生物量都有不同程度的影响(表2)。对不同浓度NaCl 处理下同一菌株的生物量比较可知,红绒盖牛肝菌对照菌株的生物量最高,达0.273 g,低浓度的(0.2 mol·L-1)NaCl 并未影响其生物量,与对照差异不显著(P >0.05),而中高浓度(0.4 ~0.8 mol·L-1)NaCl 胁迫下该菌株的生物量,显著低于对照(P<0.05)。对灰环粘盖牛肝菌而言,中低浓度的(0.2~0.4 mol·L-1)NaCl 并未影响其生物量,与对照差异不显著(P >0.05),而高浓度(0.6 ~0.8 mol·L-1)NaCl胁迫下,该菌株的生物量显著低于对照(P <0.05)。灰鹅膏菌的生物量则随着NaCl 浓度的增加而逐渐减少,各个浓度NaCl 胁迫下的生物量,均显著低于对照(P<0.05)。同浓度NaCl 胁迫下不同菌株的生物量由大到小依次为红绒盖牛肝菌、灰环粘盖牛肝菌、灰鹅膏菌。
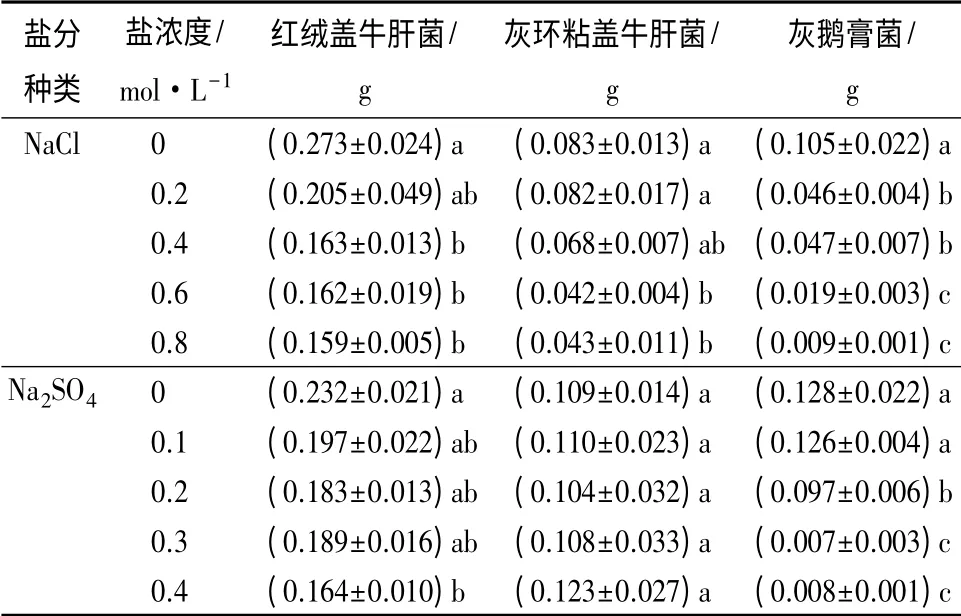
表2 盐胁迫对3 种外生真菌的生物量的影响
不同浓度的Na2SO4对3 种外生菌根真菌的生物量都有不同程度的影响(表2)。红绒盖牛肝菌的生物量受到Na2SO4的影响并不大,在0.1、0.2、0.3 mol·L-1Na2SO4胁迫下,其生物量和对照相比,无显著差异(P>0.05);而在0.4 mol·L-1Na2SO4胁迫下,其生物量和对照差异显著(P<0.05)。这和其在固体平板上的生长速度差异相似。说明Na2SO4对其在液体培养基中的生长具有一定的抑制作用,但是其抑制作用并不强。灰环粘盖牛肝菌并未受到Na2SO4胁迫的影响,在不同浓度下,其生物量并未明显的变化,对照与各个盐浓度下的生物量并无显著差异(P>0.05),说明Na2SO4的存在并未影响其在液体培养基中的生长。灰鹅膏菌的生物量随着Na2SO4浓度的升高,存在明显的降低趋势,虽然在0.1 mol·L-1的情况下其生物量与对照无显著差异,但其在0.3、0.4 mol·L-1的情况下,其生长受到了明显地抑制,说明其不适宜在高浓度的Na2SO4环境中生存。比较同浓度Na2SO4胁迫下不同菌株的生物量,发现红绒盖牛肝菌均高于其他2 种菌株,这和NaCl 胁迫下不同菌株的生物量情况相似,说明红绒盖牛肝菌生物量在盐胁迫下均较高。
对同种菌株在同种盐分不同浓度下的生长速度和生物量进行相关性分析(表3),发现灰鹅膏菌生长速度和生物量显著相关(P<0.05),红绒盖牛肝菌和灰环粘盖牛肝菌的生长速度和生物量无显著相关性(P>0.05),可能和菌株菌丝的密度有较大的关系,生长较快的菌株其菌丝密度不一定较高,其生物量也无相应的增加;也有可能是菌株在固体液体培养基上的表现不同所致,固体培养基氧气供应量较多,适合部分菌株生长,故生长速度较快,而液体培养基提供氧气较少,故部分菌株生物量较少。
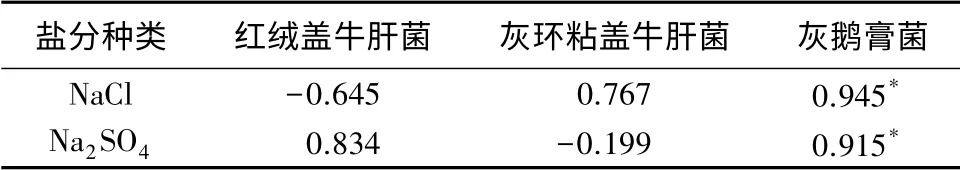
表3 同种盐分不同浓度下的生长速度和生物量相关性
2.4 盐胁迫对外生菌根真菌菌丝体中Na+质量分数的影响
不同浓度NaCl 对3 种外生菌根真菌菌丝体内Na+质量分数都有不同程度的影响(表4)。红绒盖牛肝菌菌丝体中Na+质量分数较低,0.2 mol·L-1NaCl 胁迫条件下,其菌丝体的Na+质量分数为0.90 mg·g-1,和对照菌丝体中的Na+质量分数无显著差异(P>0.05),而在0.4、0.6、0.8 mol·L-1NaCl 浓度下,其菌丝体中的Na+质量分数均超过4 mg·g-1,显著高于对照(P<0.05)。灰环粘盖牛肝菌菌丝体中Na+质量分数较高,随着NaCl 浓度的增加而逐渐增多,其菌丝体的Na+质量分数均显著高于对照(P<0.05),且在0.6 mol·L-1NaCl 浓度下,达到最高,为42.23 mg·g-1。灰鹅膏菌菌丝体中Na+质量分数较高,且随着NaCl 浓度的增加逐渐增多,在NaCl 各浓度胁迫下,其菌丝体的Na+质量分数均显著高于对照(P<0.05),且在0.6、0.8 mol·L-1NaCl 浓度下,达到30 mg·g-1以上。同种菌株在中高浓度(0.4、0.6、0.8 mol·L-1)NaCl 培养基中的菌丝的Na+质量分数并无明显差异,并未随着盐浓度的升高而升高,可能是由于在高浓度下菌丝对Na+吸收也具有饱和性,达到一定含量就不会吸收;另一方面可能由于高浓度下菌丝生长量较少,其对Na+也减少了吸收。比较不同菌株在同一NaCl 浓度下菌丝体中的Na+质量分数,基本呈现出灰环粘盖牛肝菌>灰鹅膏菌>红绒盖牛肝菌的情况,可能是由于红绒盖牛肝菌的生物量较大,降低了菌丝体中的Na+质量分数。
由表4可知,不同浓度Na2SO4对3 种外生菌根真菌菌丝体内Na+质量分数影响较大,但和NaCl 胁迫下的表现不同,对同一菌株菌丝体中Na+质量分数随Na2SO4浓度的升高而逐渐增加,且均显著高于对照(P<0.05),在0.4 mol·L-1Na2SO4浓度下,菌株菌丝体中的Na+质量分数均达到最高。比较不同菌株在同一Na2SO4浓度下菌丝体中的Na+质量分数,也基本呈现出灰环粘盖牛肝菌>灰鹅膏菌>红绒盖牛肝菌的情况,和NaCl 胁迫下的表现相似。说明这3 种菌株对Na+的吸收能力和菌株本身的生长情况有关,而与何种盐分胁迫无关。

表4 盐胁迫对3 种外生真菌菌丝体中Na+质量分数的影响
对不同盐浓度和对应的菌丝体中的Na+质量分数进行相关性分析(表5),发现培养液中的NaCl 浓度和对应的3 个菌株菌丝体中的Na+质量分数均显著相关(P<0.05);培养液中的Na2SO4浓度和对应的3 个菌株菌丝体中的Na+质量分数均为极显著相关(P<0.01)。

表5 不同种类盐浓度和菌丝体中的Na+质量分数相关性
3 结论与讨论
土壤盐渍化是当前农林业生产中不可忽视的问题。土壤盐分含量过高破坏了植物体内的离子平衡,减少了植物对水分的吸收,抑制了植物的生长甚至导致死亡[5-7]。近年来,利用外生菌根真菌提高树木耐盐性的报道较多。Muhsin 等[8]研究表明,在盐分胁迫下,外生菌根真菌能明显降低植物的盐分吸收,提高植物营养吸收和蒸腾作用。Bois 等[9]将3 种外生菌根真菌接种于北美云杉(Picea glauca)和北美短叶松(Pinus banksiana)的实生苗上,发现外生菌根真菌提高了植物在盐胁迫土壤上的存活率和生长量。范克胜等[10]在盐胁迫条件下将3 种微生物接种于美洲黑杨,发现接菌可改善叶片叶绿素荧光和光合参数、光响应参数,减轻盐胁迫对宿主造成的伤害,提高杨树的耐盐能力。总之,外生菌根真菌接种植物可以显著提高植物的耐盐性。
在含盐培养基上对外生菌根真菌的生长情况进行研究是初步鉴定菌株耐盐性的较为有效的方法。Dixon 等[11]在离体培养的条件下,研究6 种外生菌根真菌对NaCl、Na2SO4、Na3C6H5O7的耐受性,发现Pisolithus tinctorius 和 Suillus luteus 对 NaCl 和Na2SO4的耐受性较高。黄艺等[12]对3 种外生菌根真菌在含有不同种类钠盐(NaCl,Na2SO4)的Kottke培养基中进行培养研究,发现2 种盐分的胁迫并未影响B. edulis 的生物量,其菌丝中Na+积累量最高,耐盐性较强。在本研究中,2 种盐分胁迫并未影响红绒盖牛肝菌的生长,其各盐浓度间差异较小;而低浓度的盐胁迫却严重抑制了灰环粘盖牛肝菌生长;灰鹅膏菌的生长状况随着盐浓度的升高而逐渐受到抑制。比较3 种菌株的生长速度,在中低浓度盐胁迫下,灰鹅膏菌的生长速度最快,而在高浓度盐胁迫下,红绒盖牛肝菌的生长速度最快。比较3 种菌株的生物量,发现在2 种盐分条件下均呈现红绒盖牛肝菌>灰环粘盖牛肝菌>灰鹅膏菌的趋势。比较3种菌株菌丝体中Na+质量分数,灰环粘盖牛肝菌>灰鹅膏菌>红绒盖牛肝菌,可能是由于红绒盖牛肝菌的生物量较大,降低了菌丝体中的Na+质量分数。比较相同浓度不同盐分对外生菌根真菌的影响,发现,Na2SO4处理的生长速度、生物量均高于NaCl 处理,特别是高盐浓度(C(Na+)= 0.6 ~0.8 mol/L)下,其表现尤为明显,可能由于NaCl 胁迫下的Cl-也对菌株的生长具有较强的抑制作用。总之,盐分的存在并没有影响红绒盖牛肝菌的生长,其在高盐浓度下的生长速度和生物量均最高,其菌丝体内的Na+质量分数最低,说明该菌株在盐胁迫的条件下,生长良好,是较为理想的耐盐菌株。灰环粘盖牛肝菌对盐胁迫较为敏感,较低浓度的盐胁迫即可降低其生长速度,其菌丝体内Na+质量分数也较高。灰鹅膏菌的耐盐性居中,随着盐浓度的增加,其生长速度和生物量逐渐降低。
有研究表明,外生菌根真菌对盐胁迫的抗性,不仅体现在菌根菌的生长和生物量上,还体现在其营养菌丝对离子的吸收和积累以及平衡调节的能力上。具有良好耐盐碱性的外生菌根真菌可分为2 种类型。一种为吸盐型,即菌根真菌侵染植物后,可吸收大量的离子并储存在菌丝中,以减轻对植物的毒害作用,提高植物对盐胁迫的抗性[13]。Langenfeld等[14]的研究表明菌根菌Paxillus involutus 并非以天然屏障的作用来耐盐碱。另一种为拒盐型,即菌根真菌的菌丝抑制毒害离子的吸收,减少有毒离子进入植物体内,以减轻对植物的危害。Muhsin 等[8]研究发现Hebeloma crustuliniforme 能阻止植物吸收过多的盐分,从而使得植物具有耐盐性。在本试验中,红绒盖牛肝菌则属于后者,在高浓度盐分胁迫下,其菌丝体内的Na+质量分数均低于其他2 种菌株,说明其对Na+的吸收作用较弱,可阻止Na+向植物的转运。还有研究表明,外生菌根真菌菌丝体的生长受培养基成分影响较大[15]。本试验中的红绒盖牛肝菌和黄艺等[12]研究的该菌种耐盐性表现出较大差异,并且各菌种在纯培养条件下与接种后的反映不同。虽然可以通过对培养基上菌种的耐盐性测试来推测接种植物后的响应,但接种的植物种类和环境因子等原因也影响了菌株作用的发挥,具体的接种效应还需进一步的试验探讨。
[1] 王遵亲,祝寿泉,俞仁培.中国盐渍土[M].北京:科学出版社,1993.
[2] 范克胜,吴小芹.3 种外生菌根真菌在杨树栽植区盐碱土壤中的适应性分析[J].南京林业大学学报:自然科学版,2009,33(4):53-56.
[3] Ishida T A,Nara K,Ma Shurong. et al. Ectomycorrhizal fungal community in alkaline-saline soil in northeastern China[J]. Mycorrhiza,2009,19(5):329-335.
[4] Bandou E,Lebailly F,Muller F,et al. The ectomycorrhizal fungus Scleroderma bermudense alleviates salt stress in seagrape (Coccoloba uvifera L.)seedlings[J]. Mycorrhiza,2006,16(8):559-565.
[5] Tester M,Davenport R. Na+tolerance and Na+transport in higher plants[J]. Annals of Botany,2003,91(5):503-527.
[6] Zhu J K. Plant salt tolerance[J]. Trends Plant Science,2001,6(2):66-71.
[7] Munns R. Genes and salt tolerance:bringing them together[J].New Phytologist,2005,167(3):645-663.
[8] Muhsin T M,Zwiazek J J. Colonization with Hebeloma crustuliniforme increases water conductance and limits shoot sodium up take in white spruce (Picea glauca)seedlings[J]. Plant and Soil,2002,238(2):217-225.
[9] Bois G,Bigras F J,Bertrand A,et al. Ectomycorrhizal fungi affect the physiological responses of Picea glauca and Pinus banksiana seedlings exposed to an NaCl gradient[J]. Tree Physiology,2006,26(9):1185-1196.
[10] 范克胜,吴小芹,任嘉红,等.盐胁迫下外生菌根真菌与根际有益细菌互作对杨树光合特性的影响[J].西北植物学报,2011,31(6):1216-1222.
[11] Dixon R K,Rao M V,Garg V K. Salt stress affects in vitro growth and in situ symbioses of ectomycorrhizal fungi[J]. Mycorrhiza,1993,3(2):63-68.
[12] 黄艺,姜学艳,季海波,等.过量钠盐胁迫对3 种外生菌根真菌生长和钠元素积累的影响[J].微生物学通报,2004,31(3):45-49.
[13] Zhong Hua,Li Jing,Chen Shaoliang,et al. Effect of NaCl on growth and ion relation in two salt-tolerant strains of Paxillus involutus[J]. For Stud China,2008,10(2):95-100.
[14] Langenfeld-Heyser R,Gao J,Ducic T,et al. Paxillus involutus mycorrhiza attenuate NaCl-stress responses in the salt-sensitive hybrid poplar Populus×canescens[J]. Mycorrhiza,2007,17(2):121-131.
[15] Pfyffer G E,Rast D M. The polyol pattern of fungi as influenced by the carbohydrate nutrient source[J].New Phytologist,1988,109(3):321-326.
