北京沙地杨树人工林生态系统水分利用策略1)
2014-03-05杨新兵鲁绍伟李少宁潘青华马成东
高 琛 杨新兵 鲁绍伟 李少宁 陈 波 潘青华 马成东
(河北农业大学,保定,071000) (北京市农林科学院林业果树研究所) (河北政法职业学院)
水资源短缺是当今人类社会面临的一个亟待解决的问题,树木在发挥其巨大生态效益的同时,维持自身生长发育需要消耗大量水分,掌握植物对水分的利用规律,是实现水资源合理利用的基础[1]。稳定同位素技术不仅可以指示环境因子与水分循环的关系,而且在植物水分来源、水分运输及分配机制、植物水分利用策略等方面有重大应用[2]。早在20世纪90年代Dawson 等[3]通过分析对比植物体内水分和各来源水的同位素组成,表明:植物根吸水过程、水分经植物茎秆到未栓化的枝条运输过程,不发生同位素分馏。这为分析植物体内水分来源,确定植物对不同水源利用比例提供了理论依据。目前,氢氧稳定同位素示踪技术具有较高的灵敏性和准确性,已成为示踪植物水分来源的有效工具。White等[4]利用水δ(D)值分析白松(Pinus armandii)水分利用策略,指出在夏季地下水位越深白松对雨水的利用率越高;Busch 等[5]对河岸优势种胡杨(Populus euphratica)和柳树(Salix babylonica)研究发现,在生长季节均利用地下水而不是河水;Dawson 等[6]对桉树(Eucalyptus globulus)水分利用策略研究,桉树不仅利用来自降水的浅层土壤水和河水,也利用地下水;Smith 等[7]对树木生长早期水分利用策略进行研究,树木生长早期主要利用浅层土壤水,当土壤干旱缺水时,主要利用地下水,且随着表层土壤干燥程度的上升,对地下水的利用比例增加。上述研究表明,植物水分利用策略因种类、生长季节及水环境的不同而存在差异。国内利用稳定同位素研究植物水分利用方面起步较晚,21 世纪初,石辉、章光新、孙双峰、张光辉、褚建民等[8-12]分别对稳定同位素技术在植物水分来源方面进行了综述和具体应用研究。而目前在北方季节分明的沙地生态系统,主要植被水分利用策略的研究案例较少。因此,本文应用稳定同位素技术测定不同来源水及杨树茎木质部氢氧同位素,并对其与主要环境因子的关系进行定量分析,旨在揭示沙地杨树人工林水分利用策略,以期为华北地区人工造林、经营管理及灌溉用水提供理论依据。
1 研究区自然概况
研究区位于北京市大兴区榆伐镇大兴林场,中心地理坐标为北纬39°31'50″,东经116°15'07″。海拔30 m 左右,土壤为沙土。属暖温带半湿润季风气候,年均气温11.5 ℃,极端最高气温40.6 ℃,极端最低气温-27.4 ℃。年均降水量568.9 mm,降水量分布极不均匀,7—9月降水量占全年降水量的60%~70%。光照时间较长,全年光照时间达2 769.3 h,≥10 ℃的积温4 143 ℃,年均无霜期204 d。该区的风向以北风、西北风为主,冬、春两季多风,且风速大。人工林树种主要是107 欧美杨(Populus×euramericanacv.“74/76”),其中,75%为2002年种植,其余为1998年、2001年、2003年种植,株行距为2 m×4 m。混交树种毛白杨(Populus tomentosa)。林分均匀整齐,林下为当年生草本植物,主要有紫苜蓿(Medicago sativa)、黄香草木樨(Melilotus officinalis)、猪毛菜(Salsola collina)、尖头叶藜(Chenopodium acuminatum)、灰菜(Chenopodium album)、蒺藜(Tribulus terrestris)、附地菜(Trigonotis peduncularis)等。
2 材料与方法
2.1 试验材料
在大兴林场内选取一块20 m×20 m 试验地,对试验地内的杨树进行每木检尺,最终选择8 棵生长良好的杨树作为标准样树(见表1)。于2012年6—11月份定期对样树进行木质部、土壤、地下水及降水取样,每次在光照强度较低的条件下采集,减小外界环境对同位素分析结果的影响。采集杨树样品时,选择东、西、南、北4 个方向两年生杨树枝条,截取直径0.3~0.5 cm,长3~5 cm 的枝段,剥去外皮和韧皮部,将木质部小茎装入4 mL 取样瓶中,用Plam 封口膜密封,迅速放入保温箱内带回实验室-18 ℃保存。在样地内挖取深度为220 cm 土壤剖面,以20 cm 为梯度依次取11 个土层样品,迅速装入取样瓶并密封,放入保温箱内带回实验室-18 ℃保存,并同步取各层土样分析其含水量。利用挖掘法[13]采集地下水,通过随机放置20 个白色塑料瓶收集降水。水样采集后放入保温箱内带回实验室保鲜保存。每次收集取3 个平行样,并于瓶身标注取样时间及平行样号。
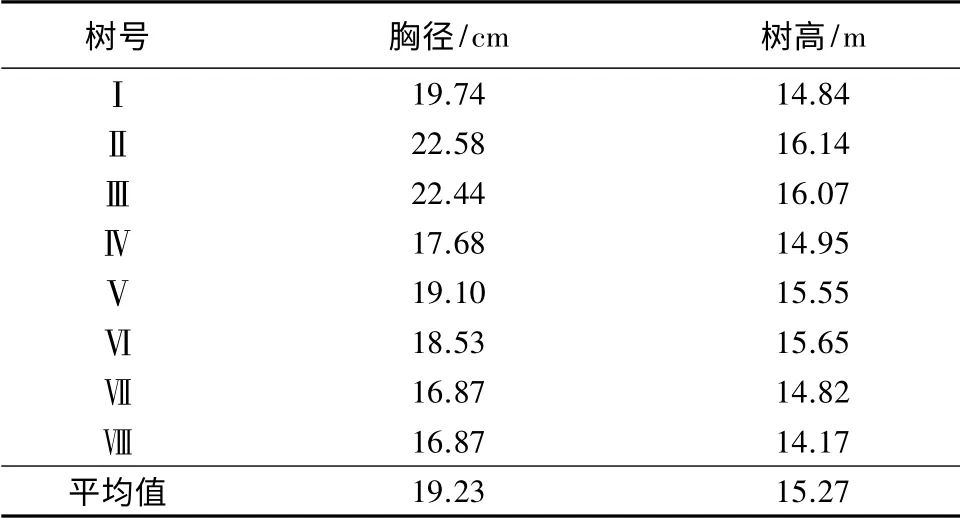
表1 10年生标准样树的基本概况
2.2 测定原理
利用稳定同位素分析欧美杨水分来源的原理在于:绝大部分植物吸水时不能区别对待同一元素的不同核素,只能一并吸取;除了有一些海岸的盐生植物在吸收水分后会导致同位素产生分馏外,绝大多数植物根系吸收的水分以及在植物体茎木质部传输的过程中,水分的δ(18O)、δ(D)值一般不会发生变化[14];植物水分来源主要有:降水、地表径流、土壤水及地下水,不同来源水中的同位素组成不一样。而植物吸收的是降水、地表径流、土壤水和地下水的混合水分[15]。基于以上几点,如果各来源水中的同位素值有差异,且该差异大于实验误差,那么植物吸收各来源水的比例可以用对比植物茎木质水中的δ(18O)、δ(D)值和各个来源水中的δ(18O)、δ(D)值的方式得到。

表2 107 欧美杨水分来源中主要稳定同位素自然丰度
由表2可以看出,重同位素在自然界中的丰度远低于轻同位素在自然界中的丰度,如果以绝对量来表达同位素之间的差异会带来很多不便。因此,利用DELTA V Advantage 同位素比率质谱仪对采集样品(枝条、土壤、降水、地下水等)进行同位素分析时,一般用样品的同位素比值与某种标准样品的同位素的比值δ 来表示同位素之间的差异,公式:

式中:Ⅰ为元素中的重同位素,Ry为样品中的同位素比值;Rb为标准样品中的同位素比值[10]。其中,水样中的氢氧同位素采用国际标准SMOW(即标准平均海洋水)。
2.3 数据处理
采用Excel 2003 和SPSS 16.0 软件,对不同来源水(杨树茎木质部水分、土壤水分、降水、地下水)的δ(18O)、δ(D)稳定性同位素值进行制图和相关性分析,并对δ(18O)同位素值的波动幅度和方差进行分析。同时利用三源线性混合模型[14]计算杨树对不同水源的相对使用量。模型如下:
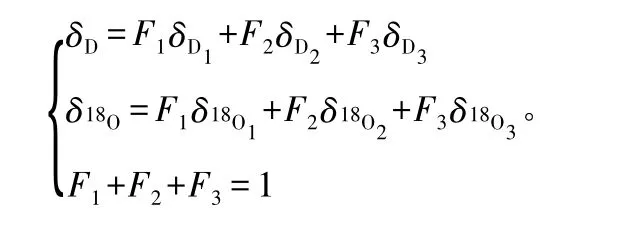
式中δ18O、δD 为杨树枝条木质部水分中稳定氢、氧同位素值,δD1、δD2、δD3为3 个不同水源中稳定氢同位素值;δ18O1、δ18O2、δ18O3为3 个不同水源中稳定氧同位素值;F1、F2、F3为对应的3 个不同水源在杨树茎木质部水分总量中所占的比例。当杨树吸收的水分来源只有1 项时,第2、3 项的比例为0。由于采样、实验分析等原因存在一定程度的误差,导致个别结果不符合实际情况,此方法在计算时,对某一种水源的利用率小于0 时,结果记为0,认为杨树没有吸收此处水分;对某一种水源利用率大于1 时,结果记为1,认为杨树完全利用此处水源。
3 结果与分析
3.1 土壤含水量变化
为了更准确的探讨土壤水氢氧稳定同位素,了解外来水源对土壤水的影响,对夏秋两季0 ~220 cm土层土壤含水量进行绘图分析。如图1所示,夏季土壤含水量变化幅度较大,其中表层和>80 ~180 cm土层含水量较低,其它土层含水量均较高,尤其以60 cm 土层含水量最高,为5.47%。秋季土壤含水量稳定在2%~3%之间,低于夏季。表明夏季外来水源较多,对土壤水的影响较大,而秋季外来水源较少,土壤含水量较稳定。这是因为研究区属于暖温带半湿润季风气候,且土壤为沙质土,夏季频繁的雨水导致土壤含水量增加,雨水在沙质土中短时间内发生入渗,表层土壤水由于受到太阳辐射而大量蒸发,导致表层土壤含水量低于浅层土壤含水量。而秋季降水较少,光照强度弱,从而导致土壤含水量较低且较稳定。
3.2 不同水体同位素季节变化
外来水源在入渗和转化为土壤水并在土壤剖面重新分布的过程中通常发生蒸发现象,导致氢氧同位素的分馏或富集,进而导致不同土层土壤水和地下水δ(D)、δ(18O)值存在差异。对降水、不同深度土壤水和地下水氢氧同位素分析,有利于了解水分的蒸发和入渗过程,掌握土壤水氢氧同位素分馏和富集规律。
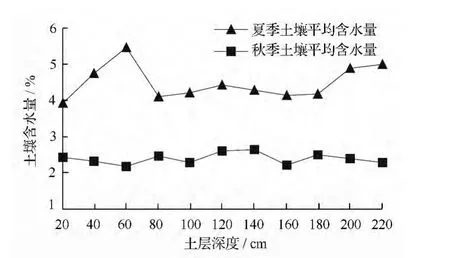
图1 不同季节土壤平均含水量变化
3.2.1 不同水体相关性
由图2可知,夏季(6—8月份)降水,δ(D)、δ(18O)同位素均低于土壤水和地下水;而秋季(9—11月份)除9月份外,其它两个月降水δ(D)、δ(18O)同位素值均高于土壤水。表明夏季降水在转化为土壤水和地下水的过程中发生同位素分馏,即降水在入渗过程中发生蒸发,且转化为土壤水后在土壤剖面重新分布的过程中发生二次蒸发现象。上述过程使得降水在入渗过程中发生重同位素(δ(D)、δ(18O))富集,导致δ(D)、δ(18O)增高。在炎热、光照强烈的夏季,表层土壤水由于氢氧同位素的蒸发和分馏而使重同位素富集,从而使得夏季表层土壤水δ(D)、δ(18O)值较秋季显著偏正,进而导致不同季节土壤水组成发生变化。
夏季土壤水δ(D)、δ(18O)同位素均高于秋季,且随着土层深度的增加,两者之间的差值呈现出减小趋势,在220 cm 土层处基本相等。具体数据如表3所示。6—11月份,20 cm 处土壤水δ(D)、δ(18O)同位素分别为-3.693%~-9.719%、-0.271%~-1.216%,到距地表220 cm 处土壤水δ(D)、δ(18O)同位素值分别为-6.538%~-8.519%、-0.835%~-1.008%,这表明随着土层深度的增加,土壤水稳定性越高,不易受光照、降雨等外部气象和环境因子的干扰而发生同位素的分馏或富集。研究区剧烈的太阳辐射和频繁的降水,对浅层土壤水氢氧同位素值的干扰程度大,而深层土壤水受到的干扰较小。
3.2.2 土壤水氢氧同位素与土层深度相关性
通过对夏秋两季0~220 cm 土层土壤水δ(D)、δ(18O)同位素值拟合,分别得出土壤水δ(D)、δ(18O)同位素值和土层深度之间的关系式(表4),其中h为土层深度。土层深度与夏秋两季土壤水δ(D)、δ(18O)同位素值存在显著的二次多项式关系,R 值均在0.834 1 以上。这一结论与赵良菊等[16]在黑河下游极端干旱区土壤深度与土壤水δ(18O)为线性相关的结果不一致。原因是黑河下游干旱区年降雨量仅为42 mm,降水在入渗到土壤之前已经被蒸发消耗,土壤水只通过河水补给,且水分性质较为稳定;而本研究区属暖温带半湿润季风气候,采样时期内降水较为频繁,表层土壤水蒸发较强,受到外界的干扰较大,而深层土壤水蒸发相对较弱。
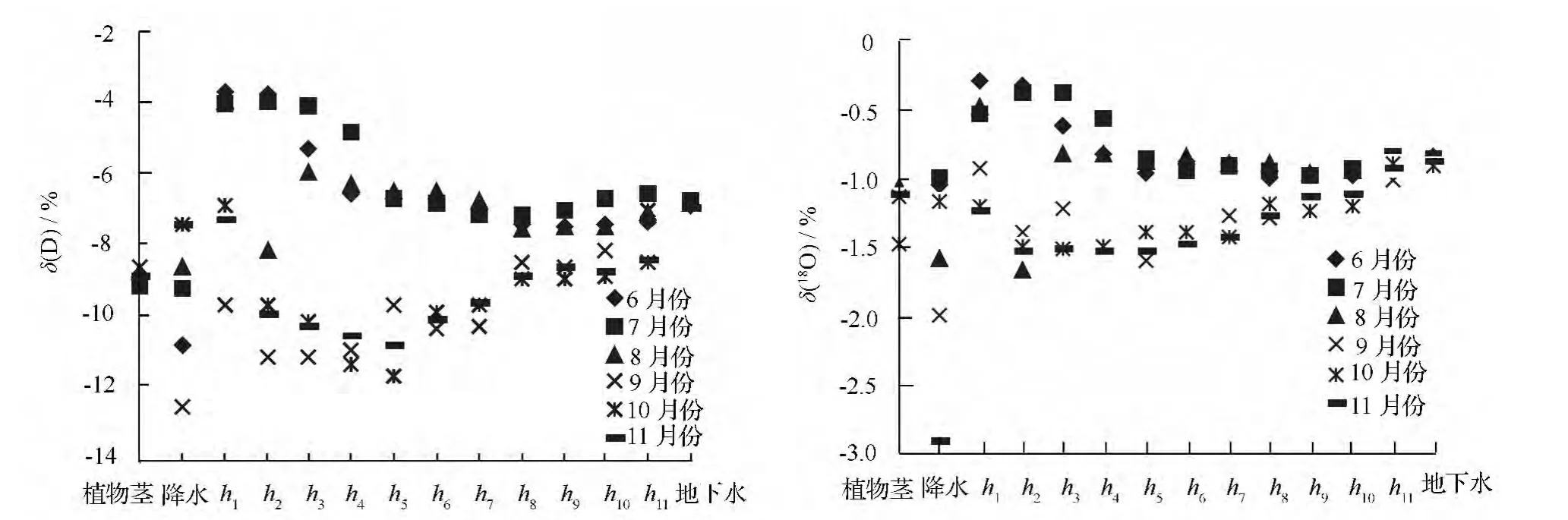
图2 植物茎木质部与不同来源水氢氧同位素值
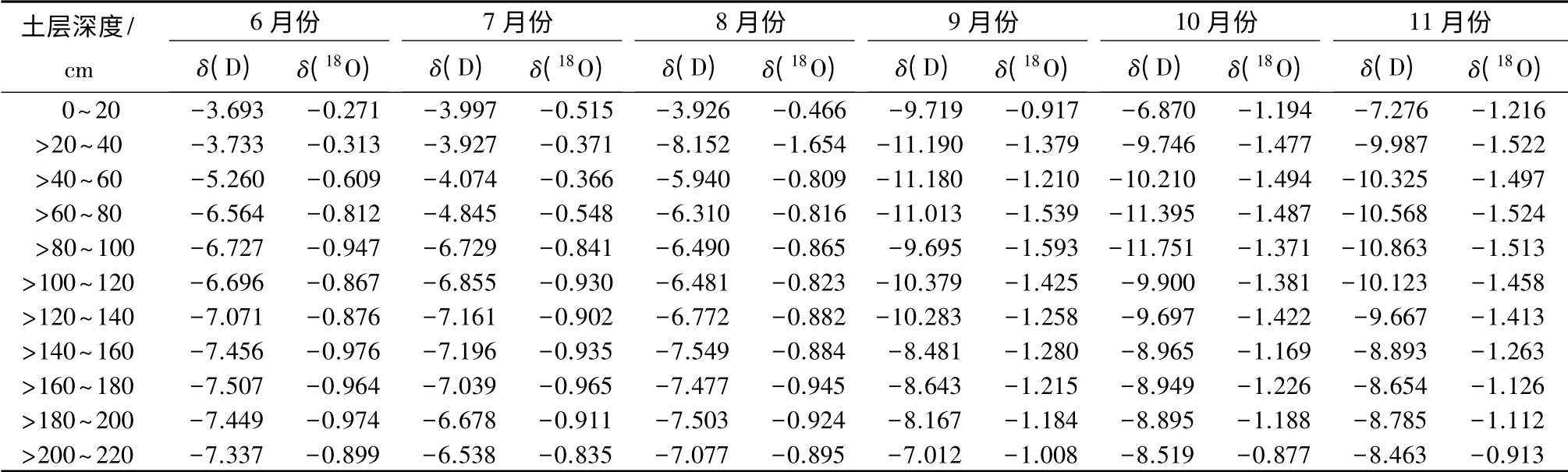
表3 不同月份土壤水δ(D)、δ(18O)同位素值 %
夏秋两季在0 ~100 cm 土壤水变化,越接近土壤表层,土壤水δ(D)、δ(18O)同位素越偏正。夏季100 cm 以下土壤水氢氧同位素值基本达到稳定状态,而秋季土壤水氢氧同位素值在>100 ~120 cm 土层处由原来减小趋势转变为增加趋势,表明秋季>100~120 cm 为土壤水氢氧同位素值的显著变化层(见图2)。这与Asbjornsen 等[17]2007年在美国中西部热带稀疏大草原和森林带的研究结果土壤剖面δ(18O)的显著变化层分别为>60 ~80、>80 ~100 cm存在差异。原因与两个研究地所处的气候、土质条件有关,Asbjornsen 的研究地处于草原地区,植被覆盖率高,蒸发量少,土壤蓄水保水能力强;本研究区为沙地人工林,蓄水保水能力弱,植被覆盖率较低,光照强烈,年降雨量568.9 mm,降水漏渗现象严重,多渗入深层土壤层,在入渗和土壤剖面重新分配的过程中发生蒸发,进而导致显著变化层下降。

表4 土壤水δ(D)、δ(18O)同位素值与土层深度关系
3.3 杨树木质部水与不同潜在水源的关系
由6—11月份各来源水δ(18O)同位素值的波动幅度和方差降序排列见表5,土壤水δ(18O)的波动幅度和方差随深度的增加而减小。其中降水波动幅度和方差最大,分别为1.888%和54.27;地表>20 ~40 cm 处土壤水波动幅度和方差次之,分别为1.209%和37.07。表明降水和>20~40 cm 处的土壤水最易受到外来水源和环境因子的干扰。>20 ~40、>40~60、>60 ~80 cm 处土壤水的波动幅度和方差均大于0~20 cm 处,这是由于表层土壤蒸发强烈,当遇到外来水源时,表层水分迅速被蒸发或下渗,对该层土壤干扰作用小而导致的。>160~180、>180 ~200、>200~220 cm 的土壤水δ(18O)同位素值的波动幅度和方差基本相等,大小均在0.281%~0.276%和1.73~1.63;地下水δ(18O)同位素值最稳定,波动幅度和方差最小,分别为0.079%和0.09。表明160 cm 以下土壤水含量、组成和性质较稳定。
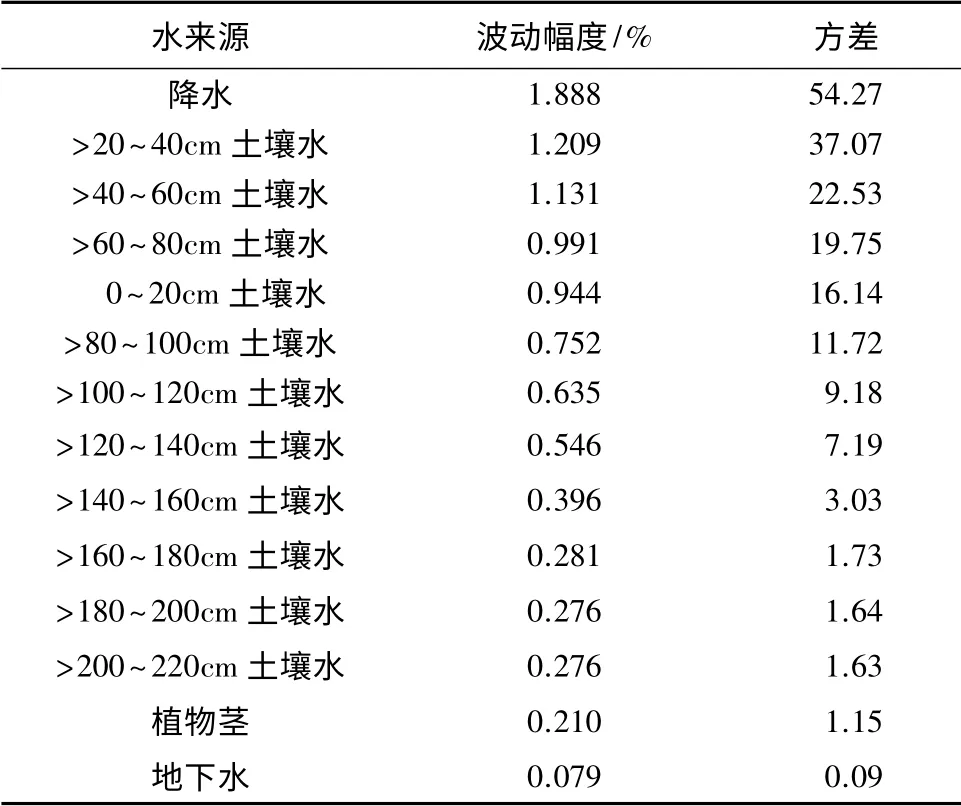
表5 不同来源水及杨树茎木质部水δ(18O)同位素波动幅度及方差
综合得出,160 cm 以下土壤层水和地下水较稳定,不易受到光照、降水等气象因子和环境因子的影响而发生氢氧同位素的分馏和富集。杨树木质部氧同位素的波动幅度和方差分别为0.210%和1.15,且波动幅度和方差介于>160~220 cm 处土壤水和地下水之间,表明在研究区杨树的根系生长较深,呈现出明显的趋水性,能吸收深层土壤水和地下水。这进一步证实了巩国丽[13]等对白刺水分来源的结论的正确性。
3.4 沙地杨树人工林水分利用策略
由于植物木质部水分保留了被根系吸收前水分同位素信息,因此,可利用木质部水和各来源水分δ(D)、δ(18O)作为示踪剂来分析不同水源对植物耗水的贡献,从而判断植物根系有效吸收水分的区域,进而了解沙地杨树人工林水分利用策略[18-19]。根据0~220 cm 土壤剖面土壤水同位素特征,结合枝条木质部、雨水、地下水δ(D)、δ(18O)同位素值,利用三源线性混合模型计算杨树对不同水源的相对使用量(由于此模型只能在植物吸收水分来源不超过3 个的情况下计算,且3 个来源水中δ(D)、δ(18O)值应有明显差异,已得出160 cm 以下土壤水组成成分相似、性质稳定,因此,将160 cm 以下水分归为一组取其平均值计算)。计算结果见表6。由表6可知,在第一组数据中,夏季杨树水分完全由>140 ~160 cm 处的土壤水贡献,贡献率达到了100%;秋季杨树水分由表层0~20 cm 土壤水和>140~160 cm 处的土壤水贡献,贡献率分别为20.67%和79.33%。综合分析得出:夏秋两季>140 ~160 cm 处的土壤水对杨树的贡献率最大,且秋季杨树能少量吸收0 ~20 cm 处浅层土壤水。基本排除了>60 ~80 cm 处土壤水对杨树的影响。
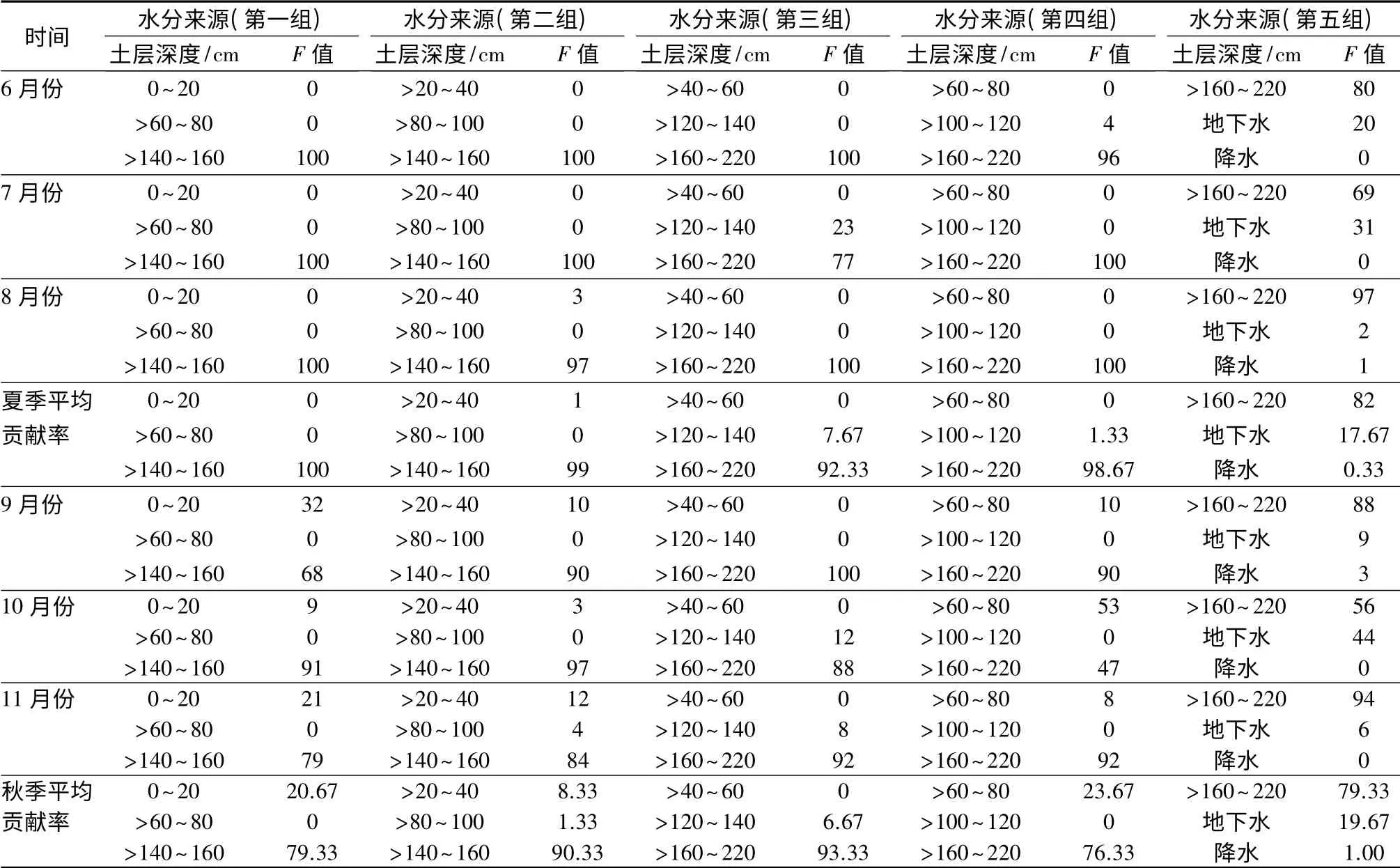
表6 不同来源水对杨树的贡献率 %
在第二组来源水中,夏季>140 ~160 cm 处土壤水对杨树的贡献率最大,且最低贡献率达到97%;秋季>20~40、>80~100、>140~160 cm 三个土层均对杨树水分有所贡献,贡献率分别为8.33%、1.33%和90.33%。由此可知,夏秋两季>140 ~160 cm 处土壤水对杨树水分的贡献率最大,且秋季杨树能少量吸收>20~40、>80~100 cm 处土壤水。
在第三组来源水中,夏季>120 ~140、>160 ~180 cm 处土壤水对杨树水分的贡献率分别为7.67%、92.33%,秋季>120 ~140、>160 ~180 cm 处土壤水对杨树水分的贡献率分别为6.67%、93.33%。综上可知,夏秋两季杨树水分完全由>120~140、>160~180 cm 处土壤水贡献,其中以>160 ~180 cm 处土壤水贡献率大,综合贡献率达到了92.83%。
在第四组来源水中,夏季杨树水分由>100 ~120、>160~220 cm 处土壤水贡献,贡献率分别为1.33%、98.67%;秋季树水分由>60~80、>160~220 cm处土壤水贡献,贡献率分别为23.67%、76.33%。这表明,夏秋两季杨树水分主要由>160 ~220 cm 处土壤水贡献达到了87.50%。
在第五组来源水中,夏季杨树水分由>160 ~220 cm 处土壤水、地下水和降水贡献,贡献率分别为82%、17.67%和0.33%。秋季杨树水分同样由>160~220 cm 处土壤水、地下水和降水贡献,贡献率分别为79.33%、19.67%和1.00%。由此可知,夏秋两季杨树水分主要由>160~220 cm 处土壤水和地下水贡献,综合贡献率分别为80.67%、18.67%。
综合分析五组数据得出,夏季杨树主要吸收140 cm 以下土壤水和地下水,秋季杨树不仅吸收140 cm 以下土壤水和地下水,对浅层土壤水也有少量的吸收。这与赵良菊[16]等在黑河下游研究结果为乔木河岸林多利用地下水存在差异,主要因为前者研究地为河流岸边,水源较为稳定,树木根系的趋水性使得河岸林多利用地下水;而本研究为沙质土人工林区,除降雨外没有外来水源的注入,而沙质土中,土壤颗粒间孔隙大,土壤质地疏松,保水能力差,不仅利于植物根系的生长,而且利于水分的下渗,导致浅层土壤含水量少,夏季太阳辐射高,光照较强,造成浅层土壤水大量蒸发,使得杨树根系生长较深,多吸收深层土壤水和地下水来维持植物体内的水量平衡,而秋季光照强度相对较弱,光照时间短,蒸发相对较小,杨树不仅吸收深层土壤水和地下水,而且在浅层土壤中含有一定量可供杨树根系吸收的水分。
4 结论
不同季节杨树林水分利用策略不同,夏季杨树主要吸收140 cm 以下土壤水和地下水,秋季杨树除了吸收140 cm 以下土壤水和地下水外,对浅层土壤水也有少量的吸收。这一水分利用策略表明:杨树根系在浅层和深层土壤中均有分布,杨树根系的生长表现为明显的趋水性,且主根深入深层土壤中,为杨树吸取深层土壤水和地下水提供了条件,而浅层土壤含有大量的侧根,是杨树吸取浅层土壤水和雨水的基础。此种根系分布特征保证了杨树在干旱和湿润季节采用不同的水分利用策略,从而保证自身水分的需要,是植物对环境适应性的表现。
[1] 李丁,马金珠,南忠仁.民勤盆地地下水水位下降特征与可持续利用评价[J].中国沙漠,2004,24(6):734-739.
[2] 郭范,上官志冠.稳定同位素和元素组成判定潜水河雨后地表径流水的构成[J].地球化学,1994,23(1):42-49.
[3] Dawson T E,Ehleringer J R. Isotopic enrichment of water in the“woody”tissues of plants:Implications for plant water source,water uptake,and other studies which use the stable isotopic composition of cellulose[J]. Geochimica et Cosmochimica Acta,1993,57(14):3487-3492.
[4] White J W C,Cook E R,Lawrence J R,et al. The DH ratios of sap in trees:Implications for water sources and tree ring DH ratios[J]. Geochimica et Cosmochimica Acta,1985,49(1):237-246.
[5] Busch D E,Ingraham N L,Smith S D. Water uptake in woody riparian phreatophytes of the southwestern United States:a stable isotope study[J]. Ecological Applications,1992,2(4):450-459.
[6] Dawson T E,Ehleringer J R. Streamside trees that do not use stream water[J]. Nature,1991,350(6316):335-337.
[7] Smith S D,Wellington A B,Nachlinger J L,et al. Functional responses of riparian vegetation to streamflow diversion in the eastern Sierra Nevada[J]. Ecological Society of America,1991,1(1):89-97.
[8] 石辉,刘世荣,赵晓广.稳定性氢氧同位素在水分循环中的应用[J].水土保持学报,2003,17(2):163-166.
[9] 章光新,何岩,邓伟.同位素D 与18O 在水环境中的应用研究进展[J].干旱区研究,2004,21(3):225-229.
[10] 孙双峰,黄建辉,林光辉,等.稳定同位素技术在植物水分利用研究中的应用[J].生态学报,2005,25(9):2362-2371.
[11] 张光辉,陈宗宇,聂振龙,等.黑河流域地下水同位素特征及其对古气候变化的响应[J].地球学报,2006,27(4):341-348.
[12] 褚建民.干旱区植物的水分选择性利用研究[D].北京:中国林业科学研究院,2007.
[13] 巩国丽,陈辉,段德玉.利用稳定氢氧同位素定量区分白刺水分来源的方法比较[J].生态学报,2011,31(24):7533-7541.
[14] Wershaw R L,Friedman I,Heller S J. Hydrogen isotope fractionation of water passing through trees[J]. New York:Pergamon,1966:55-67.
[15] Gregg J W. The differential occurrence of the mistletoe,Phoradendron juniperinum,on its host,Juniperus osteosperma in the western United States[D]. Department of Biology,University of Utah,1991.
[16] 赵良菊,肖洪浪,程国栋,等.黑河下游河岸林植物水分来源初步研究[J].地球学报,2008,29(6):709-718.
[17] Asbjornsen H,Mora G,Helmers M J. Variation in water uptake dynamics among contrasting agricultural and native plant communities in the Midwestern US[J]. Agriculture,ecosystems & environment,2007,121(4):343-356.
[18] 张建锋,周金星.林木根系衰老研究方法与机制[J].生态环境,2006,15(2):405-410.
[19] Ehleringer J R,Dawson T E. Water uptake by plants:perspectives from stable isotope composition[J]. Plant,Cell & Environment,1992,15(9):1073-1082.
