西藏猪模型对新型生物人工肝治疗安全性的评估*
2014-03-04熊龙辉何国林潘明新
熊龙辉,何国林,张 志,汪 艳,潘明新,高 毅
(南方医科大学珠江医院肝胆二科,广州510282)
物理性人工肝对肝衰竭的临床治疗有一定的支持效果,但生物型人工肝的疗效评价需进一步研究[1]。生物人工肝对肝衰竭模型治疗效果的评价是一项复杂的工程,涉及动物肝衰竭模型的建立、生物反应器中肝细胞的大量培养、治疗过程中治疗模式及参数的选择、生命体征的监护、治疗前后血液指标变化、并发症的防治等。若上述任何一个环节出现问题,可能会导致整个实验失败。故本研究利用西藏猪模型评估新型生物人工肝治疗的安全性,希望能够对生物人工肝大动物体外循环、肾脏透析、肝衰竭模型的疗效评价及远期临床应用提供一定的经验。
1 材料与方法
1.1 材料 6只40~50 kg雌性西藏猪,由南方医科大学实验动物中心提供(合格证号:SCXK粤2011-0015)。所需材料包括新一代组合型肝肾支持系统(由南方医科大学和中国科学院电工研究所共同研制)、人工肝血液管路(自行设计)、膜型血浆分离器(日本旭化成可乐丽医疗株式会社)、一次性血液灌流器(HA330-Ⅱ)、一次性血液透析双腔导管、一次性7F双腔中心静脉导管、有创血压心电监护仪、盐酸氯胺酮注射液、丙泊酚注射乳剂。
1.2 方法
1.2.1 生物人工肝实验猪模型制备 实验前适应性喂养1周,术前禁食12 h,自由饮水。氯胺酮肌肉注射诱导麻醉结合股静脉持续泵入丙泊酚维持麻醉,术中间断追加咪达唑仑镇静,待麻醉满意后,常规消毒铺单,并心电监护,观察实验过程中心电图、心率、呼吸频率、血氧饱和度。分别于股动脉及颈内静脉置管以备实验用。
1.2.2 实验猪肝肾支持系统上机 实验猪上机前所有管路以及滤器先用肝素盐水循环20 min,再用706代血浆预充管路,给予静脉注射地塞米松5 mg,肌肉注射盐酸异丙嗪注射液25 mg,经双腔管按0.5 mg/kg给予首剂肝素,启动肝素泵,按0.05 mg·kg-1·h-1追加肝素,每小时监测活化部分凝血酶时间(APTT),根据APTT值调整肝素泵的速率,治疗结束前1 h停止追加肝素。血泵流量调节为50~60 mL/min,分浆泵流量调节为15 mL/min,倒向泵(LDP)1、LDP2流量调节为18 mL/min,反应器往返周期为0.4 min。连接压力监测器检查各个报警装置。每头实验猪接受总共8 h的治疗,前2 h模拟混合模式(血液吸附灌流联合生物人工肝治疗),后6 h模拟单纯生物治疗模式(撤掉灌流器),每隔1 h记录1次静脉压、跨膜压、入浆壶压,动态监测实验猪的动脉血压、血氧饱和度、心率、呼吸、心电图。治疗过程中,每隔2 h输入0.9%生理盐水200 mL进行冲管,以防止堵塞滤器和管路,密切注意猪的胸廓起伏、生命体征的变化。治疗结束后,继续观察实验猪饮食、饮水、生命体征变化。同时从实验开始及实验4、8 h股静脉采血行血培养、内毒素测定,具体由南方医科大学珠江医院检验科执行。
1.3 统计学处理 采用SPSS13.0统计软件进行分析,计量资料以±s表示,样本均数间比较采用单向方差分析,系统稳定性采用质量控制图进行分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 一般状况 6只猪在实验过程中及实验结束后均存活良好。实验过程中未出现低血压、高血压、抽搐、透析综合征、发热、出血等不良反应。治疗7 d后未见发热、切口感染、出血等并发症。生物人工肝机器运行过程中无故障,无管路爆破、漏血,血浆分离器未见破膜等情况,实验开始时及实验4、8 h抽血所测得的内毒素结果均小于0.5 EU/mL,血培养结果显示培养15 d未见细菌生长。混合模式治疗实验图见图1。
2.2 实验过程中生命体征变化 西藏猪在实验过程中心电图无明显异常,各时间点平均动脉压、呼吸频率差异无统计学意义(P>0.05),实验2 h心率与实验开始时比较差异有统计学意义(P<0.05),实验2 h心率的均数落在质控图下限外,血氧饱和度、呼吸频率、平均动脉压样本均数各时间点均在控制线内,均能维持相对稳定状态,实验5 h出现心率加快,血氧饱和度降低,平均动脉压下降的情况。见表1。
表1 西藏猪实验过程中各时间点生命体征变化(±s)

表1 西藏猪实验过程中各时间点生命体征变化(±s)
时刻 心率(次/分)呼吸频率(次/分)血氧饱和度(%)平均动脉压(mm Hg)实验开始时84±4 25±13 96±2 105±4 1 h 79±4 21±3 91±16 101±5 2 h 71±9 23±7 94±8 101±9 3 h 80±5 21±5 96±2 99±6 4 h 89±8 25±9 93±7 96±11 5 h 91±7 21±4 90±3 91±7 6 h 77±8 19±2 94±5 99±8 7 h 76±7 20±3 91±2 100±2 8 h 83±10 23±6 92±13 99±6
2.3 生物人工肝支持系统静脉压、跨膜压、入浆壶压变化 经Welch法校正后的入浆壶压及静脉压、跨膜压均满足方差齐性。经方差分析发现不同时间点之间差异有统计学意义(F=2.415、2.357、6.163,均P<0.05),将实验1~8 h的值与实验开始时的值进行比较后发现,静脉压、跨膜压、入浆壶压在实验5 h较实验开始时明显增高(P<0.05),而其余各时间点与实验开始时比较,差异无统计学意义(P>0.05),见表2;除了实验5 h的均数点落在控制线以外,其余各点均在控制线内。
表2 生物人工肝机器的压力值变化(±s,mm Hg)
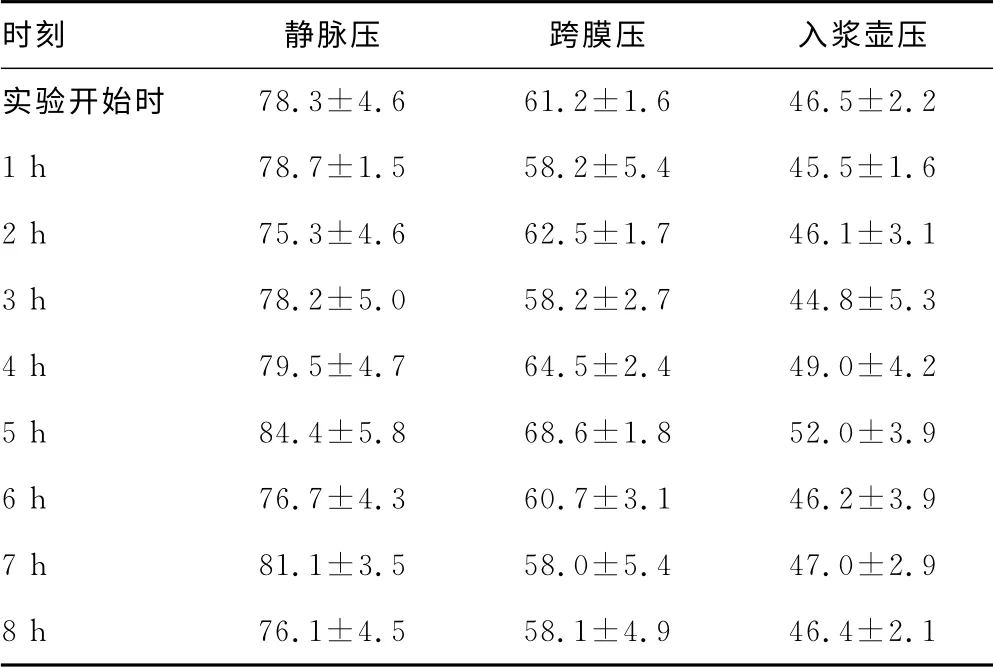
表2 生物人工肝机器的压力值变化(±s,mm Hg)
时刻 静脉压 跨膜压 入浆壶压实验开始时78.3±4.6 61.2±1.6 46.5±2.2 1 h 78.7±1.5 58.2±5.4 45.5±1.6 2 h 75.3±4.6 62.5±1.7 46.1±3.1 3 h 78.2±5.0 58.2±2.7 44.8±5.3 4 h 79.5±4.7 64.5±2.4 49.0±4.2 5 h 84.4±5.8 68.6±1.8 52.0±3.9 6 h 76.7±4.3 60.7±3.1 46.2±3.9 7 h 81.1±3.5 58.0±5.4 47.0±2.9 8 h 76.1±4.5 58.1±4.9 46.4±2.1

图1 混合模式治疗实物图
3 讨 论
生物人工肝动物实验的安全性问题主要涉及细胞、生物反应器、人工肝机器、动物安全性的评估等方面。目前,国内外细胞安全性问题主要是对猪逆转录病毒感染致癌性[2-4]、基因毒性[5-6]、免疫排斥[7]等的研究。生物反应器的研究主要围绕为肝细胞提供良好的长期生长代谢环境、物质转运交换,提高肝细胞活性和功能、反应器体积、细胞数量等方面的研究[8-10]。然而,关于生物人工肝机器和动物安全的详细报道甚少。
大动物实验麻醉成功是实验得以顺利进行的前提,氯胺酮复合丙泊酚麻醉兼备镇静和镇痛效果,有利于保障呼吸和循环稳定[11-12]。整个实验过程中,没有行气管插管,最终能顺利完成实验并且能够保证动物安全。
本研究在实验开始时及实验4、8 h抽取动物体内静脉端的血,所测得的内毒素结果均小于0.5 EU/mL,符合2004年美国真菌学研究变态反应学家协会的透析用水及透析液标准[13]。同时,血培养结果显示培养15 d未见细菌生长,说明在整个体外循环过程中,动物血未受到污染,整个管路、滤器密闭性良好。
实验中始终要把动物的生命安全放在首位,实验过程中心电图正常,各时间点平均动脉压、呼吸频率比较差异无统计学意义(P>0.05),实验2 h心率与实验开始时相比差异有统计学意义(P<0.01)。心率的均数除了实验2 h存在散点外,其余各点均在控制线内,分析原因可能与丙泊酚的麻醉深度引起的心率下降有关。由于猪的无创血压无法监测,本文采取经股动脉置管接压力换能器测定有创血压,显示屏可以直接连续动态显示收缩压、舒张压、平均动脉压,动脉血压能够反映心脏后负荷、心肌耗氧和做功及周围组织与器官血流灌注,是判断循环功能的有效指标,与心率一起可以初步判定治疗过程中有无内出血、血容量不足的发生。平均动脉压、血氧饱和度、呼吸频率的均数无散点落在控制线外,而且波动不呈规律性变化,提示系统处于稳定状态。
在进行血液循环的过程中,人工肝机器的监测系统也很重要的,特别是静脉压、跨膜压、入浆壶压的变化有很大的意义;本实验中,以上指标除了实验5 h与实验开始时比较差异有统计学意义(P<0.05),其余各时间与实验开始时比较差异无统计学意义(P>0.05)。而且,除实验5 h的均数点落在控制线外(上限外),其余各点均在控制线内,而且波动不呈规律性变化,提示系统基本处于稳定状态。结合实验5 h的血氧饱和度下降、心率加快、平均动脉压下降的情况分析实验5 h出现压力值升高的原因是血浆分离器以及管路部分堵塞引起的血红细胞数量减少。堵塞的原因可能与血流量较小、血流缓慢、肝素抗凝不足等有关。实验中每隔2 h用250 mL生理盐水冲洗管路和滤器,加大肝素用量后恢复到稳定状态。另外,实验过程中发现血泵、分浆泵、倒向泵的速率设置对各个压力的影响很大。由于血浆分离率最高为30%,分浆过快,血浆分离器达不到分浆速度,会导致负压破膜,跨膜压变为负值;若分浆速度设置过慢,有可能导致滞留在血浆分离器的血过多,导致静脉压、跨膜压、入浆壶压变大,当跨膜压、静脉压增加到一定程度时,也会发生破膜。本实验所设置的血泵流量为50~60 mL/min,分浆泵流量为15 mL/min,倒向泵LDP1、LDP2流量为18 mL/min,各个压力值平稳,跨膜压稳定在40~60 mm Hg,保证了有效的分浆率。
因此,在新型生物人工肝系统治疗过程中,生命体征处于稳定状态,血流动力学相对稳定,呼吸以及循环功能未受到不良影响,人工肝机器的各个压力监测值趋于稳定,动物的生命安全得以保证,在此基础上,可以进一步评价猪的肝衰竭模型的有效性。
[1]何念海,王英杰,刘俊,等.物理型人工肝对重型肝炎肝功能支持24例效果评价[J].重庆医学,2004,33(4):586-587.
[2]Liu Q,Liu Z,Dalakas E.Prevalence of porcine endogenous retrovirus in Chinese pig breeds and in patients treated with a porcine liver cell-based bioreactor[J].World JGastroenterol,2005,11(30):4727-4730.
[3]Frühauf JH,Mertsching H,Giri S,et al.Porcine endogenous retrovirus released by a bioartificial liver infects primary human cells[J].Liver Int,2009,29(10):1553-1561.
[4]Yang Q,Liu F,Pan XP,et al.Fluidized-bed bioartificialliver assist devices(BLADs)based on microencapsulatedprimary porcine hepatocytes have risk of porcine endogenous retroviruses transmission[J].Hepatol Int,2010,4(4):757-761.
[5]Knasmüller S,Mersch-Sundermann V,Kevekordes S,etal.Use of human-derived liver cell lines for the detectionof environmental and dietary genotoxicants;current stateof knowledge[J].Toxicology,2004,198(1/3):315-328.
[6]Kobayashi N,Fujiwara T,Westerman KA,et al.Prevention of acute liver failure in rats with reversibly immortalized human hepatocytes[J].Science,2000,287(5456):1258-1262.
[7]Iwamuro M,Shiraha H,Nakaji S,et al.A preliminary studyfor constructing a bioartificial liver device with inducedpluripotent stem cell-derived hepatocytes[J].Biomed EngOnline,2012,11(1):93.
[8]Park JK,Lee DH.Bioartificial liver systems:current status and future perspective[J].J Biosci Bioeng,2005,99(4):311-319.
[9]霍小林,吴昌哲,曹越,等.人工肝生物反应器优化设计的仿真研究进展[J].临床肝胆病杂志,2010,26(6):577-580.
[10]Wang Y,Susando T,Lei X,et al.Current development ofbioreactors for extracorporeal bioartificial liver(Review)[J].Biointerphases,2010,5(3):FA116-FA131.
[11]Miner JR,Gray RO,Bahr J,et al.Randomized clinical trialof propofol versus ketamine for procedural sedation in theemergency department[J].Acad Emerg Med,2010,17(6):604-611.
[12]Loh G,Dalen D.Low-dose ketamine in addition to propofolfor procedural sedation and analgesia in the emergency department[J].Ann Pharmacother,2007,41(3):485-492.
[13]Amato RL.Water treatment for hemodialysis--updated toinclude the latest AAMI standards for dialysate(RD52:2004)continuing[J].Nephrol Nurs J,2005,32(2):151-167.
