小儿肺炎支原体感染肺外消化系统损害及其相关因素分析
2014-03-04陈咏丽严晓娟
陈咏丽,严晓娟
(1.华中科技大学同济医学院附属普爱医院儿科,武汉430033;2.湖北省襄阳市中心医院呼吸内科 441021)
肺炎是危害我国儿童身体健康的多发病、常见病之一,其中常见病原菌——肺炎支原体在小儿呼吸道感染中占重要比例。肺炎支原体除引起呼吸道疾病外,还可导致多种肺外系统受损,如消化系统、神经系统、皮肤黏膜、血液系统、肌肉关节等,几乎可以累及全身任何器官和组织[1]。Chen等[2]报道肺外损害可发生于肺部症状出现之前、之时或之后,甚至可以是肺炎支原体感染的惟一表现,并且约1/3以上(25%~45%)的肺炎支原体感染病例同时伴有不同类型、不同程度的肺外并发症。包盈颖[3]的研究资料显示52.9%的肺炎支原体感染患儿伴有肺外并发症,其中消化系统脏器受累最高(30.8%),心血管系统(28.0%)、血液系统(22.0%)次之。而有关小儿肺炎支原体感染肺外消化系统损害的相关报道较少。本文旨在回顾分析小儿肺炎支原体感染合并消化系统损害的临床资料,并从中寻求规律性。现将结果报道如下。
1 资料与方法
1.1 一般资料 肺炎支原体感染患儿均符合《诸福棠实用儿科学》所述肺炎支原体的诊断[4]。肺炎支原体感染合并消化系统损害目前尚无统一诊断标准,本研究参照张国华等[5]的研究方法,以血支原体抗体(肺炎支原体-Ig M)阳性合并下述表现者:(1)具有消化系统症状两项及两项以上者:恶心、呕吐、腹痛、腹泻等;(2)消化系统实验室检查有1项或多项异常者:腹部B超、腹部X线片、血清转氨酶、血总胆红素、血尿淀粉酶等。华中科技大学同济医学院附属普爱医院儿科2010年6月至2012年5月共收治肺炎支原体患儿583例,其中276例有肺外损害表现。具有肺外损害表现的患儿中男145例,女131例;发病年龄6个月至3岁75例(婴幼儿组),4~14岁201例(儿童组)
1.2 方法 所有患儿均取静脉血1 mL,采用ELISA检测(试剂来自上海蓝基生物科技有限公司)全部患儿的肺炎支原体-Ig M。记录患儿的临床表现,包括发热、咳嗽、喘息、恶心、呕吐、腹泻、肝大、胸闷、皮疹、嗜睡、惊厥、血尿、蛋白尿、出血点等。测查97例肺炎支原体感染合并消化系统损害患儿的血常规、血清转氨酶、血总胆红素、血尿淀粉酶、腹部B超、腹部X线片等。病程1~14 d。
1.3 治疗及转归 所有患儿在确诊肺炎支原体感染后,立即给予静脉滴注阿奇霉素10 mg·kg-1·d-1,应用3~5 d后,改阿奇霉素口服序贯治疗,服3 d,停4 d,疗程2~3周。记录阿奇霉素治疗的初始时间(开始时的病程时间)、药物治疗的剂量、病情恢复程度及速度。除此之外,根据肺外系统脏器受损情况,分别给予相应疗程的药物治疗。经治疗后全部病例均治愈,无1例留有后遗症。
1.4 统计学处理 采用SPSS13.0统计软件进行分析,计量资料以±s表示,采用t检验;计数资料以率表示,采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 临床表现 276例肺外系统损害患者主要体现为8类症状,分别为消化系统、心血管系统、血液系统、皮肤及关节、神经系统、泌尿系统、胸腔积液及多系统损害。而以肺外表现为首发的有22例,其中以消化系统受累为首发表现的有17例。276例中有发热现象者215例(77.90%),体温为38~41℃,237例出现呼吸系统相关症状(85.87%)。肺外表现以肺炎支原体感染合并消化系统损害所占比例最高,为97例(35.14%),其次为肺炎支原体感染合并心血管系统损害(28.26%)和肺炎支原体感染合并血液系统损害(23.55%)。此外,同时有2个及以上系统或器官损害的多系统损害患儿比例为57.25%。见表1。
2.2 性别、年龄、季节对肺炎支原体感染合并肺外系统损害的影响 男女之间的肺外损害检出率差异无统计学意义(P>0.05)。不同年龄段小儿肺炎支原体感染合并肺外损害的检出率区别较大,小于或等于6岁组与大于6岁组之间肺炎支原体感染合并肺外损害的检出率比较差异有统计学意义(P<0.05),其他年龄组之间检出率比较差异无统计学意义(P>0.05)。2010及2011年的7~9月份肺炎支原体感染合并肺外损害的检出率与同年其他季节比较差异有统计学意义(P<0.05);其余各季节之间肺炎支原体检出率比较差异无统计学意义(P>0.05)。
2.3 阿奇霉素抗感染起始时间及病程 肺炎支原体感染合并肺外系统损害组(A组)使用大环内酯类抗菌药物阿奇霉素的初始时间平均为病程第(6.02±1.77)d,肺炎支原体感染非并肺外系统损害组(B组)为第(4.99±1.92)d,A组起始时间晚于B组,两组比较差异有统计学意义(P<0.05)。A、B两组的病程比较差异无统计学意义(P>0.05)。见表2。
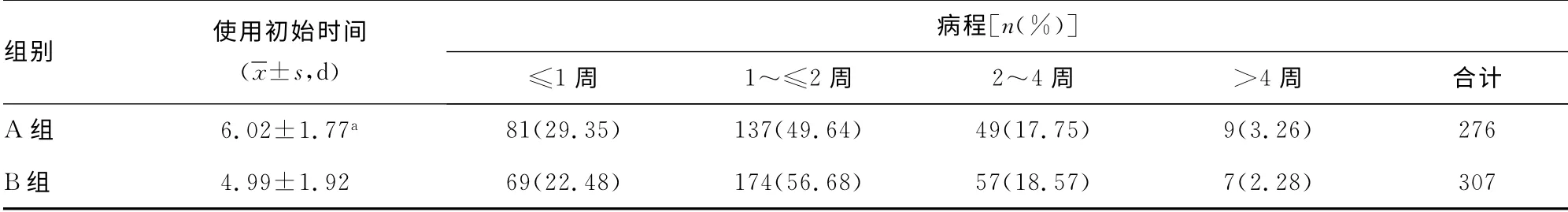
表2 A、B组阿奇霉素使用起始时间及病程比较
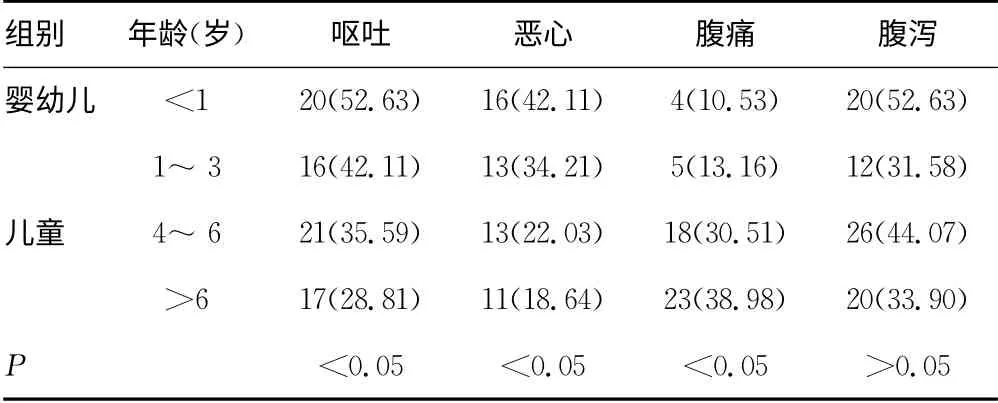
表3 不同年龄阶段肺炎支原体感染合并肺外消化 系统损伤症状的比较[n(%)]
2.4 不同年龄肺炎支原体感染合并肺外消化系统损害症状的差异 97例肺炎支原体感染合并肺外消化系统损害患儿中,婴幼儿组38例,儿童组59例。婴幼儿组较儿童组呕吐、恶心症状表现明显,差异有统计学意义(P<0.05);儿童组较婴幼儿组腹痛症状表现明显,差异有统计学意义(P<0.05);而婴幼儿组与儿童组的腹泻症状表现差异无统计学意义(P>0.05),见表3。
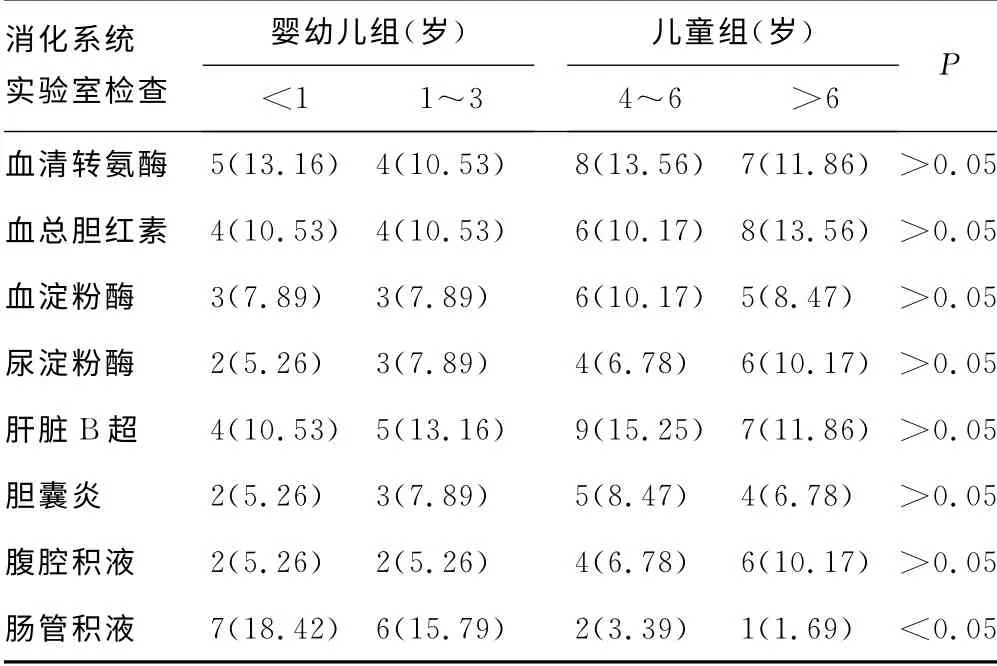
表4 肺炎支原体感染不同年龄患儿消化系统实验室 检查阳性结果[n(%)]
2.5 不同年龄肺炎支原体感染合并肺外消化系统损害实验室检测指标的差异 腹部X线片检测肠道积气表现时发现,婴幼儿组较儿童组高,差异有统计学意义(P<0.05)。儿童组的实验室测定指标血清转氨酶增高、血总胆红素增高、血淀粉酶增高、尿淀粉酶增高、肝脏B超异常、胆囊炎、腹腔积液等表现的比例高于婴幼儿组,但差异无统计学意义(P>0.05)。见表4。
3 讨 论
肺炎支原体是介于病毒和细菌间、能自行繁殖的最小原核生物,是引起儿童呼吸道感染及非典型肺炎的病原之一。近年来随着检测技术的提高,有关肺炎支原体感染的报道也日见增多,结果显示其发病趋势有所提高,且发病年龄有下移趋势。临床对肺炎支原体感染的治疗日趋规范,但对肺外损害表现的重视却远远不够,因此容易误诊、漏诊。虽然近年来有关肺炎支原体感染致肺外器官损害的报道显示肺炎支原体可引起神经、血液、心血管、消化以及皮肤、肌肉、关节等器官的疾病,但其影响机制目前并不十分清楚,推测可能原因为:(1)病原体直接入侵引起支原体血症,经过此环节后肺炎支原体直接侵犯各组织、系统,在肺外脏器生存、繁殖从而引起肺外器官发生病变;(2)肺炎支原体感染通过引起自身免疫和免疫抑制参与肺炎支原体肺炎及肺外并发症的发病过程,通过刺激淋巴细胞产生相应组织的抗自身抗体,从而损害组织和脏器;(3)沉积在毛细血管基底膜的循环免疫复合物,通过激活补体免疫反应损害不同器官[6]。
已有研究结果表明肺外损害脏器的种类、比例及损害程度受对象、年龄、性别、地域、季节以及检测方法等的影响[7-8]。黄瑶等[9]对梧州市916例下呼吸道感染肺炎支原体的儿童样本进行研究,结果显示男女性别之间肺炎支原体检出率差异无统计学意义(P>0.05),而不同年龄及季节比较差异有统计学意义(P<0.05),其中,患儿年龄以6岁为分界线,夏季的发病率较其他季节高。卢玉容等[10]对102例肺炎支原体感染患儿进行临床分析时发现肺炎支原体感染以学龄前儿童较多见,而春冬季感染率显著高于夏秋季。黄伟萍[11]对116例小儿肺炎支原体感染肺外损害进行临床分析发现,肺外损害以消化系统为主,其次为血液系统及神经系统等。而袁增权等[12]的临床分析结果则显示肺外损害以消化系统为主,其次为心血管系统及泌尿系统。本研究旨在回顾性分析年龄、性别比例、季节等因素对本地区肺炎支原体感染患儿以及肺外损害形式的影响。
有研究显示,肺炎支原体感染患儿伴有的肺外并发症中以消化系统脏器受累最高,且患者的年龄越小,肺炎支原体感染的临床表现越不典型,同时由于消化系统损害大多为非特异性表现,常发生于疾病早期,容易造成漏诊、误诊[3,13]。本组中就有17例患儿以消化系统受累为首发表现,因此研究影响小儿肺炎支原体感染合并肺外消化系统损害的相关因素具有一定的理论和实践意义。
本研究显示,肺炎支原体感染患儿中47.34%(276/583)存在不同系统、不同程度的肺外损害并发症,比国内相关报道略高,但以消化系统和心血管系统最多见,其次为血液系统、皮肤及关节症状、神经系统及泌尿系统,预后大多良好。消化系统临床症状主要表现为呕吐、恶心、腹痛、腹泻、肝脾肿大、肝功能异常等,经治疗后症状体征及肝功能均恢复正常。值得注意的是多系统损害的患儿比例高达57.25%,且损害的器官(系统)越多,病情越重,尤其是合并神经系统和(或)心血管系统的患儿病情尤为严重,这一现象需引起临床医师的高度重视。
本研究结果提示,男女性别之间的肺外损害检出率差异无统计学意义(P>0.05),而季节、年龄之间的肺外损害检出率差异有统计学意义(P<0.05)。本地区肺炎支原体感染全年均可发生,但以秋季更多见;小儿发病年龄分析结果显示,小于或等于6岁为肺外损害高发期,其中消化系统损害检出率最高,其次为心血管系统以及血液系统。消化系统损伤症状主要为呕吐、恶心、腹痛及腹泻;婴幼儿组较儿童组呕吐、恶心症状表现明显,差异有统计学意义(P<0.05);儿童组较婴幼儿组腹痛症状表现明显,差异有统计学意义(P<0.05);而腹泻症状表现在两组间差异无统计学意义(P>0.05);儿童组血清转氨酶增高、血总胆红素增高、血淀粉酶增高、尿淀粉酶增高、肝脏B超异常、胆囊炎、腹腔积液等表现均较婴幼儿组略高,但两组差异无统计学意义(P>0.05);肺炎支原体感染合并肺外消化系统损伤婴幼儿较儿童临床症状表现明显。
小儿肺炎的肺外表现使病情复杂化,特别是以肺外表现为首发症状时极易造成误诊、误治,因此在观察到有肺部感染症状且合并其他系统损害的患者,应考虑肺炎支原体感染的可能性,尤其是在应用青霉素类、头孢菌素类药物治疗无效或者疗效不佳时,应及早进行肺炎支原体相关检测,以尽早确诊和及时治疗。
本研究显示,小儿肺炎支原体感染合并肺外消化系统损害的发生率最高,这一结果与国内一些报道类似[7-11],因此消化系统损害的表现症状及实验室指标检测应受到国内临床医师和研究者的关注。但国外报道的类似结果较少,原因可能是国内的研究(含本组)记录的消化系统症状多为非特异性的胃肠道反应,如恶心、呕吐、腹泻等,具有一定的自限性,有时比较难与呼吸道感染(如肺炎等)伴随的消化道反应区别;而国外报道则把这类症状归于真正的“消化系统损害”,因此不进行相关的统计学分析;国外资料中提及的“消化系统损害”主要为淤胆型肝炎和胰腺炎[14]。虽然消化系统为肺炎支原体感染肺外损害最常见受累的器官,但以轻度、自限性、非特异性的表现为主,预后较好。
临床上,肺炎支原体感染致消化系统受损患者应及早给予阿奇霉素治疗,早期应用阿奇霉素可减少肺炎支原体肺外并发症的发生。但阿奇霉素引起的恶心、呕吐、腹痛、腹泻等不良反应又易与肺炎支原体感染时的消化系统症状相混淆,因此需谨慎用药、针对治疗。
[1]Kashyap S,Sarkar M.Mycoplasma pneumonia:Clinicalfeatures and management[J].Lung India,2010,27(2):75-85.
[2]Chen CJ,Juan CJ,Hsu ML,et al.Mycoplasma pneumoniae infection presenting as neutropenia,thrombocytopenia,and acute hepatitis in a child[J].J Microbiol Immunol Infect,2004,37(2):128-130.
[2]Chen CJ,Juan CJ,Hsu ML,et al.Mycoplas ma pneu moniae infection presenting as neutropenia,thrombocytopenia,and acute hepatitis in a child[J].J Microbiol Immunol Infect,2004,37(2):128-130.
[3]包盈颖.小儿肺炎支原体感染肺外损害及其相关因素分析[D].杭州:浙江大学,2007.
[4]胡亚美,江载芳,诸福棠.实用儿科学[M].7版.北京:人民卫生出版社,2002:1205.
[5]张国华,罗素云,王琴,等.不同年龄小儿肺炎支原体感染合并消化系统损害临床特点分析[J].中国现代医生,2010,48(28):153-154.
[6]何海兰,郑静,闫军.小儿肺炎支原体感染肺外表现临床分析[J].临床和实验医学杂志,2012,11(9):657-658.
[7]Atkinson TP,Balish MF,Waites KB,et al.Epidemiology,clinical manifestations,pathogenesis and laboratory detection of Mycoplasma pneumoniae infections[J].FEMSMicrobiol Rev,2008,32(6):956-973.
[8]Sánchez-Vargas FM,Gómez-Duarte OG.Mycoplasma pneumoniae-an emerging extra-pulmonary pathogen[J].ClinMicrobiol Infect,2008,14(2):105-117.
[9]黄瑶,郭柳薇,叶满.梧州市916例下呼吸道感染儿童肺炎支原体感染临床分析[J].重庆医学,2009,38(20):2615-2616.
[10]卢玉容,何世娟,蔡苗,等.肺炎支原体感染患儿102例临床分析[J].重庆医学,2011,40(19):1921-1922,1926.
[11]黄伟萍.小儿肺炎支原体感染肺外损害116例临床分析[J].中国社区医师:医学专业,2011,13(20):141.
[12]袁增权,蒋炜,饶鸣皋.小儿肺炎支原体感染肺外脏器损害22例分析[J].皖南医学院学报,2008,27(5):360-361.
[13]袁壮.儿科急重症与疑难病症诊治评述[M].北京:人民卫生出版社,2002:115.
[14]Grüllich C,Baumert TF,Blum HE.Acute mycoplasmapneumoniae infection presenting as cholestatic hepatitis[J].J Clin Microbiol,2003,41(1):514-515.
