铜绿假单胞菌对致病真菌的抑制作用*
2014-03-04徐令清侯红艳刘彩林欧国平孙明月孙自镛
徐令清,汪 峰,侯红艳,刘彩林,欧国平,孙明月,孙自镛
(华中科技大学同济医学院附属同济医院检验科,武汉430030)
铜绿假单胞菌(PA)是一种无处不在的细菌,井水、河水、生牛奶、冻鱼、未经处理的污水、人畜的粪便及医院环境中都能分离到PA,能够引起菌血症、创伤后伤口感染、肺炎、脑膜炎、附睾炎、眼部感染、乳突炎等。但有报道称,在感染PA的囊性纤维变性患者中,极少有真菌感染的发生,提示PA可能具有抗真菌的活性。
1 材料与方法
1.1 材料 2012年5月至2012年9月从本院住院部及门诊患者送检标本中共分离出不重复的PA 24株,经革兰染色、氧化酶实验、Vitek-2全自动微生物鉴定仪(法国梅里埃公司)或API 20NE(法国梅里埃公司)对菌株进行鉴定。大肠埃希菌(EC)ATCC23922、肺炎克雷伯菌(KP)ATCC700603及 PA ATCC25923为质控菌株。真菌质控菌株为白色念珠菌(CA)ATCC90028、热带念珠菌(CT)、光滑念珠菌(CG)、近平滑念珠菌(CP)、克柔念珠菌(CK)、葡萄牙念珠菌(MSB)各5株,均分离自临床标本。由科玛嘉平板及API-20CAUX酵母样真菌鉴定试条(法国梅里埃公司)对临床分离的真菌进行鉴定。
1.2 方法
1.2.1 纸片法 在沙堡罗培养基上涂布2个麦氏浊度的真菌菌液,然后贴上无菌滤纸片(直径6mm),将PA制成0.5个麦氏浊度的菌悬液,吸取3μL均匀涂在滤纸片上,孵育48h后,观察结果。
1.2.2 十字交叉划线法 24株临床PA菌株与3种质控菌株分别培养24h后用0.9%生理盐水制成菌悬液,取30μL菌悬液至沙堡罗培养基上,用无菌棉签沿任意直径划宽为1cm的划痕,然后放至37℃培养基培养24h。用无菌刀片移除沙堡罗培养基上的菌苔,取5cm的无菌滤纸浸满三氯甲烷后放入一金属小盒子中,将移除菌苔的沙堡罗培养基生长面朝向滤纸放好,三氯甲烷的蒸汽会杀灭残余的细菌,30min后将平板暴露于生物安全柜中抽吸几分钟,让三氯甲烷挥发掉。将上述真菌在沙堡罗培养基上培养48h后,制成1×106/mL菌悬液,棉签醮取并沿着三氯甲烷处理过的菌痕作垂直相交划线。将平板30℃孵育24h后,观察结果。
24株PA中每一株都与6种念珠菌中的每一株进行测试。平板按照以下规则判读,完全抑制真菌生长记作:+;部分抑制真菌生长记作:±;不能抑制真菌生长记作:-。
1.2.3 LB液体培养基中共孵育实验 无菌EP管中装入1 mL LB液体培养基,分别将上述纸片法中的每一株PA和每一株真菌菌悬液各50μL加入EP管中,100r/min离心,30℃摇菌24h,取混悬液置显微镜下观察。另取50μL真菌菌悬液放入1mL LB液体培养基中作对照。
1.2.4 十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析菌体蛋白差异 将完全有抑制作用的6号与15号PA菌株及完全无抑制作用的1号与22号PA菌株作SDS-PAGE蛋白分析。在LB液体培养基中150r/min离心,35℃摇菌24 h,取沉淀及上清液分别煮沸10min后直接进行SDS-PAGE电泳,脱色后观察结果。
2 结 果
2.1 纸片法结果 在24株PA与30株真菌的纸片法试验中,24株PA菌株中6、15、16、17、18、19、20号菌株对6种真菌的30株菌株均出现了明显的抑菌环,抑菌环直径非常接近,3、9、23号菌株有抑菌环但不明显,其余菌株及质控菌株均无抑菌环出现,见图1。
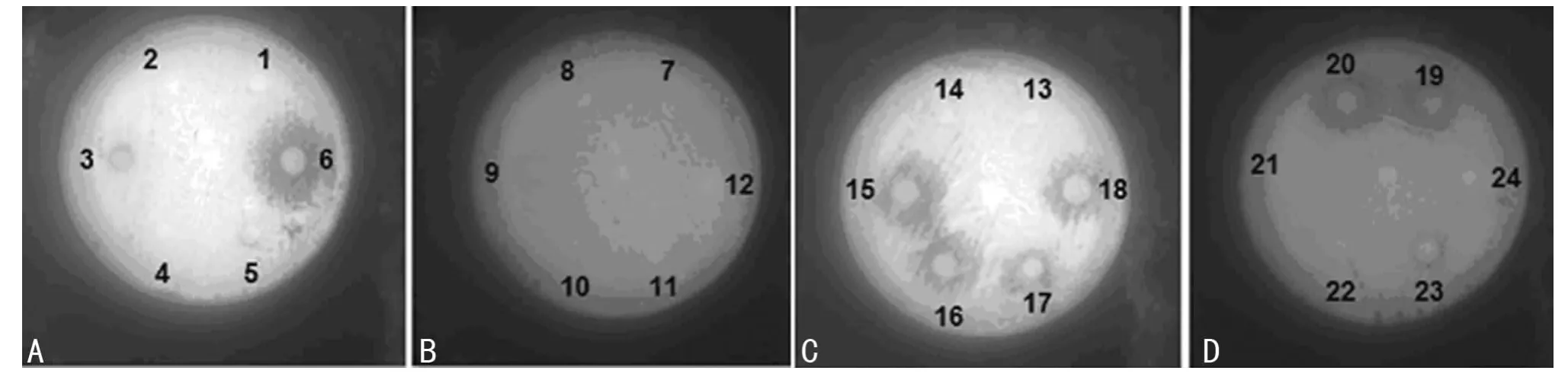
图1 纸片法实验
2.2 十字交叉划线实验结果 部分 PA(6、15、16、17、18、19、20号菌株)出现明显的抑制现象,部分PA菌株(3、9、23号菌株)有轻微抑制作用,其余菌株及质控菌株均未出现抑制现象,这与纸片法结果一致,见图2。24株PA对各种真菌的抑制活性情况见表1。
2.3 LB液体培养基中共孵育试验结果 有抑制作用的PA菌株(6、15号菌株)与真菌共培养时,发现真菌菌丝显著减少,而无抑制作用的PA菌株(1、22号菌株)共培养后菌丝数量与真菌单独培养相近,见图3。
2.4 SDS-PAGE分析菌株蛋白差异 几株PA的共同点是在35×103处均有一明显条带,但其他条带存在明显差异:无抑制作用的1、22号PA菌株只在35×103处有一明显条带,有明显抑制效果的6、15号PA菌株在38、35、27、24×103处均有较清晰的条带,即6、15号PA菌株要比1、22号PA菌株多出好几个条带,见图4。
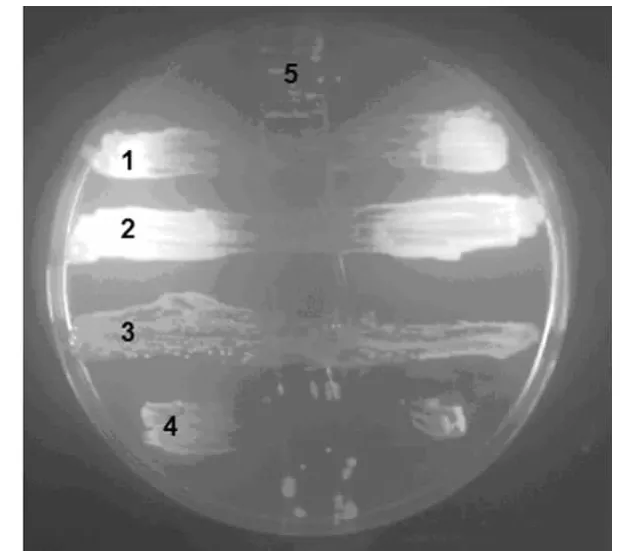
图2 十字交叉划线实验
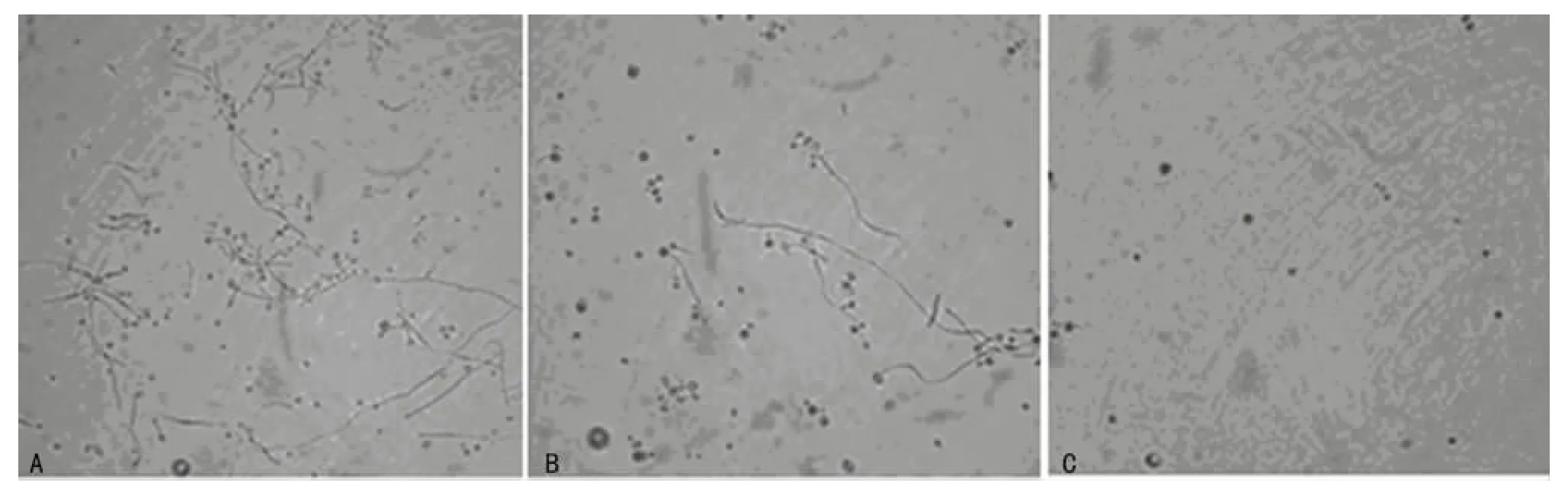
图3 LB液体培养基中共孵育实验(普通光学显微镜×400)
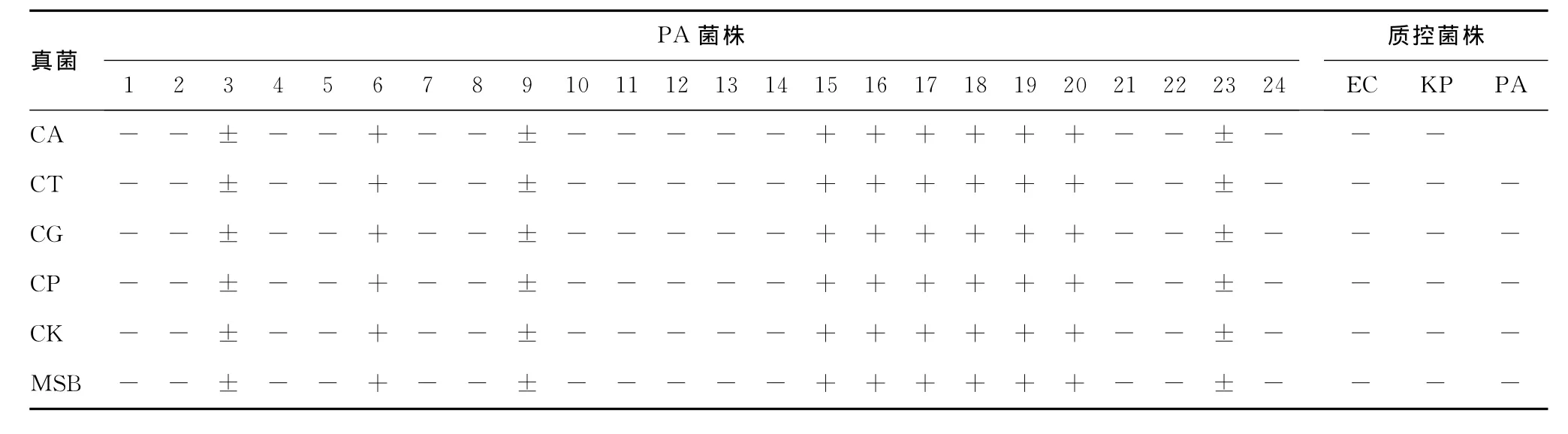
表1 PA菌株抗真菌活性
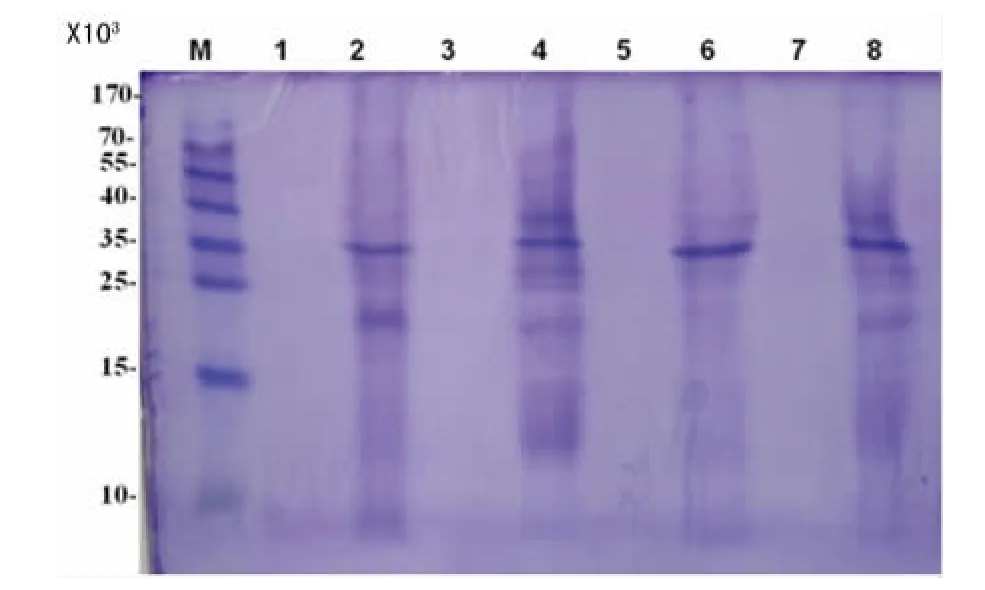
图4 SDS-PAGE电泳图
3 讨 论
PA是广泛存在于水、土壤、动物体内的一种条件致病菌,以往研究只关注PA作为致病菌在临床上能引起一些感染性疾病,但在环境与个体中PA常会与周围的其他微生物相互作用,抑制甚至杀死其他微生物。
已有资料表明,PA的二代产物,如植物毒素、黏液、抗真菌化合物的产生,对自然环境中的其他微生物有明显的选择作用。Hogan等[1]报道称,PA能在CA菌丝上形成厚厚的生物被膜从而杀死CA,表明PA影响的是CA的菌丝形成,而不是孢子形成,因为他们的细胞壁存在差异;另外一些PA的毒力因子(如四型菌毛、磷脂酶C、吩嗪等)同样也与杀死CA的菌丝有关。Kaleli等[2]报道PA对CA、CP、CK及CT的抑制率在使用血平板和沙堡罗培养基时差异无统计学意义。
另有一些研究表明,PA和CA在人体内相互作用。在囊胞性纤维症中有超过80%的患者会伴有PA感染,而广谱抗菌药物和类固醇激素的使用也会导致烟曲霉和CA的感染。Hughes等[3]发现在感染PA的囊胞性纤维症患者中只有10%CA皮肤试验阳性,而未感染PA的囊胞性纤维症患者中则有30%的阳性率,表明PA产生了一些抗真菌的物质防止念珠菌感染。另外也有报道称,PA可以抑制隐球菌的生长[4-5]。而到目前为止,还没有在囊泡性纤维症患者体内分离出隐球菌的报道,隐球菌与PA都是常见的肺部致病菌,如果这二者不能同时定植,那么有可能是PA抑制了隐球菌生长,绿脓菌素和喹诺酮系统可能是预防囊泡性纤维症患者肺部感染隐球菌的主要原因。
PA能产生多种细胞间因子如群体感应系统丝氨酸内酯、鼠李糖脂、氧化还原吩嗪、胰蛋白酶E、磷脂酶C、胞外多糖、胞藻酸盐等。Hogan等[6]发现PA能产生一种丝氨酸内酯,是一种细胞间信号分子,能充分抑制CA菌丝形成。
Grillot等[7]通过PA与酵母菌纯培养及混合培养来调查PA与酵母菌间的相互作用,报道显示所有被测试酵母菌在血平板和在与细菌的过滤液中共同培养时均受到抑制。Gupta等[8]报道有59%的念珠菌在烧伤时与细菌混合感染。然而,在有PA存在时,真菌的定植明显受到抑制。这也表明PA能杀死或抑制致病性真菌的生长。Kerr等[9]报道PA临床菌株的主要抗真菌活性是通过产生氧化还原色素、绿脓菌素等来抑制CA和烟曲霉的。绿脓菌素能降低人类上皮细胞中的环磷酸腺苷和三磷酸腺苷[10-14]。
本次研究发现,部分PA对真菌有显著的抑制效果,部分PA有一定抑制作用,而另外一些则对真菌完全没有抑制作用。如6号PA菌株出现了非常明显的抑菌环(图1),通过十字交叉划线及共培养进一步发现,6号及15号PA菌株的抑制作用非常强,通过SDS-PAGE发现这两株菌与1号及22号PA菌株的蛋白条带比较差异明显,比后者多出2~3个条带(图4),多出的条带是否与其抑制真菌的活性存在相关性,有待进一步研究。
综上所述,PA在体内和体外都具有强大的抗真菌活性,原因可能是他能产生绿脓菌素形成生物被膜,及产生多种细胞间因子如群体感应系统丝氨酸内酯、鼠李糖脂、氧化还原吩嗪、胰蛋白酶E、磷脂酶C等及分泌各种蛋白类物质抑制真菌菌丝从而抑制真菌生长。作者将进一步分离和纯化这些物质,作进一步研究。
[1]Hogan DA,Kolter R.Pseudomonas-Candida interactions:an ecological role for virulence factors[J].Science,2002,296(5576):2229-2232.
[2]Kaleli I,Cevahir N,Demir M,et al.Anticandidal activity of Pseudomonas aeruginosa strains isolated from clinical specimens[J].Mycoses,2007,50(1):74-78.
[3]Hughes WT,Kim HK.Mycoflora in cystic fibrosis:some ecologic aspects of Pseudomonas aeruginosa and Candida albicans[J].Mycopathol Mycol Appl,1973,50(3):261-269.
[4]Caldwell CC,Chen Y,Goetzmann HS,et al.Pseudomonas aeruginosa exotoxin pyocyanin causes cystic fibrosis airway pathogenesis[J].Am J Pathol,2009,175(6):2473-2488.
[5]Rella A,Yang MW,Gruber J,et al.Pseudomonas aeruginosa inhibits the growth of cryptococcus species[J].Mycopathologia,2012,173(5/6):451-461.
[6]Hogan DA,Vik A,Kolter R.A pseudomonas aeruginosa quorum-sensing molecule influences candida albicans morphology[J].Mol Microbiol,2004,54(5):1212-1223.
[7]Grillot R,Portmann-Coffin V,Ambroise-Thomas P.Growth inhibition of pathogenic yeasts by Pseudomonas aeruginosa in vitro:clinical implications in blood cultures[J].Mycoses,1994,37(9/10):343-347.
[8]Gupta N,Haque A,Mukhopadhyay G,et al.Interactions between bacteria and Candida in the burn wound[J].Burns,2005,31(3):375-378.
[9]Kerr JR.Suppression of fungal growth exhibited by Pseudomonas aeruginosa.[J].J Clin Microbiol,1994,32(2):525-527.
[10]de Macedo JL,Santos JB.Bacterial and fungal colonization of burn wounds[J].Mem Inst Oswaldo Cruz,2005,100(5):535-539.
[11]Dubern JF,Diggle SP.Quorum sensing by 2-alkyl-4-quinolones in Pseudomonas aeruginosa and other bacterial species[J].Mol Biosyst,2008,4(9):882-888.
[12]Diggle SP,Winzer K,Chhabra SR.The Pseudomonas aeruginosa quinolone signal molecule overcomes the cell density-dependency of the quorum sensing hierarchy,regulates rhl-dependent genes at the onset of stationary phase and can be produced in the absence of lasr[J].Mol Microbiol,2003,50(1):29-43.
[13]Le Berre R,Faure K,Nguyen S.Quorum sensing:a new clinical target for Pseudomonas aeruginosa?[J].Med Mal Infect,2006,36(7):349-357.
[14]KeçeliÖzcan S,Dündar D,Sönmez Tamer G.Anti-candidal activity of clinical Pseudomonas aeruginosa strains and in vitro inhibition of Candida biofilm formation[J].Mikrobiyol Bul,2012,46(1):39-46.
