ldhA基因敲除对Corynebacterium glutamicumTCCC11822发酵生产L-谷氨酸的影响
2014-03-04张成林李志华梁静波徐庆阳
张成林,李志华,梁静波,徐庆阳*
(1.代谢控制发酵技术国家地方联合工程实验室,天津300457;2.天津市氨基酸高效绿色制造工程实验室,天津300457;3.天津科技大学生物工程学院,天津300457)
ldhA基因敲除对Corynebacterium glutamicumTCCC11822发酵生产L-谷氨酸的影响
张成林1,2,3,李志华1,梁静波1,2,3,徐庆阳1,2,3*
(1.代谢控制发酵技术国家地方联合工程实验室,天津300457;2.天津市氨基酸高效绿色制造工程实验室,天津300457;3.天津科技大学生物工程学院,天津300457)
针对L-谷氨酸发酵过程中乳酸产量偏高的问题,以L-谷氨酸生产菌谷氨酸棒杆菌(Corynebacterium glutamicum)TCCC11822为出发菌株,通过构建敲除质粒pK18mobsacB△ldh并采用同源重组技术敲除其乳酸脱氢酶编码基因ldhA,以期达到减少副产物、提高L-谷氨酸产量和转化率的目的。结果表明,与出发菌株相比ldhA基因敲除株的乳酸合成量降低了85.6%,L-谷氨酸的产量和转化率分别提高7.6%和5.5%,但生物量略有下降。本研究可为L-谷氨酸及其他氨基酸生产菌株的理性改造提供参考。
L-谷氨酸;乳酸;乳酸脱氢酶;基因敲除
L-谷氨酸又名α-氨基戊二酸,是大宗氨基酸品种之一,因其具有增鲜作用而被广泛用于味精、鸡精等调味剂的生产。此外,L-谷氨酸还具有降低血氨、改善神经系统和儿童智力发育以及增强血液循环等功能,并被广泛应用于食品、农业、医药、日化等领域[1-3]。
自1957年采用谷氨酸棒杆菌(Corynebacterium glutamicum)发酵生产L-谷氨酸以来,其产量和生产规模不断扩大,目前世界L-谷氨酸年产量已超过250万t[4]。乳酸是L-谷氨酸发酵过程中常见副产物之一,由丙酮酸经乳酸脱氢酶(lactate dehydrogenase,LDH)催化生成。乳酸的过量合成不仅会影响菌体生长,更能减弱L-谷氨酸合成的代谢流量、增加碳架的浪费,从而减少L-谷氨酸的产量及其转化率并增加生产成本[5-6]。随着基因组测序技术突飞猛进的发展以及谷氨酸棒杆菌基因操作技术的不断完善,多株谷氨酸棒杆菌基因组测序工作已经完成,使得通过分子生物学手段对该菌进行定向改造成为现实[7-8]。
本研究针对发酵过程中乳酸产量偏高的问题,以L-谷氨酸生产菌谷氨酸棒杆菌(C.glutamicum)TCCC11822为出发菌株,采用同源重组技术敲除其乳酸脱氢酶编码基因ldhA,以期达到减少副产物、提高L-谷氨酸产量和转化率的目的。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种和质粒
谷氨酸棒杆菌(C.glutamicum)TCCC 11822、大肠杆菌DH5α以及质粒pK18mobsacB:天津科技大学代谢工程研究室。
1.1.2 主要试剂
T4DNA连接酶、ExTaqDNA聚合酶、EcoRⅠ、HindⅢ:日本TaKaRa公司;聚合酶链反应(polymerase chain reaction,PCR)产物回收试剂盒、质粒小量快速提取试剂盒:北京博迈德科技发展有限公司。
1.1.3 培养基
斜面培养基:葡萄糖1g/L,牛肉膏10g/L,酵母粉5g/L,蛋白胨10g/L,NaCl 5g/L,琼脂粉5g/L,pH 7.0~7.2。
种子培养基:葡萄糖25g/L,玉米浆18mL/L,K2HPO42.2g/L,MgSO4·7H2O 0.9g/L,尿素3g/L,pH 7.0~7.2。
发酵培养基:玉米浆20mL/L,葡萄糖30g/L,豆饼水解液10mL/L,MnSO4·H2O30mg/L,MgSO4·7H2O3g/L,K2HPO40.5g/L,FeSO4·7H2O 10mg/L,VH300μg/L,VBl300μg/L,pH 7.0~7.2。
Luria-Bertani(LB)培养基:胰蛋白胨10g/L,酵母提取物5g/L,NaCl 5g/L,pH 7.0。
牛心浸液(beef heart infusion supplement,BHIS)培养基:牛脑心浸提物37g/L,山梨醇91g/L。
1.2 仪器与设备
752紫外分光光度计:上海精密科学仪器有限公司;SBA-40C生物传感仪:山东省科学院生物研究所;BIOTECH-10BGZ自动控制发酵罐:上海保兴生物设备工程有限公司;Biometra 9700型PCR基因扩增仪:美国Syngene公司;NEPA21电转仪:美国Eppendorf公司。
1.3 方法
1.3.1 △ldh片段的扩增
根据Genbank中报道的谷氨酸棒杆菌ATCC 13032基因组中ldhA上游717bp、下游600bp序列设计引物(见表1),以谷氨酸棒杆菌TCCC11822基因组DNA为模板、分别以L1和L2及L3和L4为引物,扩增出ldhA上、下游片段。反应条件为94℃预变性10min 1个循环;94℃变性30s、60℃退火30s、72℃延伸60s,25个循环;72℃延伸10min,1个循环。
然后再以L1和L4为引物、以上述PCR片段为模板,采用重叠PCR的方法扩增获得△ldh片段。反应条件为94℃预变性10min 1个循环;94℃变性30s、60℃退火30s、72℃延伸90s,25个循环;72℃延伸10min,1个循环。
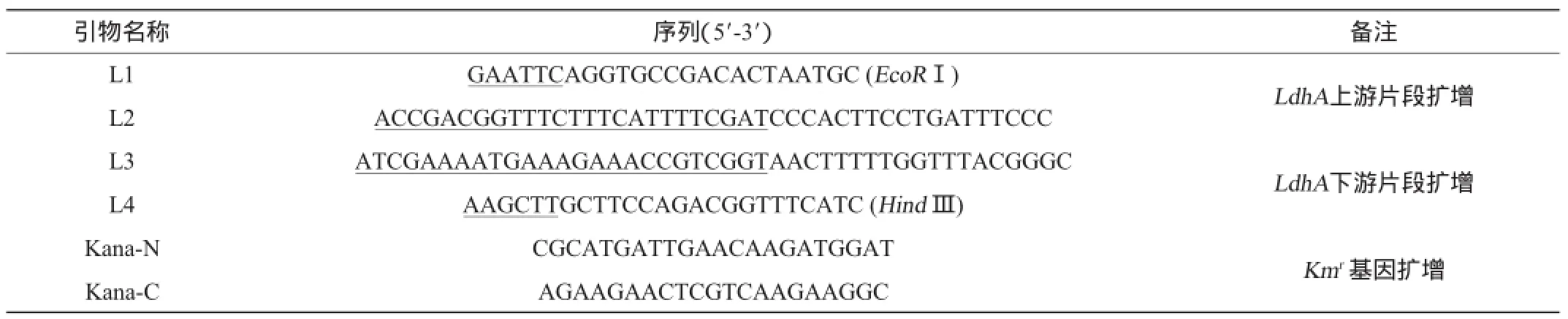
表1 引物及其序列Table 1 Primers and its sequences
1.3.2 整合载体pK18mobsacB△ldh的构建
将回收的重叠PCR产物△ldh经限制性内切酶EcoRI和HindIII酶切后,采用T4 DNA连接酶连接至经相同酶切的穿梭载体pK18mobsacB,然后转化至E.coliDH5α感受态细胞并涂布于含卡那霉素(25μg/mL)的LB固体培养基上。提取阳性单克隆质粒进行酶切验证,将验证正确的重组质粒命名为pK18mobsacB△ldh。
1.3.3 ldhA敲除菌株TCCC11822△ldh的构建
将pK18mobsacB△ldh电转化至谷氨酸棒杆菌TCCC 11822感受态细胞中(电击条件:25μF,12.5kV/cm,200Ω),于BHIS活化后涂布于含卡那霉素(25μg/mL)的BHIS固体培养基[9-11]。挑取阳性单克隆并提取其基因组DNA,采用引物Kana-N和Kana-C进行PCR验证。
将验证为阳性的菌株于含15g/L蔗糖的BHIS液体培养基中培养48h后涂布于BHIS固体培养基,挑取单克隆并点接至含卡那霉素(25μg/mL)的BHIS固体培养基[12]。选取仅能在BHIS固体培养基中生长的单克隆并提取其基因组DNA,采用引物L1和L4进行PCR验证。将验证正确的ldhA敲除菌株命名为TCCC11822△ldh。
1.3.4 菌体生物量的测定
取0.5mL发酵液,加入9.5mL去离子水,以去离子水为空白,采用752型分光光度计测定波长620nm处的吸光度值,菌体生物量以OD620nm值表示。
1.3.5 乳酸、L-谷氨酸及葡萄糖含量的测定
取经10 000g离心5min后的发酵液上清,采用SBA-40C生物传感仪测定乳酸、L-谷氨酸及葡萄糖含量。
1.3.6 比生长速率及转化率的计算公式
比生长速率用每小时单位质量的菌体所增加的菌体量表示,其计算公式如下:

式中:μ表示比生长速率,h-1;X表示菌体生物量(以OD620nm值表示);t表示培养时间,h。
L-谷氨酸转化率的计算公式如下:

2 结果与讨论
2.1 △ldh片段的构建
以谷氨酸棒杆菌TCCC11822基因组为模板,L1、L2、L3和L4为引物进行重叠PCR,将产物经1.5%琼脂糖凝胶电泳后,分别获得与ldhA上、下游片段及△ldh片段分子质量相近的片段,结果见图1。由图1可知,ldh上、下游PCR扩增片段大小分别为717bp和600bp左右,重叠PCR获得大小约1 300bp左右的△ldh,电泳结果与预期大小一致,证明△ldh片段构建成功。
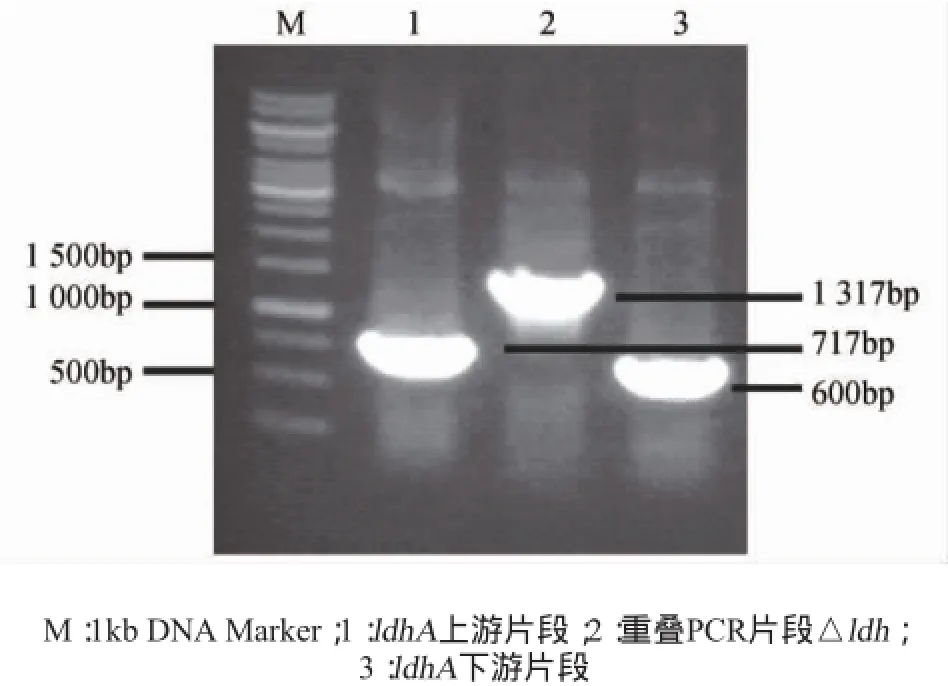
图1 △ldh片段的PCR构建Fig.1 Construction of△ldhfragment by PCR
2.2 重组质粒pK18mobsacB△ldh的构建及鉴定
切胶回收△ldh的PCR扩增产物并采用限制性内切酶EcoRI和HindIII酶切后,连接至经相同酶切的穿梭载体pK18mobsacB,获得重组质粒pK18mobsacB△ldh。提取重组质粒分别采用EcoRⅠ及EcoRⅠ和HindⅢ酶切验证,结果如图2所示。由图2可知,经EcoRⅠ单酶切的重组质粒电泳后出现一条分子质量约为7 000bp的条带,与预期一致。经EcoRⅠ和HindⅢ双酶切的重组质粒电泳后获得分子质量约为5 694bp和1 317bp的片段,分别与pK18mobsacB及△ldh分子质量一致,表明pK18mobsacB△ldh已构建成功。
2.3 ldhA敲除菌株TCCC11822△ldh的构建及验证
pK18mobsacB为谷氨酸棒杆菌基因敲除的常用质粒。pK18mobsacB△ldh被转化至TCCC11822后,因具有ldhA同源序列而整合至该菌的基因组DNA中ldhA上游或下游并随染色体复制,从而使得宿主具有卡那霉素抗性。筛选具有卡那霉素抗性的克隆并提取其基因组DNA并采用引物Kana-N和Kana-C进行PCR验证,经电泳获得一条分子质量约为800bp的片段,与预期分子质量一致,表明pK18mobsacB△ldh成功整合至TCCC11822。

图2 重组质粒pK18mobsacB△ldh的酶切鉴定Fig.2 Enzyme digestion of recombinant plasmid pK18mobsacB△ldh
pK18mobsacB△ldh中的sacB基因编码分泌型蔗糖果聚糖酶,该酶能催化蔗糖水解成葡萄糖和果糖并将果糖聚合成高分子质量的果聚糖,后者因具有毒性而造成细胞死亡。将上述重组菌接种至含蔗糖的BHIS液体培养基中,pK18mobsacB△ldh因同时具有ldhA上游和下游同源序列而发生第二次重组,从而使得pK18mobsacB脱离染色体并使重组菌株丧失卡那霉素抗性,而未发生第二次重组的菌株会因过量果聚糖积累而死亡。筛选仅能在无抗性的BHIS固体培养基中生长的单克隆并提取其基因组DNA,采用引物L1和L4进行PCR验证,经电泳获得分子质量为约1 300bp的片段(△ldh),而从出发菌株TCCC11822基因DNA中扩增出分子质量为约2 200bp的片段,结果见图3。图3结果表明,ldhA基因敲除菌株TCCC11822△ldh成功构建。

图3 ldhA基因敲除菌株的PCR验证Fig.3 Identification of deletionldhAby PCR
2.4 ldhA的敲除对L-谷氨酸摇瓶发酵的影响
为了研究ldhA基因敲除对L-谷氨酸发酵的影响,分别对TCCC11822和TCCC11822△ldh进行摇瓶分批发酵。发酵过程中定时取样测定菌体生物量并计算其比生长速率,于发酵结束后测定发酵液中L-谷氨酸、乳酸及葡萄糖含量并计算转化率。TCCC11822和TCCC11822△ldh生长曲线见图4,L-谷氨酸、乳酸含量及转化率结果见图5。结果表明,TCCC11822△ldh的L-谷氨酸产量及转化率分别比TCCC 11822提高7.6%和5.5%,其乳酸产量较TCCC11822降低85.6%,但生物量略有下降。

图4 TCCC11822和TCCC11822△ldh生长曲线Fig.4 Growth curves of TCCC11822 and TCCC11822△ldhin fermentation process
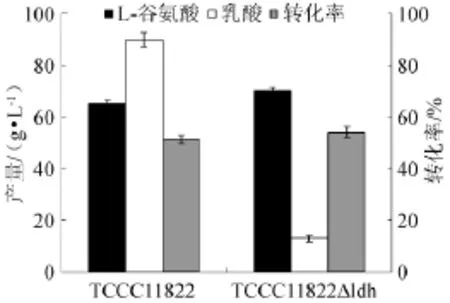
图5 TCCC11822和TCCC11822△ldh L-谷氨酸产量、转化率及乳酸合成量Fig.5L-glutamate production,convert ratio and lactate synthetic quantity by TCCC11822 and TCCC11822△ldh
乳酸是谷氨酸发酵过程中的常见副产物,由乳酸脱氢酶催化丙酮酸生产。过量的乳酸不仅影响菌体生物量,还会引起碳代谢流的浪费,降低L-谷氨酸产量及转化率[13-15]。许多生物均具有多个乳酸脱氢酶同工酶,但经检索谷氨酸棒杆菌仅含一个乳酸脱氢酶编码基因ldhA[8]。因此采用同源重组的方法敲除该基因。摇瓶实验结果表明,该基因的敲除能有效降低乳酸生成量,从而使代谢流更多地流向三羧酸循环并显著提高L-谷氨酸产量及其转化率。本研究可为L-谷氨酸的菌种选育提供参考。
3 结论
本研究采用基因重组技术成功敲除了L-谷氨酸生产菌TCCC11822乳酸脱氢酶ldhA基因,敲除菌株的L-谷氨酸及其转化率均明显提高且乳酸合成量显著降低,但其生物量略有下降。
[1]于信令.味精工业手册(第二版)[M].北京:中国轻工业出版社,2007.
[2]陈宁.氨基酸工艺学[M].北京:中国轻工业出版社,2007.
[3]CALIK G,UNLUTABAK F,OZDAMAR T H.Product and by-product distributions in glutamic acid fermentation byBrevibacterium flavum: effects of the oxygen transfer[J].Biochem Eng J,2001,9(2):91-101.
[4]IKEDA M.Amino acid production processes[J].Adv Biochem Eng Biotechnol,2003,79:1-35.
[5]TAKAC S,CALIK G,MAVITUNA F,et al.Metabolic flux distribution for the optimized production of L-glutamate[J].Enzyme Microb Tech, 1998,23(5):286-300.
[6]CHEN N,DU J,LIU H,et al.Elementary mode analysis and metabolic fl uxanalysisofL-glutamate biosynthesisbyCorynebacterium glutamicum [J].Ann Microbiol,2009,59(2):317-322.
[7]OHNISHI J,MITSUHASHI S,HAYASHI M,et al.A novel methodology employingCorynebacterium glutamicumgenome information to generate a new L-lysine-producing mutant[J].Appl Microbiol Biot,2002,58(2): 217-223.
[8]KALINOWSKI J,BATHE B,BARTELS D,et al.The complete Corynebacterium glutamicumATCC 13032 genome sequence and its impact on the production on of aspartate derived amino acids and vitamins[J].J Biotechnol,2003,104(1-3):5-25.
[9]TAUCH A,KICHNER O,LOFFLER B,et al.Efficient electrotransformation ofCorynebacterium diphtheriaewith a minireplicon derived from Corynebacterium glutamicumplasmid pGA1[J].Curr Microbiol,2002, 45(5):362-367.
[10]饶志明,张君胜,沈微,等.谷氨酸棒杆菌高丝氨酸脱氢酶编码基因ham的敲除[J].中国生物工程杂志,2006,27(1):59-63.
[11]谢希贤,杜军,徐庆阳,等.谷氨酸棒杆菌苏氨酸脱氢酶基因敲除及对L-亮氨酸发酵的影响[J].中国食品学报,2010,10(2):40-45.
[12]KIRCHNER O,TAUCH A.Tools for genetic engineering in the amino acid-producing bacteriumCorynebacterium glutamicum[J].J Biotechnol,2003,104(1):287-299.
[13]PETERS-WENDISCH P G,SCHIEL B,WENDISCH V F,et al.Pyruvate carboxylase is a major bottleneck for glutamate and lysine production byCorynebacterium glutamicum[J].J Mol Microbiol Biotechnol, 2001,3(2):295-300.
[14]STANSEN C,DELAUNAY U D,DELAUNAY S,et al.Characterization of aCorynebacterium glutamicumlactate utilization operon induced during temperature-triggered glutamate production[J].Appl Environ Microb,2005,71(10):5920-5928.
[15]TOYODA K,TERAMOTO H,INUI M,et al.Molecular mechanism of SugR-mediated sugar-dependent expression of theldhAgene encoding L-lactate dehydrogenase inCorynebacterium glutamicum[J].Appl Microbiol Biotechnol,2009,83(10):315-327.
Impact ofldhAknockout onL-glutamate fermentation byCorynebacterium glutamicumTCCC11822
ZHANG Chenglin1,2,3,LI ZhiHua1,LIANG Jingbo1,2,3,XU Qingyang1,2,3*
(1.National and Local United Engineering Lab of Metabolic Control Fermentation Technology,Tianjin 300457,China; 2.Tianjin Engineering Laboratory of Efficient and Green Amino Acid Manufacture,Tianjin 300457,China; 3.College of Biotechnology,Tianjin University of Science and Technology,Tianjin 300457,China)
Lactic acid is one of main by products excreted in to the fermentation medium byCorynebacterium glutamicum.To improveL-glutamate production and reduceL-lactate accumulation,pK18mobsacB△ldh used for dehydrogenase-encoding geneldhAknockout was constructed andldhA was knocked out fromL-glutamate producing strainCorynebacterium glutamicumTCCC11822,designated TCCC11822△ldh.Result showed that the lactate synthetic quantity reduced 85.6%,but the production and conversion ofL-glutamate increased 7.6%and 5.5%,respectively.The biomass declined slightly.This study will lay theoretical foundation on rational reconstruction ofL-glutamate and other amino acids producing strains.
L-glutamate;lactic acid;lactate dehydrogenase;gene knockout
Q78;TQ920.1
A
0254-5071(2014)04-0106-04
10.3969/j.issn.0254-5071.2014.04.026
2014-01-10
国家高技术研究发展计划“863计划”(No.2013AA102106)
张成林(1982-),男,讲师,博士,研究方向为代谢控制发酵。李志华(1974-),男,工程师,博士,研究方向为代谢控制发酵。注:以上两人为并列第一作者。
*通讯作者:徐庆阳(1980-),男,副研究员,博士,研究方向为发酵工程。
