牛血清白蛋白-刺槐豆胶-壳聚糖缓释纳米微球的制备、表征及其体外释放性能研究
2014-03-03高义霞周向军王廷璞袁毅君
高义霞,周向军,王廷璞,袁毅君
(天水师范学院生命科学与化学学院,甘肃天水 741001)
牛血清白蛋白-刺槐豆胶-壳聚糖缓释纳米微球的制备、表征及其体外释放性能研究
高义霞,周向军,王廷璞,袁毅君*
(天水师范学院生命科学与化学学院,甘肃天水 741001)
以刺槐豆胶和壳聚糖为载体,戊二醛为交联剂,牛血清白蛋白(BSA)为模型药物,采用交联法制备BSA-刺槐豆胶-壳聚糖缓释纳米微球。通过单因素实验探讨不同戊二醛浓度、载体与BSA质量比、水相:油相体积比及交联时间对纳米微球制备的影响,对纳米微球进行红外光谱、热重、元素分析、动态光散射及形貌等表征,并测定体外释放性能。结果表明,纳米微球最佳制备工艺为:戊二醛浓度1.25%,载体与BSA比为20∶1,水相与油相比6∶1,交联时间60min,在此条件下纳米微球包封率为62.32%±0.39%,载药量3.45%±1.43%。形貌分析表明,纳米微球尺寸分布均一,平均粒径约为80nm。纳米微球具有一定的缓释能力,在模拟小肠中释放最快,胃中次之,大肠中最慢。
刺槐豆胶,壳聚糖,牛血清白蛋白,缓释
随着生物技术的发展,多肽、蛋白质类药物不断涌现,虽然其常规制剂疗效早已经临床证实,但由于生物药物半衰期短,需要长期频繁注射给药,且不稳定,从而使患者在心理和经济上均难以接受[1]。包裹多肽、蛋白质药物制成注射纳米微球剂,使其在体内达到缓释目的,是近10多年来各国学者大力研究的新领域。壳聚糖具有生物组织相容性好、抗原性低、无毒和良好的生物活性等特性,引起了人们的极大关注,在过去的几十年中,其在农业、工业和医药等领域的应用发展迅速[2-4]。壳聚糖广泛应用于缓释、控释制剂,已有了一定的研究[5],如利用壳聚糖修饰脂质体、纳米微球、微囊等递药系统[6-7],可控制药物的释放,改善易降解物质的生物利用度,增强亲水性药物通过上皮层的渗透性等[8]。但如果单纯利用壳聚糖制备的纳米微球包载药物,其强度差、成球率低,易影响包载量及缓释能力。刺槐豆胶是一种水溶性高分子多糖类聚合体,其单元以1,4糖苷键连接的β-D-甘露糖为主链,在某些甘露糖基的6位上连接一个α-D-半乳糖构成半乳甘露聚糖,二者比率约为4∶1,由于甘露糖和半乳糖比率的特殊性,决定了刺槐豆胶聚合体在水中三维立体结构的特殊性,这使其本身能在特殊环境下形成凝胶且可以和其他亲水胶体相互作用 产 生 凝 胶[9-11],同 时 暴 露 出 活 性 基 团 羟 基 ,更 利于包载药物。本研究应用壳聚糖与刺槐豆胶的协同作用,以BSA为模拟药物,采取戊二醛交联法以制备纳米微球,并进而研究其作为蛋白类药物缓释载体的缓释能力。该研究为其应用提供了基本实验依据。
1 材料与方法
1.1 材料与仪器
PLPHR 1-4 LD真空 冷冻 干 燥 机 德 国 Christ;NOCOLET FT-IR360 红 外 扫 描 仪 美 国 Nocolet公司 ; 元 素 分 析 仪 德 国 Elementar Analysensysteme GmbH公司;BT-9300Z动态光散射纳米粒度分析仪丹东百特;Tecnai G2 20透射电镜 美国FEI公司。
1.2 实验方法
1.2.1 BSA标准曲线的制作 参考文献[12]的方法,以吸光度为纵坐标,BSA浓度(μg/mL)为横坐标,制作 标 准 曲 线 :Y=0.02563X-0.00512,R2=0.9992,Y 为吸光度,X为BSA浓度(μg/mL)。
1.2.2 BSA-壳聚糖-刺槐豆胶缓释纳米微球的制备取0.5g壳聚糖溶解在50mL 2%乙酸中,将一定量的BSA分散于此壳聚糖溶胶中,为溶液A;另取0.5g刺槐豆胶分散于50mL热水中,抽滤,收集上清液,为溶液B;将A、B两种溶液混合均匀,转入200mL恒压漏斗中,缓慢滴入一定比例的石蜡油、石油醚、Span-80及吐温-20混合液,500r/min搅拌30min以形成稳定的微乳溶液。再缓慢滴加一定浓度的戊二醛为交联剂,500r/min搅拌反应一定时间后,丙酮破乳,沉淀,离心,分别收集沉淀和上清液。蒸馏水洗至茚三酮检测[13]为阴性,收集沉淀,冷冻干燥至恒重,即为BSA-壳聚糖-刺槐豆胶缓释纳米微球,作为载药球[14-15],收集洗涤液,合并上清液备用。同法制备壳聚糖-刺槐豆胶缓释纳米微球,作为空白球。
1.2.3 单因素实验设计 以空白球为对照,考察四个因素对BSA包封率的影响,优选BSA-刺槐豆胶-壳聚糖缓释纳米微球的最佳制备工艺。
a.戊二醛浓度单因素实验:戊二醛浓度(v/v)0.5%、0.75%、1.0%、1.25%、1.5%、2%、3%,载体与BSA比(m/m)为20∶1,油相与水相比(v/v)为6∶1,交联时间为60min;
力学性能要求:Rp0.2≥300MPa,Rm≥480MPa,A≥20%,AK V≥50J(20℃时)。超声波无损检测的检验等级按EN12680一级,质量等级按SN320第10部分进行验收。
b.载体与BSA比单因素实验:载体与BSA比(m/m)为5∶1、10∶1、15∶1、20∶1、25∶1、30∶1、35∶1,戊二醛浓度(v/v)1.25%,油相与水相比(v/v)为6∶1,交联时间为60min;
c.油相与水相比单因素实验:油相与水相比(v/v)为5∶1、6∶1、7∶1、8∶1、10∶1、12∶1,戊二醛浓度(v/v)1.25%,载体与BSA比(m/m)为20∶1,交联时间为60min;
d.交联时间单因素实验:交联时间为30、60、90、120、150min,戊二醛浓度(v/v)1.25%,载体与BSA比(m/m)为20∶1,油相与水相比(v/v)为6∶1。
1.2.4 包封率与载药量的计算 取上述上清液1mL,以1.2.1法测定BSA含量,计算纳米微球包封率和载药量[16]。
包封率(%)=(最初加入BSA量-上清BSA量)/最初加入BSA量×100;
载药量(%)=(总BSA量-游离BSA量)/纳米微球质量×100。
1.2.5 稳定性实验 在最佳工艺条件下,重复制备载药球和空白球各3次,以包封率和载药量为指标考察工艺稳定性[17]。
1.2.6 缓释纳米微球的表征 利用红外光谱、热重分析对壳聚糖和刺槐豆胶混合物、空白球、载药球进行表征;利用元素分析法研究载药球和空白球各特征元素的变化;利用动态光散射纳米粒度分析仪测定载药球平均粒径和粒径分布;利用光学显微镜和透射电镜观察载药球的形貌[18]。
1.2.7 释放性能的测定 分别配制下列溶液:pH2.0酸性缓冲液 (模拟胃液环境);pH7.2磷酸盐缓冲液(模拟小肠环境)[19];pH9.0弱碱缓冲液 (模拟大肠环境),考察载药球在不同介质中的药物释放情况。精确称取50mg载药球于透析袋中,将透析袋置于锥形瓶中,分别加入100mL上述不同pH缓冲液于37℃摇床温浴。每隔一定时间取样1mL,考马斯亮蓝法测定蛋白含量,计算BSA释放率,以空白球作对照实验。
1.3 数据处理
2 结果与分析

图1 戊二醛浓度对包封率的影响Fig.1 The influence of glutaraldehyde concentration on encapsulation efficiency
2.1 纳米微球制备工艺优选
2.1.1 不同戊二醛浓度对纳米微球包封率的影响 由图1可知,当戊二醛浓度小于1.25%(v/v)时,纳米微球对BSA的包封率随浓度升高而增加;当戊二醛浓度为1.25%时,包封率达到最大值,为62.6%±1.15%(p>0.05)。当戊二醛浓度在1.25%~2%范围时,包封率急剧下降;当戊二醛浓度大于2%时,包封率几乎保持不变。可能原因是戊二醛既是交联剂,又是蛋白质变性剂。当戊二醛浓度较低时,形成的微球机械强度低,BSA在被固定化后仍容易脱落;戊二醛浓度过高除了自身发生羟醛缩合,固化成不规则物附在产物表面,影响微球的表面孔结构,使得BSA不易被固定,此外酶与载体上的过多的醛基反应会引起BSA发生变性[20]。因此在本实验中,最适戊二醛浓度为1.25%。2.1.2 载体与BSA不同比对包封率的影响 由图2知,当载体与BSA比小于20∶1时,纳米微球对BSA的包封率随比值的升高而增加;当载体与BSA比为20∶1时,包封率达到最大值,为64.48%±0.35%(p>0.05)。当载体与BSA比大于20∶1时,包封率随比值的升高而降低。这是因为载体对模型药物有最大的承载量,载体偶联的BSA直接影响固定化药物的包封率,因而载体与BSA不同比将严重影响包封率。当负载的BSA达到一定量后,再增加给药量反而会增加固定化药物分子之间的拥挤程度,使之与底物结合时空间阻碍增大,造成药物包封率降低[20]。因此实验中最佳载体与BSA比为20∶1。
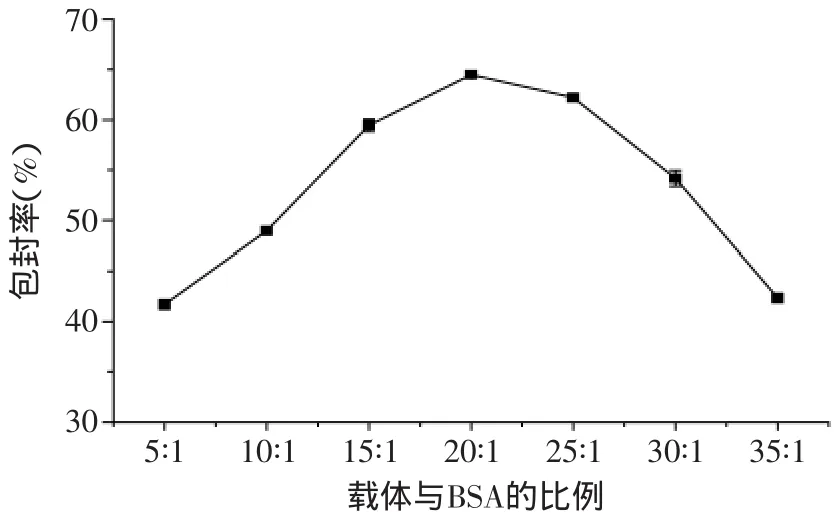
图2 载体与BSA的比对包封率的影响Fig.2 The influence of carrier/BSA on encapsulation efficiency
2.1.3 不同水相:油相比(W/O)对包封率的影响 由图3知,当W/O低于5∶1时,反应体系不能形成稳定的微乳液,纳米微球产率过低,因此本实验以W/O=5∶1为初始值。当W/O低于6∶1时,纳米微球对BSA的包封率随W/O比的增大而升高;当W/O=6∶1时,包封率达到最大值,为62.8%±0.54%(p>0.05);当W/O高于6∶1时,包封率随着W/O比的升高而降低。可能原因是W/O低于6∶1时,油相过量,水相不足,成球率低;但当W/O高于6∶1时,水相过量,形成的微乳液较稀,较难成 球 ,造 成 纳 米 微 球 包 封 率 下 降[21]。 因 此 在 本 实 验中,最适W/O=6∶1。
2.1.4 不同交联时间对包封率的影响 由图4可见,当时间低于60min时,纳米微球对BSA的包封率随时间的增加而升高;当时间为60min时,包封率达到最大值,为62.8%±0.6%(p>0.05)。当时间大于60min时,包封率随时间的增加而降低。这是因为交联时间太短,交联不充分,固定的BSA少;当交联时间太长,载体之间交联的纳米微球空隙过于致密使得BSA很难包载[20]。在本实验中,最适交联时间为60min。
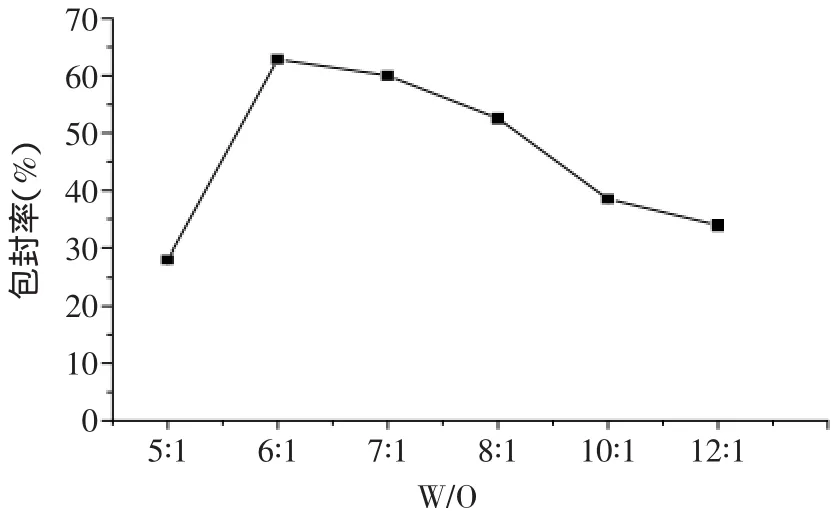
图3 水相与油相的比对包封率的影响Fig.3 The influence of water/oil phase on encapsulation efficiency
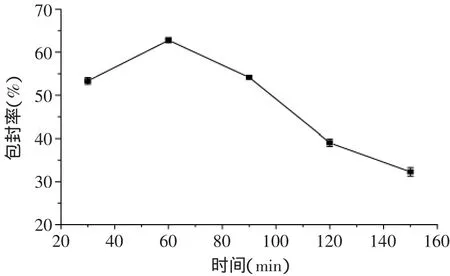
图4 时间对包封率的影响Fig.4 The influence of time on encapsulation efficiency
2.1.5 稳定性实验 在戊二醛浓度为1.25%,载体与BSA比20∶1,W/O为6∶1,交联时间60min条件下,重复制备纳米微球及空白球三次,考察制备工艺的稳定性,结果见表1。重复三次得到纳米微球包封率61%~63%之间变化,基本稳定,相对标准偏差(RSD)为0.24%。纳米微球载药量在3.45%~3.55%之间变化,比较稳定,相对标准偏差(RSD)为0.05%。因此,BSA-壳聚糖-刺槐豆胶缓释纳米微球的制备工艺稳定性好,重复率高。

表1 稳定性实验Table 1 Stability testing
2.2 BSA-刺槐豆胶-刺槐豆胶缓释纳米微球的表征
2.2.1 纳米微球的红外分析 采用KBr压片法分别测定刺槐豆胶和壳聚糖混合物、空白球和载药球官能团的吸收峰,并进行比较,见图5。可知,三者均在3400、2920、1080cm-1等处出现较强吸收峰,此为多糖类物质特征吸收峰。但与壳聚糖和刺槐豆胶混合物相比,纳米微球在3400、1080cm-1处信号大为减弱,而3400cm-1归属为多糖羟基或壳聚糖氨基的伸缩振动,1080cm-1归属为C-NH2的伸缩振动,可能原因为羟基和氨基参与反应而被保护。与壳聚糖和刺槐豆胶混合物不同,纳米微球在1640cm-1出现吸收峰,归属为西佛碱的C=N-C的振动,可能是壳聚糖氨基与戊二醛交联形成西佛碱官能团的信号峰;在3400、1080cm-1处信号强度减弱,可能是多糖羟基或壳聚糖氨基被BSA保护,信号峰强度降低。
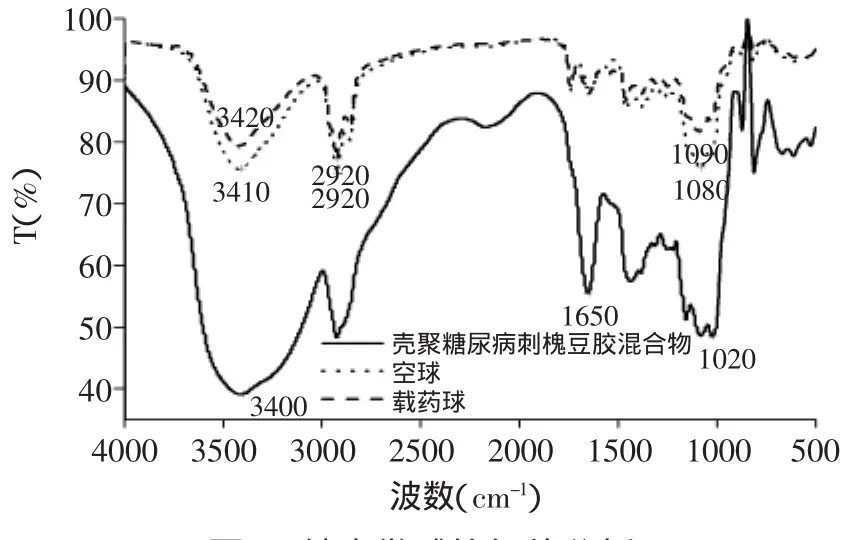
图5 纳米微球的红外分析Fig.5 Infrared analysis of microspheres
2.2.2 纳米微球热重分析 由图6a,可知三种物质在第一阶段的失重率较缓慢,载药球在26~150℃范围内失重率为7.59%,空白球失重率为7.79%,壳聚糖和刺槐豆胶混合物失重9.65%。第二阶段均出现快速失重,载药球在150~300℃范围内失重率为37.28%,空白球失重率为36.17%,壳聚糖和刺槐豆胶混合物急剧失重,为38.21%。第三阶段失重逐渐变缓,载药球在300~400℃范围内失重率为25.18%,空白球失重率为36.03%,载药球失重12%。第四阶段载药球在400~800℃范围内失重变缓,载药球失重为9.87%,失重率为17.67%,壳聚糖和刺槐豆胶混合物失重8.25%。三物质相比之下:载药球与空白球稳定性相当,壳聚糖和刺槐豆胶混合物的热稳定性最好。即戊二醛的引入使得壳聚糖或刺槐豆胶的分子结构变得松散,热稳定性降低。从图6b可看出,整个失重过程都是放热反应。这表明,在氮气氛围中,没有明显的氧化过程,只是热裂解反应。
2.2.3 纳米微球的元素分析 由表2知,载药球的N、C、H三元素的百分含量均升高,且C、N元素升高的最多,这说明BSA已被纳米微球吸附。
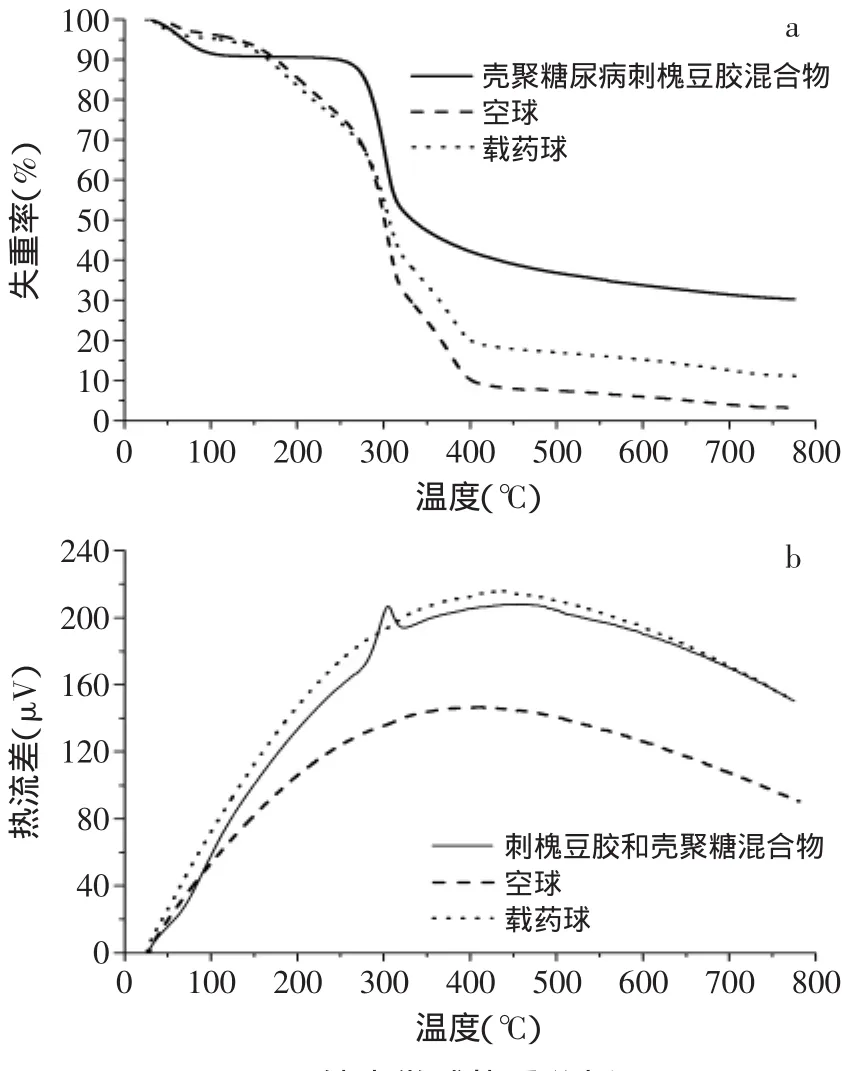
图6 纳米微球热重分析Fig.6 Thermogravimetric analysis of microspheres
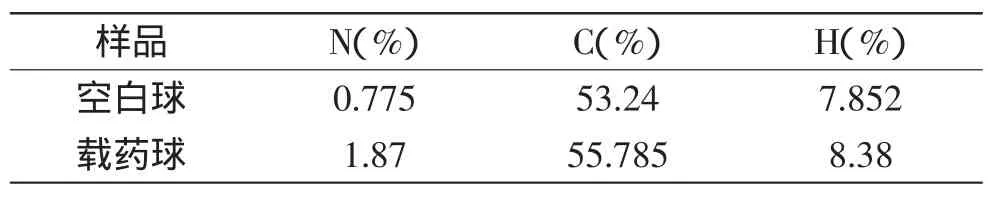
表2 纳米微球的元素分析Table 2 Element analysis of microspheres
2.2.4 动态光散射 图7是通过动态激光散射仪对载药球粒径大小及分布的检测结果,由图7可知,纳米微球的粒径约在55~110nm之间,基本符合正态分布。计算出平均粒径为79.3nm。
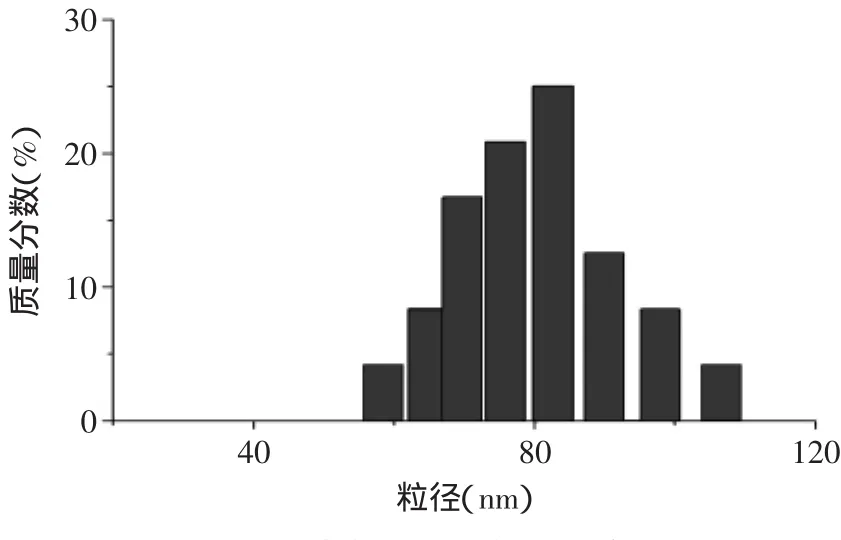
图7 纳米微球的粒径分布Fig.7 Size distribution of microspheres
2.2.5 纳米微球的形貌观察 利用光学显微镜和扫描电镜对干态纳米微球拍照(图8),可见纳米微球具有了凹凸面和孔穴结构,尺寸分布均匀,粒径大约为80nm,与动态光散射结果一致。具有凹凸面和空穴结构,说明微球表面某些基团易解离,但微球仍具有完整的骨架结构,且分散性好、无团聚现象,适合作为BSA的缓释的载体。

图8 纳米微球的形貌Fig.8 Morphology of microspheres
2.3 纳米微球对BSA的缓释分析
不同pH条件下缓释率随时间的变化(p<0.01),见图9,在体外模拟人体消化道环境(胃、小肠、大肠)制备的三种不同pH缓冲液中,BSA缓释率表现出相似的药物释放动力学模式,即早期快速的释放和后期的缓慢、持续释放。开始前5h,三种不同pH缓冲液对BSA的缓释率随时间的增加而升高,缓释率变化趋势相对较快;5h后缓释变化趋势随时间推移逐渐变慢,当达25h时,pH2.0、7.2、9.0缓冲液对BSA缓释率分别为80.2%±0.99%、88.06%±0.51%和82.84%±0.06%。但三种不同pH的缓冲液对BSA的缓释速率不同,pH2.0酸性缓冲液释放最快,在20h内,pH7.2环境较9.0快,即纳米微球在模拟小肠缓冲液中释放最快,胃中次之,大肠中释放最慢。
3 结论
以壳聚糖和刺槐豆胶为载体,戊二醛为交联剂,制备BSA-刺槐豆胶-壳聚糖缓释纳米微球,通过单因素实验筛选出纳米微球制备的最佳工艺:戊二醛浓度为1.25%,载体/BSA20∶1,W/O为6∶1,交联时间60min,对此条件下制备的纳米微球进行表征,纳米微球尺寸分布均一,平均粒径为80nm左右;与载体相比,纳米微球的稳定性稍有降低。体外释放实验表明纳米微球对BSA具有一定的缓释能力。因此BSA-刺槐豆胶-壳聚糖缓释纳米微球可作为蛋白类药物缓释载体,具有一定的应用价值。
[1]姬振行,安静,王德松,等.壳聚糖纳米微球的制备与应用[J]. 材料导报,2010,24(7):128-132.
[2]Rejinold NS,Muthunarayanan M,Divyarani VV.Curcuminloaded biocompatible thermoresponsive polymeric nanoparticles for cancer drug delivery[J].Journal of Colloid and Interface Science,2011,360(1):39-51.
[3]Dev A,Binulal NS,Anith A,et al.Preparation of poly(lactic acid)/chitosan nanoparticlesforanti-HIV drug delivery applications[J].Carbohydrate Polymers,2010,80(3):833-838.
[4]贾伟涛,张欣,黄文旵,等.抗生素缓释载体用硼酸盐玻璃/壳聚糖复合材料[J]. 硅酸盐学报,2010,38(7):1303-1309.
[5]谢宇,尚晓娴,蒋丰兴,等.壳聚糖纳米纳米微球对牛血清蛋白的包封和缓释效果研究[J]. 化学研究与应用,2008,20(12):1617-1621.
[6]Dev A,Mohan JC,Sreeja V,et al.Novel carboxymethyl chitin nanoparticles for cancer drug delivery applications[J]. Carbohydrate Polymers,2010,79(4):1073-1079.
[7]王津,陈莉敏,蒋智清,等.壳聚糖-明胶体系的温敏凝胶及其药物缓释性能[J]. 功能材料,2013,44(9):1294-1297.
[8]刘伟,查晶,胡一娇.壳聚糖作为缓控释辅料的研究最新进展[J]. 中国药科大学学报,2000,31(30):234-238.
[9]Wang JH,Lou FC,Wang YL,et al.A flavonol tetraglycoside from sophora japonica seeds[J].Phytochemistry,2003,63(4):463-465.
[10]Mao CF,Chen JC.Interchain association of locust bean gum in sucrose solutions:an interpretation based on thixotropic behavior [J].Food Hydrocolloids,2006,20(5):730-739.
[11]李欣,范明娟,冯廉彬,等.24种豆科植物的半乳甘露聚糖胶分析[J]. 植物学报,2000,22(3):302-304.
[12]萧能,余瑞元,袁明秀,等. 生物化学原理与方法[M]. 第二版.北京:北京大学出版社,2005:240-242.
[13]周虹,徐文第. 生物化学与分子生物学高级教程[M]. 北京:科学出版社,2002:219-221.
[14]姜涌明,隋德新,赵国骏,等.壳聚糖固定化木瓜蛋白酶的研究[J]. 生物化学杂志,2003,9(4):404-407.
[15]吴俊珠,王成军,金拓.赖诺普利微粒载药量与包封率影响因素研究[J]. 大理学院学报,2010(2):18-23.
[16]周嘉嘉,陈汝福,卢红伟,等.两亲多糖纳米胶束作为药物缓释载体的制备及释药研究[J]. 中山大学学报:医学版,2006,127(6):667-671.
[17]李新民,宋全道,叶国华,等.尼莫地平壳聚糖纳米微球的制备及其体外释药特性的研究[J]. 中国现代应用药学,2010(6):11-27.
[18]姜炜,李凤生,杨毅,等.磁性壳聚糖复合纳米微球的制备和性能研究[J]. 材料科学与工程学报,2004,22(5):660-662.
[19]张杰,张新宇,张代佳,等.喷雾法制备载牛血清白蛋白海藻酸钙微 球系 统 研究[J]. 大连 理工大学 学报 ,2009,49(6):822-826.
[20]刘真,常雁红,刘仁霖,等.磁性壳聚糖微球的制备及对乳酸氧化酶的固定化研究[J]. 现代化工,2007(增2):310-313.
[21]张素敏,孙元庆,李倩,等.纳米糊精微球的的制备与优化研究[J]. 现代化工,2008(增2):228-234.
Preparation,characterization and in vitro releasing property of bovine serum albumin-locust bean gum-chitosan sustained-release microspheres
GAO Yi-xia,ZHOU Xiang-jun,WANG Ting-pu,YUAN Yi-jun*
(College of Life Science and Chemistry,Tianshui Normal University,Tianshui 741001,China)
Bovine serum albumin(BSA)-locust bean gum-chitosan sustained-release microspheres were prepared by cross-linking method using locust bean gum and chitosan as carrier,glutaraldehyde cross-linking agent and BSA model drug.The effects of different glutaraldehyde concentration ,the ratio of carrier to BSA and water to oil phase,and cross-linking time on microspheres preparation were investigated by single factor experiments. The resulting microspheres were characterized by infrared spectrum,thermogravimetric analysis,element analysis,dynamic light scattering and morphology analysis.At the same time,its releasing property was also determined.The results showed that the optimal preparation technology for microspheres were glutaraldehyde concentration 1.25% ,the ratio of carrier to BSA and water to oil phase 20 ∶1 and 6 ∶1,respectively and crosslinking time 60min.Under these conditions,encapsulation efficiency and drug loading for microspheres were 62.32% ±0.39%and 3.45%±1.43% ,respectively.The morphology of microspheres was in uniform size with the average diameter of 80nm.The microspheres had certain sustained-release capability,and their releasing rate was as follows:small intestine>stomach>large intestine.
locust bean gum;chitosan;bovine serum albumin;sustained-release
TS201.1
B
1002-0306(2014)20-0332-05
10.13386/j.issn1002-0306.2014.20.064
2014-01-06
高义霞(1982-),女,硕士研究生,讲师,研究方向:资源植物的开发利用研究。
* 通讯作者:袁毅君(1966-),女,博士,教授,研究方向:中药活性成分提取分离及药理研究。
天水师范学院“青蓝”人才工程基金资助;国家自然基金(81360619)。
