不同营养元素对小球藻Chlorella sorokiniana C74生长的影响
2014-03-03刘平怀
张 玲,杨 勋,张 森,罗 宁,刘平怀
(海南大学材料与化工学院,海南海口 570228)
不同营养元素对小球藻Chlorella sorokiniana C74生长的影响
张 玲,杨 勋,张 森,罗 宁,刘平怀*
(海南大学材料与化工学院,海南海口 570228)
以小球藻(Chlorella sorokiniana)为研究对象,考察了不同的培养基,不同的氮源,氮浓度和磷浓度对其细胞生长及营养成分的影响。结果表明,小球藻细胞生长最佳培养基为BBM培养基。不同培养基对其油脂、蛋白质和色素含量影响较小,BG-11培养基下多糖含量(44.46%)明显高于其他培养基。以甘氨酸为氮源时小球藻的生物量、油脂、蛋白质、多糖和色素含量均高于其他组。小球藻细胞生长最佳氮浓度为13.33mmol/L,缺氮情况下生物量、油脂、蛋白质和色素含量较低,但多糖含量较高,约为其他组的2倍。小球藻细胞生长最佳磷浓度为1.72mmol/L。随着磷浓度升高,小球藻生物量、油脂和蛋白质含量先增大后降低,多糖和色素含量随磷浓度升高略有降低。
小球藻,细胞生长,培养基,氮源,磷
微藻是一类分布广泛,光合效率高的自养低等生物,是地球上最古老的初级生产者之一。微藻在其生长繁殖过程中产生及其丰富的代谢产物,其中以脂类、蛋白质、糖类和色素居多,这些物质在能源、食品、饵料和医药方面有着重要的应用。微藻的生长及其代谢产物与其培养条件息息相关。氮源是限制微藻生长和代谢的重要因素之一,氮是合成氨基酸所必需的元素。研究表明,氮源对微藻生长、油脂积累和蛋白质含量均有较大影响,氮的缺乏会导致微藻细胞生长受到抑制,但有利于油脂积累[1-6]。有研究发现,Neochloris oleoabundans[7]、眼点拟微球藻[8]在以硝酸钠为氮源时生长最快,生物量、油脂含量和油脂产率最高。磷是构成微藻细胞膜、核酸的重要元素,是多种酶的辅基,参与碳水化合物的代谢及脂肪酸的转化,并且是合成叶绿素所必须的。磷是水生生态系统初级生产力水平的关键制约因素,培养液中磷浓度水平对微藻生长及代谢产物会造成一定的影响。Ruangsomboom S[9]的 研 究 表 明 ,不 同 磷 浓 度 对 于Botryocococcus braunii的生长影响不明显,但磷浓度过高或过低都对油脂积累不利。
改变培养液中营养成分会导致微藻细胞代谢产物类型及比例发生改变,本研究以小球藻为研究对象,考察不同培养基、氮源及氮浓度和磷浓度对藻细胞的生长及代谢产物的影响,以期为培养小球藻获得特定类型代谢产物提供研究基础。
1 材料与方法
1.1 材料与仪器
小 球 藻(Chlorella sorokiniana C74) 分 离 自 海南儋州,现保存于海南大学生物工程实验室;蒽酮、硫酸、葡萄糖、甲醇、氯仿、丙酮、硝酸钠、硝酸铵、氯化铵、尿素、磷酸等 均为国产分析纯;甘氨酸 为食品级。
CR22GⅡ高速冷冻离心机 日立;LGJ-25C冷冻干燥机 北京四环仪器;TU-1810紫外可见分光光度计 普析通用。
1.2 培养条件
采用柱形光生物反应器培养小球藻,装新鲜培养液灭菌冷却后按10%(V/V)接种,全天光照,光照强度为8000lux,培养温度为26℃,通入无菌空气,通气量为5L/min。培养结束后离心收集藻液,冻干后藻粉保存于-20℃冰箱。
1.3 实验设计
1.3.1 不同培养基对小球藻细胞生长及细胞内营养成分的影响 小球藻在五种培养基(AF-6、BBM、TAP、SE和BG-11)下培养,培养周期为15d,培养过程中每天取样一次,测定680nm处的光密度(OD680),培养结束后8000r/min离心5min收集藻泥,冻干后测定生物量和藻细胞内油脂、蛋白质、多糖和色素含量。
1.3.2 不同氮源对小球藻细胞生长及细胞内营养成分的影响 选取上述实验中藻细胞生长最适的培养基作为基础培养基,以硝酸钠、硝酸铵、尿素、氯化铵和甘氨酸为氮源,最终有效氮浓度均为8.82mmol/L,培养周期为10d,培养过程中每天取样一次,测定680nm 处 的 光 密 度(OD680),培 养 结 束 后 8000r/min 离心5min收集藻泥,冻干后测定生物量和藻细胞内油脂、蛋白质、多糖和色素含量。
1.3.3 氮浓度对小球藻细胞生长及细胞内营养成分的影响 在上述实验基础上,以藻细胞生长最佳氮源为基础氮源,设定氮浓度为0、13.33、26.67、40mmol/L,培养周期为10d,培养过程中每天取样一次,测定680nm 处 的 光 密 度(OD680),培 养 结 束 后 8000r/min 离心5min收集藻泥,冻干后测定生物量和藻细胞内油脂、蛋白质、多糖和色素含量。
1.3.4 磷浓度对小球藻细胞生长及细胞内营养成分的影响 在上述实验基础上,设定磷(原BBM培养基中的磷源,磷酸氢二钾和磷酸二氢钾)浓度为0.43、0.86、1.72、3.44、5.16mmol/L,培养周期为10d,培养过程中每天取样一次,测定680nm处的光密度(OD680),培 养 结 束 后8000r/min 离 心5min收 集 藻 泥 ,冻 干 后测定生物量和藻细胞内油脂、蛋白质、多糖和色素含量。
1.4 分析方法
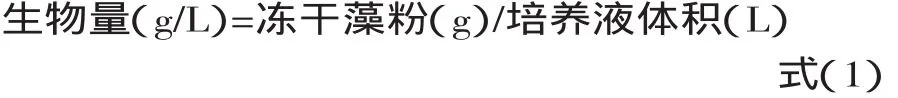
1.4.1 生长曲线及生物量 微藻培养过程中每天测定OD680值,根据光密度值绘制微藻生长曲线。藻液培养完成后离心,离心(8000r/min)5min收集微藻,藻泥使用冷冻干燥机干燥,干燥后按照式(1)计算生物量:
1.4.2 油脂含量测定 参照Luyen HQ[10]油脂测定方法,称取藻粉0.1g,加入氯仿-甲醇-水(体积比为1∶2∶0.8)混合液20mL,50℃超声提取15min,然后加入氯仿-水(体积比为1∶1)混合液10mL,50℃超声提取15min,静置分层,取有机相于50℃下干燥至恒重,计算出油率,设3个平行实验,取平均值。按照式(2)计算油脂含量:

式中,m1表示0.1g藻粉提取所得到的油脂含量,单位为g。
1.4.3 蛋白质含量测定 采用双缩脲法测定藻体内蛋白质含量,得到蛋白质含量标准曲线:
C(mg/mL)=19.23OD540+0.05(R2=0.999)
蛋白质提取液制备[11]:取0.1g藻粉,加入4mL PBS缓 冲 液 ,冻 融 破 碎 3 次(每 次 30min),超 声 15min,4000r/min离心10min,取上清液,藻泥重复提取一次,合并上清液,定容至10mL。
取1mL待测液加入4mL双缩脲试剂,于540nm处比色。以1mL蒸馏水加入4mL双缩脲试剂作参比。设3个平行实验,取平均值。根据绘制的蛋白质含量标准曲线,计算藻细胞内蛋白质含量。
1.4.4 多糖含量测定 采用硫酸-蒽酮比色法测定藻 体 内 多 糖 含 量[11],得 到 葡 萄 糖 含 量 标 准 曲 线 :C(mg/mL)=1.11×OD620-0.012(R2=0.993)。
多 糖 提 取 液 制 备 参 照 王 俊[12]的 方 法 并 加 以 改进:取藻粉0.1g,加蒸馏水3mL,超声10min后研磨数次,藻液转入烧杯中,用6mL蒸馏水清洗研钵,合并清洗液,加入6mol/L盐酸6mL,搅拌均匀后沸水浴30min,调pH=7,过滤,滤液定容至500mL。
取1mL待测液加入4mL蒽酮试剂,沸水浴中煮沸10min,自来水冷却至室温,于620nm处比色。以1mL蒸馏水加4mL蒽酮试剂作参比。设3个平行实验,取平均值。根据绘制的葡萄糖含量标准曲线,计算藻细胞内多糖含量。
1.4.5 色素含量测定 取藻粉20mg,加入5mL 80%丙酮,避光过夜放置,4000r/min离心10min,取上清液,定容至100mL。取上述提取液于470、663、645nm处测定吸光度值[13],以80%丙酮为空白对照。按如下公式计算色素含量:
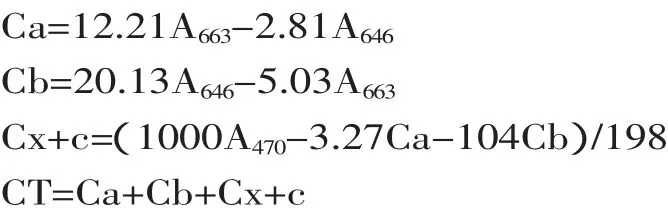
藻细胞色素含量(%)=CT×V/m2×100
式中,Ca、Cb、Cx+c、CT分别为叶绿素a、叶绿素b、类胡萝卜素和总色素质量浓度(μg/mL);V为提取液体积(100mL);m2为藻粉质量(20mg)。
1.5 数据分析
采用SPSS 20.0单因素方差分析(ANOVA)中的Duncan两两比较对实验数据进行方差及差异显著性分析。使用Microsoft Office Excel 2007软件对数据结果作图。
2 结果与分析
2.1 不同培养基对小球藻细胞生长及细胞内营养成分的影响
如图1所示,小球藻在TAP培养基中生长最快,培养4d后即进入稳定期,其OD680值最大;其次为BBM、SE、BG-11和AF-6培养基。采用5种不同培养基培养小球藻,其最终生物量、油脂含量、蛋白质含量、多糖含量和色素含量见表1。由表1可知,采用TAP和BBM培养基培养生物量无显著性差异(p>0.05),略高于SE和BG-11培养基,AF-6培养基生物量最低。采用5种培养基条件下小球藻油脂含量无明显差异(p>0.05)。SE组蛋白质含量最高,其次为BBM组,TAP、BG-11和AF-6组蛋白质含量基本相同。BG-11组多糖含量明显高于其他4组(p<0.05),这可能是因为在BG-11培养基中存在着含量较高的Na2CO3使得微藻在生长过程中大量合成多糖。TAP组色素含量最高,略高于SE、BBM和AF-6组,是BG-11组的2倍。综合上述,小球藻生物量、油脂、蛋白质、多糖和色素积累最佳培养基分别为TAP、SE、SE、BG-11和TAP培养基。由于小球藻在TAP和BBM培养基中生物量基本相同,但TAP培养基中使用较大量的三羟甲基甲胺(2.42g/L),其培养成本明显高于BBM培养基,因此选择BBM培养基为小球藻生长最佳培养基。

图1 不同培养基对小球藻生长的影响Fig.1 Effect of different culture medium on the growth of Chlorella sorokiniana C74

图2 不同氮源对小球藻生长的影响Fig.2 Effect of different nitrogen sources on the growth of Chlorella sorokiniana C74
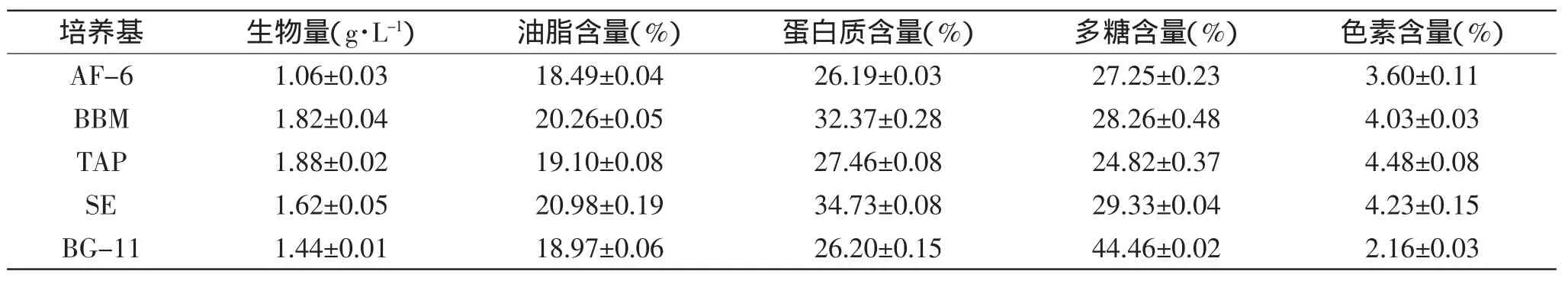
表1 不同培养基下小球藻细胞生物量及细胞主要成分Table 1 Biomass productivities and main ingredients of Chlorella sorokiniana C74 cells in different culture medium
2.2 不同氮源对小球藻细胞生长及细胞内营养成分的影响
以BBM培养基为基础培养基,考察五种不同氮源(硝酸钠、硝酸铵、尿素、氯化铵、甘氨酸)对小球藻细胞生长及细胞内营养成分的影响,结果见图2和表2。小球藻在以甘氨酸为氮源时生长最快,其次为硝酸钠和尿素;以甘氨酸和尿素为氮源时培养4d即进入平稳期,但甘氨酸组细胞密度明显大于尿素组;以硝酸钠为氮源时在整个培养周期藻细胞一直处于增长状态;小球藻在以氯化铵和硝酸铵为氮源时生长速度缓慢,在培养4d后微藻藻液变黄,之后藻体结块下沉,检测发现其pH分别为4.3和5.0,这可能是氨态氮的消耗导致培养液pH降低,使得小球藻生长受到抑制。小球藻在不同氮源下的生物量与生长速率基本一致,甘氨酸组生物量明显高于其他组(p<0.05)。小球藻在以甘氨酸为氮源时油脂含量最高,其他氮源下油脂含量无显著性差异(p>0.05);在不同氮源下小球藻蛋白质含量从高到低依次为甘氨酸、硝酸钠、硝酸铵、尿素和氯化铵;以甘氨酸、硝酸铵、尿素和氯化铵为氮源时色素含量基本相同,而硝酸钠组略低于其他组。氮元素是影响微藻生长最为关键的营养因子之一,目前关于氮源对微藻生长影响的相关研究较多,但结论不尽相同。张青田等[14]研究发现硝酸钠对铜绿微囊藻的生长速率明显高于氨氮和尿素;Li[7]及刘平怀等[15]研究不同氮源对微藻的影响,结果表明添加铵态氮的藻液生长状况最差,这与本研究中的结果相同。甘氨酸是一种有机氮源,含碳量及含氮量分别为32.0%和18.6%,可以作为微藻细胞生长的碳源及氮源。本研究发现,小球藻在以甘氨酸为氮源时生长速度最快且各营养成分含量均较其他实验组高,这与相关研究报道[16]结果一致,甘氨酸是最易同化的氨基酸,是某些单细胞藻类的最好氮源,确定甘氨 酸 为小 球藻 Chlorella sorokiniana C74的 最 佳氮源。
2.3 不同氮浓度对小球藻细胞生长及细胞内营养成分的影响
以BBM培养基为基础培养基,考察不同氮源浓度对小球藻细胞生长及细胞内营养成分的影响,结果如图3和表3所示。由图3可以看出,添加甘氨酸后小球藻的生长速率明显高于缺氮条件,但过高浓度甘氨酸会对藻细胞生长有一定抑制。小球藻生物量与细胞生长情况一致,均随着甘氨酸浓度升高先升高后略有降低,当甘氨酸浓度为13.33mmol/L时生物量最高,达3.22g/L,为缺氮组的1.53倍。在实验浓度范围内,甘氨酸对小球藻油脂和蛋白质含量均无影响(p>0.05)。在缺氮情况下藻细胞多糖含量达62.36%,是含甘氨酸组的1.7~2.4倍,油脂、蛋白质和色素含量均低于含甘氨酸实验组,这可能是由于在缺氮环境下,小球藻合成多糖的过程得到促进,油脂、蛋白质、叶绿素的合成受阻并最终导致细胞分裂减缓或停止的结果[17]。综合上述实验结果确定小球藻细胞最适甘氨酸浓度为13.33mmol/L。
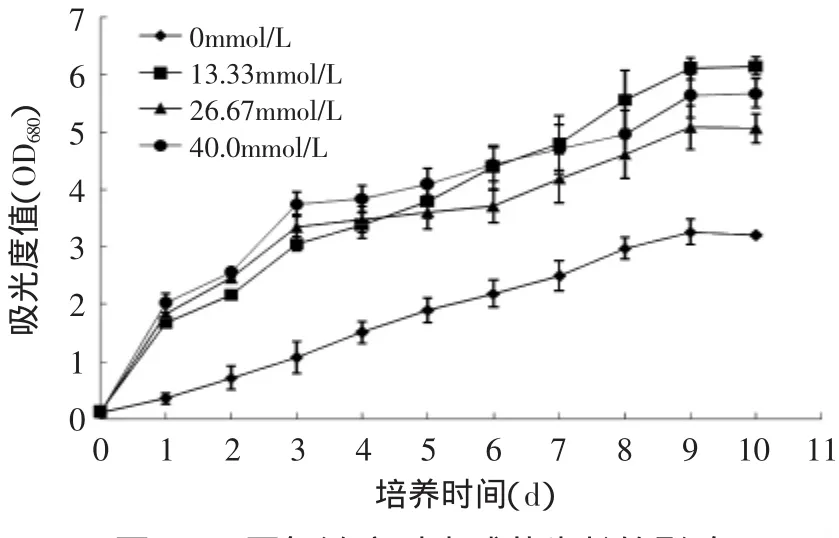
图3 不同氮浓度对小球藻生长的影响Fig.3 Effect of different concentrations of nitrogen on the growth of Chlorella sorokiniana C74
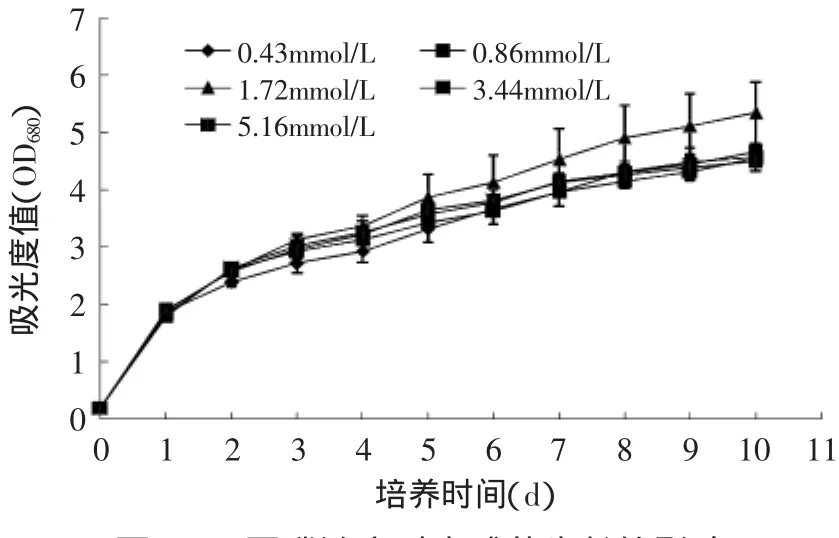
图4 不同磷浓度对小球藻生长的影响Fig.4 Effect of different concentrations of phosphorus on the growth of Chlorella sorokiniana C74

表2 不同氮源下小球藻细胞生物量及细胞主要成分Table 2 Biomass productivities and main ingredients of Chlorella sorokiniana C74 cells in different nitrogen sources
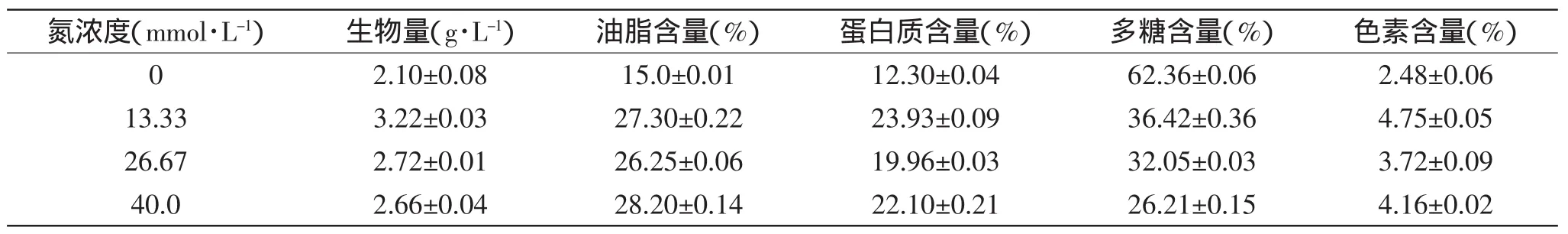
表3 不同氮浓度下小球藻细胞生物量及细胞主要成分Table 3 Biomass productivities and main ingredients of Chlorella sorokiniana C74 cells in different concentrations of nitrogen
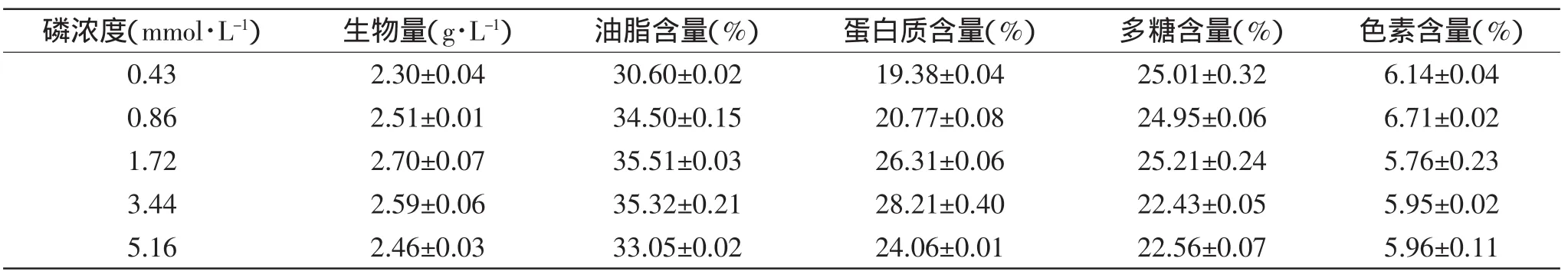
表4 不同磷浓度下小球藻细胞生物量及细胞主要成分Table 4 Biomass productivities and main ingredients of Chlorella sorokiniana C74 cells in different concentrations of phosphorus
2.4 不同磷浓度对小球藻细胞生长及细胞内营养成分的影响
磷是微藻生长的必需元素,参与合成ATP、GTP、核酸、磷脂和辅酶等。磷元素是藻类合成叶绿素所必需的,同时参与碳水化合物的代谢及脂肪酸的转化,不同的藻类对磷的浓度有不同的要求。本实验以BBM培养基为基本培养基,以13.33mmol/L甘氨酸为氮源,考察不同磷浓度对小球藻生长和细胞内营养成分的影响,结果见图4和表4。
由图4可知,磷浓度对小球藻的生长速率影响不明显,当磷浓度为1.72mmol/L时微藻细胞生长速率最快,略高于其他浓度。随着磷浓度的升高,小球藻生物量先升高后降低,在1.72mmol/L时生物量最高,为2.70g/L。不同磷浓度下小球藻细胞多糖和色素含量无明显差异(p>0.05);油脂和蛋白质的含量均随磷浓度的增加先升高后降低。已有研究表明,低磷浓度能够促进藻细胞油脂、叶绿素a及微藻囊毒素的积累[3,18-19]。实验结果显示,小球藻细胞生长最适磷浓度为1.72mmol/L。
3 结论
本实验以小球藻为研究对象,研究了不同培养基、氮源、氮浓度及磷浓度对小球藻细胞生长和细胞内营养成分的影响。实验结果表明,不同培养基对小球藻生长有较大的影响。采用TAP和BBM培养基小球藻生物量最高,采用 BG-11培养基藻细胞多糖含量明显高于其他培养基。以甘氨酸为氮源小球藻生物量和细胞内油脂、蛋白质、多糖、色素含量均为最高。小球藻培养最佳甘氨酸浓度为13.33mmol/L,过高或者过低浓度的甘氨酸均会对藻细胞生长产生影响,在缺氮情况下油脂和蛋白质含量较低,但多糖含量明显高于其他组。磷浓度对小球藻生长及细胞内油脂、蛋白质、多糖和色素含量均无较大影响,随着磷浓度升高,小球藻生物量、油脂和蛋白质含量先增大后降低,多糖和色素含量略有降低,小球藻细胞生长最适磷浓度为1.72mmol/L。
[1]李亚军,费晓雯,邓晓东.氮元素缺乏对微藻氮代谢相关基因表达的影响[J]. 热带农作物学报,2011,32(8):1512-1517.
[2]Bondioli P,Bella LD,Rivolta G,et al.Oil production by the marine microalgae Nannochloropsis sp.F&M-M24 and Tetraselmis suecica F&M-M33[J].Bioresource Technology,2012,114:567-572.
[3]Huang X,Huang Z,Wen W,et al.Effects of nitrogen supplementation of the culture medium on the growth,total lipid content and fatty acid profiles of three microalgae(Tetraselmis subcordiformis,Nannochloropsis oculata and Pavlova viridis)[J]. Journal of Applied Phycology,2013,25(1):129-137.
[4]江怀真,张维,刘天中,等.氮、磷浓度对小球藻生长及油脂积累的影响[J]. 食品工业科技,2011,32(6):204-211.
[5]杨勋,郝宗娣,张森,等.营养元素和pH对若夫小球藻生长和油脂积累的影响[J]. 南方水产科学,2013,9(4):33-38.
[6]Piorreck M,Baasch KH,Pohl P.Biomass production,total protein,chlorophylls,lipids and fatty acids of freshwater green and blue-green algae under different nitrogen regimes[J]. Phytochemistry,1984,23(2):207-216.
[7]Li Y,Horsman M,Wang B,et al.Effects of nitrogen sources on cell growth and lipid accumulation of green alga Neochloris oleoabundans[J].Applied Microbiology and Biotechnology,2008,81(4):629-636.
[8]魏东,张学成,隋正红,等.氮源和N/P对眼点拟微球藻的生长、总脂含量和脂肪酸组成的影响[J]. 海洋科学,2000,24(7):46-51.
[9]Suneerat R.Effect of light,nutrient,cultivation time and salinity on lipid production of newly isolated strain of the green microalgae,Botryococcus braunii KMITL2[J].Bioresource Technology,2012,109:261-265.
[10]Luyen HQ,Cho JY,Shin HW,et al.Microalgal growth enhancement by levoglucosan isolated from the green seaweed Monostroma nitidum[J].Journal of Applied Phycology,2007,19(2):175-180.
[11]汤宁.8种底 栖硅藻生化 成分 的 研 究[D]. 大连:大连 理 工大学,2008.
[12]王俊.杜氏盐藻、青岛大扁藻对营养盐变化的生理生态学响应机制[D]. 浙江:浙江海洋学院,2012.
[13]Wellburn AR.The Spectral Determination of Chlorophylls a and b,as well as Total Carotenoids,Using Various Solvents with Spectrophotometers of Different Resolution[J].Journal of Plant Physiology,1994,14(3):307-313.
[14]张青田,王新华,林超,等.不同氮源对铜绿微囊藻增殖的影响[J]. 水生态学杂志,2011,32(4):115-120.
[15]刘平怀,郝宗娣,杨勋,等.不同氮源对2种微藻生长及总脂含量的影响[J]. 生态环境学报,2012,21(8):1429-1433.
[16]华汝成.单细胞藻类的培养与利用[M].北京:中国农业出版社,1986:22-100.
[17]曾玲,文 菁,徐 春 曼. 氮、磷 对微 藻 生 长和产 毒 的 影响[J].湛江师范学院学报,2011,32(6):103-108.
[18]Levy I,Gantt E .Development of photosynthetic activity in porphyridium purpureum(Rhodophyta) following nitrogen starvation[J].Journal of Phycology,1990,26(1):62-68.
[19]Lewitus AJ, Caron DA .Relative effects of nitrogen or phosphorus and light intensity on the pigmentation ,chemical composition and volume of Pyrenomonas salina(Cryptophyceae)[J].Marine Ecology Progress Series,1990,61(1-2):171-181.
Effect of trophic elements on the cell growth of Chlorella sorokiniana C74
ZHANG Ling,YANG Xun,ZHANG Sen,LUO Ning,LIU Ping-huai*
(College of Materials and Chemical Engineering,Hainan University,Haikou 570228,China)
The cell growth and nutritional components in Chlorella sorokiniana under different culture medium,different nitrogen sources,concentration of nitrogen and concentration of phosphorus was investigated.Results showed that the most adequate culture medium was BBM.There was no significant difference to the content of lipid,protein and pigment under different culture medium,the highest content of polysaccharose was 44.46%in the BG-11 medium.The best nitrogen source was glycine,with which the biomass,content of lipid,protein and polysaccharose were higher than other nitrogen sources.The optimum concentration of nitrogen source was 13.33mmol/L.Without any nitrogen sources,the biomass,content of lipid,protein,and pigment were least,but the polysaccharose content was highest,which was 2 folds of other groups.The optimum concentration of phosphorus was 1.72mmol/L.With increasing concentration of phosphorus , the biomass , lipid and protein content of Chlorella sorokiniana were increasing at first and then decreasing,and polysaccharides and pigment content were decreasing slightly.
Chlorella sorokiniana;cell growth;culture medium;nitrogen sources;phosphorus
TS201.1
A
1002-0306(2014)20-0208-05
10.13386/j.issn1002-0306.2014.20.037
2014-01-14
张玲(1989-),女,硕士研究生,主要从事微藻生物活性物质方面的研究。
* 通讯作者:刘平怀(1967-),男,教授,主要从事微藻生物质资源方面的研究。
国家科技支撑计划项目课题(2011BAD14B01);海南省中药现代化科技专项(ZY201327);国家科技型中小企业技术创新基金(13C26244604892)。
