VEGF经PI3K-Akt-Bad通路降低冻存后EOCs凋亡率
2014-03-03郦铮铮林以诺郭宴会
郦铮铮,林以诺,郭宴会
(温州医科大学附属第一医院,浙江 温州 325015,1.神经内科;2.心内科)
·论 著·
VEGF经PI3K-Akt-Bad通路降低冻存后EOCs凋亡率
郦铮铮1,林以诺2,郭宴会2
(温州医科大学附属第一医院,浙江 温州 325015,1.神经内科;2.心内科)
目的:探讨血管内皮生长因子(VEGF)对低温冻存内皮生长晕细胞(EOCs)凋亡率的影响及其与PI3K-Akt-Bad信号通路的关系,研究VEGF降低低温冻存EOCs凋亡率的可能机制。方法:采用密度梯度离心法分离人脐带血中的单个核细胞,经体外扩增培养EOCs,用免疫细胞化学染色及荧光染色法鉴定细胞的内皮特性。以扩增后的第二代细胞为生物材料,将其分为W组(wortmannin干预24 h后冻存)、W+V组(wortmannin干预24 h后+50μg/L VEGF冻存)、BC组(空白对照组)、V组(50μg/L VEGF冻存),于-80 ℃冻存24 h后复苏。用流式细胞术检测EOCs凋亡率,Western blot法检测p-Akt、Bad、Caspase 3的表达量。结果:采用体外扩增培养的EOCs具有多种内皮细胞特性。低温冻存会增加EOCs的凋亡率(为5.36%±0.27%),但50μg/L VEGF能够降低低温冻存和复苏过程EOCs的凋亡率(为3.36%±0.27%,P<0.05);经wortmannin对PI3K特异性抑制后,VEGF对EOCs的保护作用减弱,细胞的凋亡率增加(为8.34%±0.57%,P<0.05);加50μg/L VEGF的EOCs冻存细胞p-Akt表达升高而Bad和Caspase 3表达降低(均P<0.05),经wortmannin干预24 h后的EOCs冻存细胞p-Akt表达降低而Bad和Caspase 3表达升高(均P<0.05)。结论:50μg/L VEGF能够降低低温冻存EOCs的凋亡率,其作用可能通过PI3K-Akt-Bad信号通路来实现。
血管内皮生长因子;内皮生长晕细胞;冻存;凋亡;信号通路
内皮祖细胞(endothelial progenitor cells,EPCs)是能够分化为血管内皮细胞的前体细胞。目前研究证明人体内至少存在两种类型的内皮前体细胞,分别为早期EPCs及晚期EPCs,后者又称为内皮生长晕细胞(endothelial outgrowth cells,EOCs)。它们不仅参与胚胎血管生成,还参与出生后血管新生过程,具有修复血管内皮和促进缺血组织血管新生的作用[1-2]。随着内皮前体细胞与冠心病相关性研究的深入,以及TOPCARE-AMI试验[3-4]和COMPARE-AMI试验[5]对其长期安全性和可行性的证实,以内皮前体细胞为基础的治疗越来越扩宽着临床医师治疗冠心病的思维,并可能成为冠心病干细胞移植治疗心肌损伤的新兴手段。
体外培养、冻存、适时复苏EOCs能够解决其数量低、培养周期长、不能及时有效进行细胞移植等难题。尽管Lin等[6]已经成功从冻存的人类脐带血中分离培养出内皮前体细胞,但对脐带血的冻存会导致脐带血细胞的大量凋亡并降低内皮前体细胞的分化能力,且集落形成率也相应降低[7-8]。但是,对已分离培养的EOCs直接冻存也可能会导致细胞凋亡率增加,使EOCs的复苏成功率降低。血管内皮生长因子(vascular endothelium growth factor,VEGF)是血管内皮细胞特异性促有丝分裂原,能够高效、特异地促进血管EPCs的分裂、分化和增殖,增加血管通透性,有利于新生血管的形成[9]。因此VEGF也许可以对低温冻存的EOCs起到保护作用。PI3K/Akt信号通路是目前已知重要的抗凋亡通路,本研究主要观察VEGF能否提高冻存EOCs的存活率,以及对PI3K-Akt-Bad信号通路起到的作用。
1 材料和方法
1.1 材料 D-Hank’s液、PBS、0.05%的胰酶、胎牛血清(fetal bovine serum,FBS)购自Gibico公司,EGM-2培养基购自Lonza公司,人纤维连接蛋白(human fibronectin,HFN)购自Chemicon公司,重组人VEGF165购自Reprotech公司,ABC免疫组织化学试剂盒和AEC染色试剂盒购自华美生物工程公司,Annexin V-碘化丙啶(propidium iodide,PI)凋亡试剂盒及FITC标记荆豆凝集素I(FITC-UEA-I)购自Sigma公司,Dil标记的乙酰化LDL(DiL-ac-LDL)购自invitrogen公司,小鼠抗FLK-1单克隆抗体(monoclonal antibody,mAb)、兔抗CD34抗体及兔抗VIII抗体购自Santa Cruz公司,兔抗p-Akt、 Bad、Caspase 3多克隆抗体(polyclonal antibody,pcAb)购自Cell Signaling Technology公司,wortmannin购自Cayman Chemical公司。
1.2 方法
1.2.1 细胞分离培养:自2012年1月至2012年9月期间收集弃用的新鲜健康脐带血共8例(血标本来自本市某三甲医院产科,30~40 mL),每位产妇均在分娩前签署知情同意书。采用梯度离心法分离血中的单个核细胞并重悬于5 mL含10% FBS的EGM-2培养液中,均匀接种在预先包被有HFN的25 mL培养瓶中,置37 ℃细胞培养箱中24 h后吸弃全部培养液,用PBS液轻柔吹洗未贴壁细胞并更换5 mL EBM-2新鲜培养液,此后7 d内每24 h更换半液,7 d后每72 h更换全液,并观察细胞生长情况,待细胞生长至80%后进行下一步操作。
1.2.2 细胞免疫组织化学染色法:第一代细胞消化后接种至盖玻片上,培养至贴壁,采用4%的多聚甲醛固定20 min,0.3% H2O2-甲醛液封闭内源性过氧化物酶10 min,PBS冲洗后分别加1∶100稀释的小鼠抗FLK-1抗体、兔抗VIII因子相关抗原抗体及兔抗CD34抗体,于4 ℃下孵育过夜,二抗结合参照ABC免疫组织化学检测试剂盒说明书进行,之后用AEC染色试剂染色,苏木素复染,于100倍倒置相差显微镜下观察染色结果[10]。采用T/G人血管平滑肌细胞株作为阴性对照。
1.2.3 细胞荧光染色法:第一代细胞消化后接种至盖玻片上,培养至贴壁,在上述细胞中加入DiI-ac-LDL(10 mg/L)37 ℃孵育4 h,4%多聚甲醛溶液固定10 min,PBS浸洗后将FITC-UEA-I(10 mg/L)加于上述标本37 ℃孵育l h。采用荧光显微镜观察染色结果,DiI-ac-LDL和FlTC-UEA-I双染色阳性细胞为正在分化的EPCs[10]。
1.2.4 实验分组与细胞冻存:第一代EOCs经0.05%胰蛋白酶消化收集后分成4组:①W组:经1μmol/ L wortmannin干预24 h后冻存;②W+V组:经1 μmol/L wortmannin干预24 h后,再与含50μg/L VEGF的冻存液共同冻存;③BC组:直接冻存,空白对照;④V组:不经wortmannin干预,与含50μg/L VEGF的冻存液在-80 ℃低温共同冻存24 h。冻存液以DMSO∶FBS∶EGM-2按照1∶2∶7的比例配成并预冷至4 ℃,上述各组细胞采用1 mL冻存液(含或不含50μg/L VEGF)重悬于冻存管中,置于4 ℃冻存4 h,-20 ℃冻存1 h,然后转入-80 ℃冻存24 h。
1.2.5 流式细胞仪检测凋亡率:各组细胞从-80 ℃冻存环境中取出后迅速置入37 ℃水浴箱中,待液体溶解后转入9 mL含10% FBS的EGM-2培养液中,100 g离心力低速离心10 min,吸弃上清液后加入4 ℃预冷的PBS液5 mL洗涤一次,用100μL 1×Annexin-Blinding buffer重悬,然后每管加入Annexin V 5μL和100μg/mL PI 1μL,室温下避光孵育15 min,加入400μL 1×Annexin-Binding buffer轻柔混匀,经流式细胞仪检测。
1.2.6 Western blot法测定p-Akt、Bad、Caspase 3:冻存细胞复苏后裂解并提取总蛋白,BCA法测定各组蛋白浓度。各组上样30μg,行15% SDS-PAGE电泳、转膜,5%脱脂牛奶室温下封闭2 h后与抗p-Akt pcAb、抗Bad pcAb和抗Caspase 3 pcAb混合液4 ℃孵育过夜,TBS-T溶液洗膜3次。室温下加入IgG抗体(1∶4 000)孵育1.5 h,洗膜3次,用Odyssey近红外双色激光成像系统选择800通道进行条带扫描,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参照标化p-Akt、Bad、Caspase 3蛋白质表达,用AlphaEaseFC凝胶成像分析软件进行半定量分析。
1.3 统计学处理方法 采用SPSS 18.0软件完成统计学分析。计量资料以表示,多组间均数比较采用单因素方差分析,独立的2组间比较用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 EOCs的培养及鉴定 单个核细胞在培养第6~第9天可出现单个体积较大的EOC,见图1a;此后细胞迅速增多形成集落,第11天细胞生长逐渐融合,见图1b;第14天形成大型集落,见图1c。培养的EOCs表面CD34、Flk-1、VIII因子相关抗原表达均为阳性,提示细胞有干细胞和内皮细胞特性,见图2。所有细胞均能够摄取DiI-ac-LDL(红色荧光)并结合FITC-UEA-I(绿色荧光),双荧光染色阳性提示细胞正在分化,见图3。
2.2 各组EOCs冻存后凋亡率的差异 -80 ℃低温冻存24 h复苏后BC组细胞凋亡率为5.36%±0.27%;

图1 EOCs的生长过程(×100)

图2 EOCs的免疫组织化学染色(×100)

图3 EOCs的双荧光染色(×800)

图4 流式细胞仪检测冻存EOCs复苏后早期凋亡率
2.3 Western blot法测定p-Akt、Bad、Caspase 3表达 V组与BC组、W组及W+V组相比,p-Akt表达量有升高,而Bad及Caspase 3的表达量降低,差异均有统计学意义(P<0.05);W组、W+V组较BC组和V组的p-Akt的表达量降低,而Bad、Caspase 3表达量均有不同程度升高,差异有统计学意义(P< 0.05);W组Caspase 3表达水平高于W+V组,差异有统计学意义(P<0.05),见图5和表1。 V组细胞凋亡率为3.36%±0.27%,与BC组比较差异有统计学意义(P<0.05);W+V组细胞凋亡率为8.34%±0.57%,与W组比较差异有统计学意义(P<0.05);W组细胞凋亡率为12.12%±0.71%,与BC组比较差异有统计学意义(P<0.05),见图4。
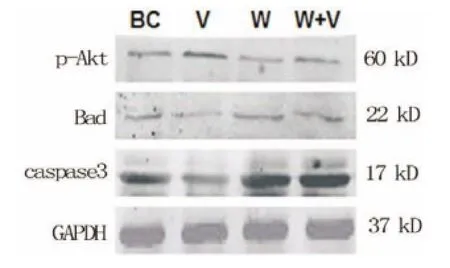
图5 Western Blot法检测p-Akt、Bad、Caspase 3蛋白表达水平
表1 各组细胞p-Akt、Bad及Caspase 3经GAPDH校正后的灰度值(±s)
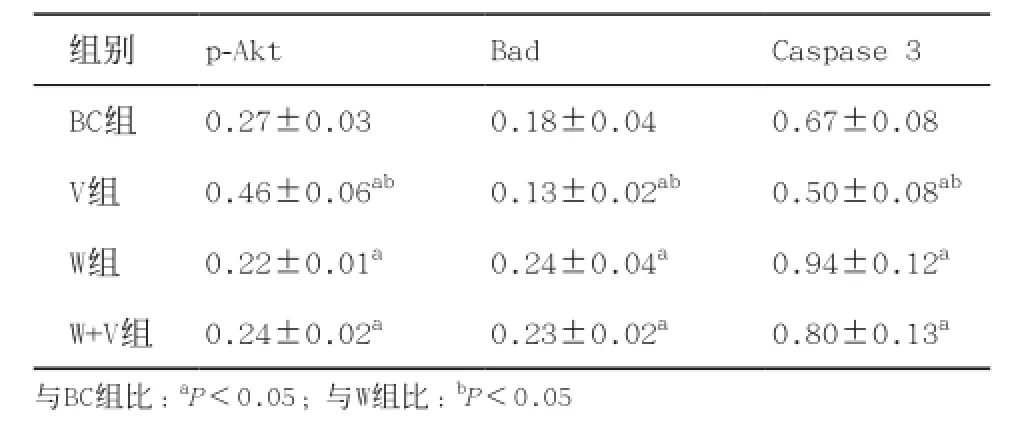
表1 各组细胞p-Akt、Bad及Caspase 3经GAPDH校正后的灰度值(±s)
组别p-AktBadCaspase 3 BC组0.27±0.030.18±0.040.67±0.08 V组0.46±0.06ab0.13±0.02ab0.50±0.08abW组0.22±0.01a0.24±0.04a0.94±0.12aW+V组0.24±0.02a0.23±0.02a0.80±0.13a与BC组比:aP<0.05;与W组比:bP<0.05
3 讨论
内皮功能不完全贯穿于冠心病的发生、发展过程,内皮前体细胞在维持内皮功能的完整性方面发挥重要作用。早期EPC表达内皮细胞和造血干细胞标志,维持造血分化潜能和功能,通过自分泌或旁分泌VEGF、SDF-1、IL-8等细胞因子,促进损伤血管内皮和缺血组织的内皮修复和血管生长[11]。当将其注入缺血组织如视网膜后可迅速形成毛细血管网,而早期EPCs不具备这种功能[12]。一些小规模的骨髓单个核细胞移植治疗心肌梗死、周围肢体缺血、严重的冠心病以及心力衰竭的I期临床试验为内皮祖细胞移植疗法提供了可行性和安全性的初步依据[3-5]。
EOCs分离培养周期较长,不利于及时进行细胞移植治疗。因此直接分离培养的EOCs能否有效地冻存和完好地复苏成为其在临床应用中的一个关键问题。在研究中观察到冻存的EOCs基础凋亡水平为5.36%±0.27%,证实冻存不可避免地会对细胞造成一定程度的伤害[7],因此需要寻找一种保护细胞抵抗低温冻存伤害的介质。VEGF是血管内皮细胞特异性促有丝分裂原,能够高效特异地促进血管EPCs的分裂、分化和增殖,还可抑制EPCs的凋亡[9]。本研究中可以观察到50μg/L VEGF能使冻存的EOCs凋亡水平降低到3.36%±0.27%,因而它可能会成为一种较为理想的EOCs冻存保护介质。
PI3K-Akt信号通路是介导细胞存活的重要通路,依赖于血管内皮生长因子受体2(vascular endothelium growth factor receptor-2,VEGFR2)及其随后激活的PI3K,活化的PI3K在细胞附近催化PIP2生成PIP3,随后磷酸化激活蛋白激酶Akt,再磷酸化Bcl-2相关凋亡启动子(Bad)和半胱氨酸天冬氨酸蛋白酶9(Caspase 9),抑制它们的活性使细胞存活[12]。
进一步研究发现与VEGF共同冻存后的EOCs其p-Akt表达升高,Bad及Caspase 3活性片段表达均降低。通过wotmannin特异性抑制PI3K-Akt通路后,wortmannin干预组早期凋亡率较未干预组升高,与之对应的p-Akt表达降低,Bad及Caspase 3活性片段表达升高,由此我们推断VEGF降低低温冻存EOCs的凋亡率与PI3K-Akt-Bad通路有关[13]。本研究还发现,同时接受wortmannin干预的2组中,p-Akt及Bad表达差异无统计学意义,Caspase 3表达在W组中高于W+V组,提示VEGF对经wortmannin干预后冻存的EOCs仍具有一定的保护作用,其结果暗示除PI3KPKB/Akt-Bad信号通路外,VEGF也许还经其他信号通路起到抗凋亡的作用,如参与调控多种细胞凋亡的p38MAPK通路、钙调神经磷酸酶通路等[14-15]。
[1] Krenning G, van-Luyn MJ, Harmsen MC. Endothelial progenitor cell-based neovacularization: implications for therapy[J]. Trends Mol Med, 2009, 15(4): 180-189.
[2] Bonello L, Basire A, Sabatier F, et al. Endothelial injury induced by cornary angioplasty triggers mobilization of endothelial progenitor cells in patients with stable coronary artery disease[J]. J Thromb Heamost, 2006, 4(5): 979-981.
[3] Kajstura J, Urbanek K, Perl S, et al. Cardiomyogenesis in the adult human heart[J]. Circ Res, 2010, 107(2): 305-315.
[4] Schächinger V, Assmus B, Britten MB, et al. Transplantation of progenitor cells and regeneration enchancement in acute myocardial infarction: final one year results of the TOPCARE-AMI trial[J]. J Am Coll Cardiol, 2004, 44(8): 1690-1699.
[5] Mansour S, Roy DC, Bouchard V, et al. COMPARE-AMI trial: comparison of intracoronary injection of CD133+ bone marrow stem cell to placebo in patients after acute myocardial infarction and left ventricular dysfunction: study rationale and design[J]. J Cardiovasc Transl Res, 2010, 3(2): 153-159.
[6] Lin RZ, Dreyzin A, Aamodt K, et al. Functional endothelial progenitor cells from cryopreserved umbilical cord blood[J]. Cell Transplant, 2011, 20(4): 515-522.
[7] Lu X, Proctor SJ, Dickinson AM. The effect of cryopreservation on umbilical cord blood endothelial progenitor cell differentiation[J]. Cell Transplant, 2008, 17(12): 1423-1428.
[8] Vanneaux V, El-Ayoubi F, Delmau C, et al. In vitro and in vivo analysis of endothelial progenitor cells from cryopreserved umbilical cord blood: are we ready for clinical application[J]. Cell Transplant, 2010, 19(9): 1143-1155.
[9] Giacca M, Zacchigna S. VEGF gene therapy: therapeutic angiogenesis in the clinic and beyond[J]. Gene Ther, 2012, 19(6): 622-629.
[10] 林以诺, 吴高俊, 张怀勤, 等. 川芎嗪对冻存内皮生长晕细胞的影响[J]. 温州医学院学报, 2013, 43(6): 363-366.
[11] Pula G, Mayr U, Evans C, et al. Proteomics identifes thymidine phosphorylase as a key regulator of the angiogenic potential of colony-forming units and endothelial progenitor cell cultures[J]. Circ Res, 2009, 104(1): 32-40.
[12] Hill KM, Kalifa S, Das JR, et al. The role of PI3-Kinase p110beta in AKT signally, cell survival, and proliferation in human prostate cancer cell[J]. Prostate, 2010, 70(7): 755-764.
[13] Ayral-Kaloustian S, Gu J, Lucas J, et al. Hybrid inhibitors of phosphatidylinositol 3-kinase (PI3K) and the mammalian target of rapamycin (mTOR): design, synthesis, and superior antitumor activity of novel wortmannin-rapamycin conjugates[J]. J Med Chem, 2010, 53(1): 452-459.
[14] Kim MK, Park HJ, Kim YD, et al. Hinokitiol increases the angiogenic potential of dental pulp cells through ERK and p38MAPK activation and hypoxia-inducible factor-1α (HIF-1α) upregulation[J]. Arch Oral Biol, 2014, 59(2): 102-110.
[15] Leidi M, Mariotti M, Maier JA. EDF-1 contributes to the regulation of nitric oxide release in VEGF-treated human endothelial cells[J]. Eur J Cell Biol, 2010, 89(9): 654-660.
(本文编辑:吴彬)
Objective:To investigate the impact of vascular endothelial growth factor (VEGF) on the apoptosis rate in cryopreservation endothelial outgrowth cells (EOCs), as well as the relationship between VEGF and the PI3K-Akt-Bad signaling pathway, to research the mechanism of VEGF reducing the apoptosis rate in cryopreservation EOCs.Methods:The mononuclear cells were harvested from umbilical cord blood, induced into EOCs and expanded in vitro. The endothelial characteristics of the EOCs were identifed by immunocytochemical staining and fuorescence staining. The second generation of EOCs were devided into group W (cryoperserved after wortmannin intervention for 24 hours), group W+V (cryopreserved with 50 μg/L VEGF after wortmannin intervention for 24 hours), group BC (control group), and group V (cryopreserved with 50 μg/L VEGF). All these groups were resuscitated after being cryopreservated at -80 ℃ for 24 hours. Subsequently, apoptosis rates were detected by fow cytometry, and the expressions of p-Akt, Bad, and Caspase 3 were measured using Western-blot test.Results:The cells cultured by adherent method showed multiple endothelial characteristics. Although cryopreservation increased the apoptosis rate of EOC (5.36%±0.27%), VEGF protected cells from deep hypothermia and thus reduced the apoptosis rate of recovery cells (3.36%±0.27%, P<0.05). Inhibition of PI3K by wortmannin decreased the protection of VEGF on the EOCs and increased the cellular apoptosis rate (8.34%±0.57%, P<0.05). Western-blot test showed elevation of p-Akt expressions and decline of Bad and Caspase 3 expressions in EOCs cryopreserved with VEGF (P<0.05). Under the PI3K inhibition by wortmannin, the expression of p-Akt was down-regulated while expressions of Bad and Caspase 3 were up-regulated (P<0.05). Conclusion: VEGF decreases the apoptosis rate of cryopreserved EOCs partly via PI3K-Akt-Bad signal pathway.
vascular endothelium growth factor; endothelial outgrowth cells; cryopreservation; apoptosis; signaling pathway
R329.2
A
1000-2138(2014)12-0882-05
2014-07-10
温州市科技局科研基金资助项目(Y20110032)。
郦铮铮(1982-),女,浙江台州人,住院医师,医学硕士。
VEGF decreases the apoptosis rate of cryopreserved EOCs via PI3K-Akt-Bad signaling pathway
LI Zhengzheng1, LIN Yinuo2, GUO Yanhui2. 1.Department of Neurology, the First Affliated Hospital of Wenzhou Medical University Wenzhou, 325015; 2.Department of Cardiology, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015
