脑梗死后出血转化的危险因素分析
2014-03-03兰清莲周成业王小同
兰清莲,周成业,王小同
(1.温州医科大学附属第一医院 神经内一科,浙江 温州 325015;2.温州医科大学附属第二医院神经内科,浙江 温州 325027)
·论 著·
脑梗死后出血转化的危险因素分析
兰清莲1,周成业1,王小同2
(1.温州医科大学附属第一医院 神经内一科,浙江 温州 325015;2.温州医科大学附属第二医院神经内科,浙江 温州 325027)
目的:探讨心源性脑梗死(CE)及大动脉粥样硬化性脑梗死(LAA)出血转化(HT)的相关危险因素。方法:回顾性分析2009年1月至2012年12月急性前循环脑梗死患者560例(其中CE组186例,LAA组374例),按是否发生HT分为HT亚组和非HT亚组。收集患者既往高血压病史、糖尿病病史及心房颤动病史,入院24 h内的血压、空腹血糖(FBG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、影像学检测到的梗死面积,入院后的抗凝、抗血小板及他汀类药物治疗情况。首先进行单因素分析,对差异有统计学意义的指标进行多因素Logistic回归分析,分别得出两种类型脑梗死HT的危险因素。结果:LAA组与CE组患者间HT的发生率差异有统计学意义(P=0.005,OR=1.946,95%CI:1.224~3.093)。多因素Logistic回归分析显示,在LAA组,他汀类药物治疗(OR=0.212,95%CI:0.067~0.672)、抗血小板治疗(OR=0.170,95%CI:0.074~0.388)及美国国立卫生院神经功能缺损评分(NIHSS)评分(OR=1.088,95%CI:1.02~1.16)与HT显著相关,而在CE组,FBG(OR=2.168,95%CI:1.131~4.155)和抗血小板治疗(OR=2.224,95%CI:1.142~4.330)为HT的独立危险因素。结论:CE患者较LAA患者HT发生率高。抗血小板治疗及他汀类药物治疗为LAA患者HT的保护因素,入院时NIHSS评分与LAA患者HT相关,而FBG高及抗血小板治疗为CE患者HT的危险因素。
脑梗死;出血转化;危险因素
脑梗死出血转化(hemorrhagic transformation,HT)是指在急性脑梗死后由于缺血区血流再灌注导致的梗死区域内继发性出血,是脑梗死的自然转归之一,也可发生于溶栓、抗凝等治疗之后,其主要发生机制为血脑屏障破坏及再灌注损伤[1-2]。根据欧洲急性卒中合作组(ECASS)的CT分型标准,可分为出血性脑梗死及脑实质血肿,多数为无症状性HT。多项研究表明HT尤其是脑实质血肿可增加脑梗死患者的致残率和致死率[3-5]。近年来溶栓治疗已成为急性脑梗死最有效的治疗方法,但溶栓会增加HT的发生率,并且梗死面积、血糖水平、年龄、降低低密度脂蛋白胆固醇(LDL-C)水平等与溶栓后HT的发生密切相关。但是绝大多数患者就诊时已错过溶栓时间窗,因此对非溶栓患者HT相关危险因素进行研究,以早期发现及预防HT,对临床治疗有重要的意义。
1 对象和方法
1.1 对象及分组 收集2009年1月至2012年12月于本院神经内一科住院的急性前循环脑梗死患者共560例,根据类肝素药物治疗急性缺血性脑卒中试验亚型分类标准(TOAST)中大动脉粥样硬化型脑梗死(large artery atherothrombosis,LAA)和心源性脑梗死(cardioembolism,CE)的诊断标准及是否发生HT将患者分为4个亚组。其中CE组186例,HT亚组55例,非HT亚组131例,HT发生率为29.6%,平均年龄(66±10)岁;LAA组374例,HT亚组51例,非HT亚组323例,HT发生率为13.6%,平均年龄(67± 9)岁。
1.2 纳入及排除标准 纳入标准:年龄≥18岁;所有病例均符合全国第四届脑血管会议制定的脑梗死诊断标准,并且发病72 h内经头颅CT或者MRI证实;2周内或症状变化时复查头颅CT/MRI;首次CT/ MRI未发现出血征象者。
排除标准:入院时发病时间超过72 h者;既往有脑梗死或者脑出血病史者或其他疾病导致神经功能缺损者;腔隙性脑梗死、原因不明的脑梗死患者;有临床症状但影像学无脑梗死征象者;未复查影像者;合并其他出血性疾病者;严重肝肾功能不全者;静脉溶栓治疗者。
1.3 观察指标 包括以下几项:①一般情况及既往病史:年龄(定义年龄>75岁为危险因素)、高血压病史、糖尿病病史、心房颤动史。②入院时的临床资料:入院24 h内血压值(定义收缩压>180 mmHg或舒张压>110 mmHg为危险因素)、空腹血糖(FBG,>6.1 mmol/L为危险因素)、血总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、梗死面积(梗死灶直径>5 cm为危险因素)、入院时美国国立卫生院神经功能缺损评分(NIHSS)评分。③入院后治疗情况:抗凝治疗(入院后使用华法林片或低分子肝素治疗至少5 d),抗血小板治疗(单独使用阿司匹林或氯吡格雷,或两者联用),他汀类药物治疗(脑梗死前后使用瑞舒伐他汀钙或阿托伐他汀钙)。
1.4 统计学处理方法 采用SPSS 17.0统计软件。先采用单因素分析,计量资料采用独立样本t检验,计数变量采用卡方检验。定义P<0.10时考虑与HT有关,进入多因素Logistic回归分析。P<0.05为差异有统计学意义。
2 结果
参与单因素分析的因素共有12项,包括:年龄、高血压病史、糖尿病病史、入院24 h血压值、入院时NIHSS评分、梗死面积、TC、LDL-C、FBG以及入院后抗凝、抗血小板聚集、他汀类药物治疗。单因素分析显示,LAA患者高血压病史、梗死面积、NIHSS评分、抗凝、抗血小板及他汀类药物治疗在HT和非HT亚组间差异有统计学意义,纳入多因素Logistic回归方程,结果显示:他汀类药物治疗、抗血小板治疗及NIHSS评分差异有统计学意义(P<0.05)。CE患者中单因素分析结果差异有统计学意义的指标包括:高血压病史、抗凝治疗、抗血小板治疗、梗死面积及FBG水平,纳入多因素Logistic回归分析,结果显示FBG水平及抗血小板治疗可能与HT相关。详见表1-2。
3 讨论
3.1 梗死面积与HT 在溶栓及非溶栓患者中,大面积脑梗死一直以来都被认为是HT的独立危险因素。大面积脑梗死患者,梗死区域脑细胞水肿压迫周围小血管,使血管内皮细胞缺血缺氧,血管的连续性和稳定性遭到破坏,水肿消退后,血流再灌注,血细胞通过损伤的血管内皮外溢,导致梗死区域周边渗血[6]。本研究中大面积脑梗死患者184例,其中HT 55例,发生率为29.9%,非大面积脑梗死患者376例,其中HT 51例,发生率为13.6%,多因素分析显示两者间差异具有统计学意义(P=0.005,OR=1.946,95%CI=1.224~3.093)。与以往多项研究[7-9]结果一致。进一步分型后,单因素分析提示大面积与LAA组及CE组患者HT均相关,而多因素分析则无明显差异,可能与本研究中大面积脑梗死患者急性期未使用抗栓抗凝药物有关。
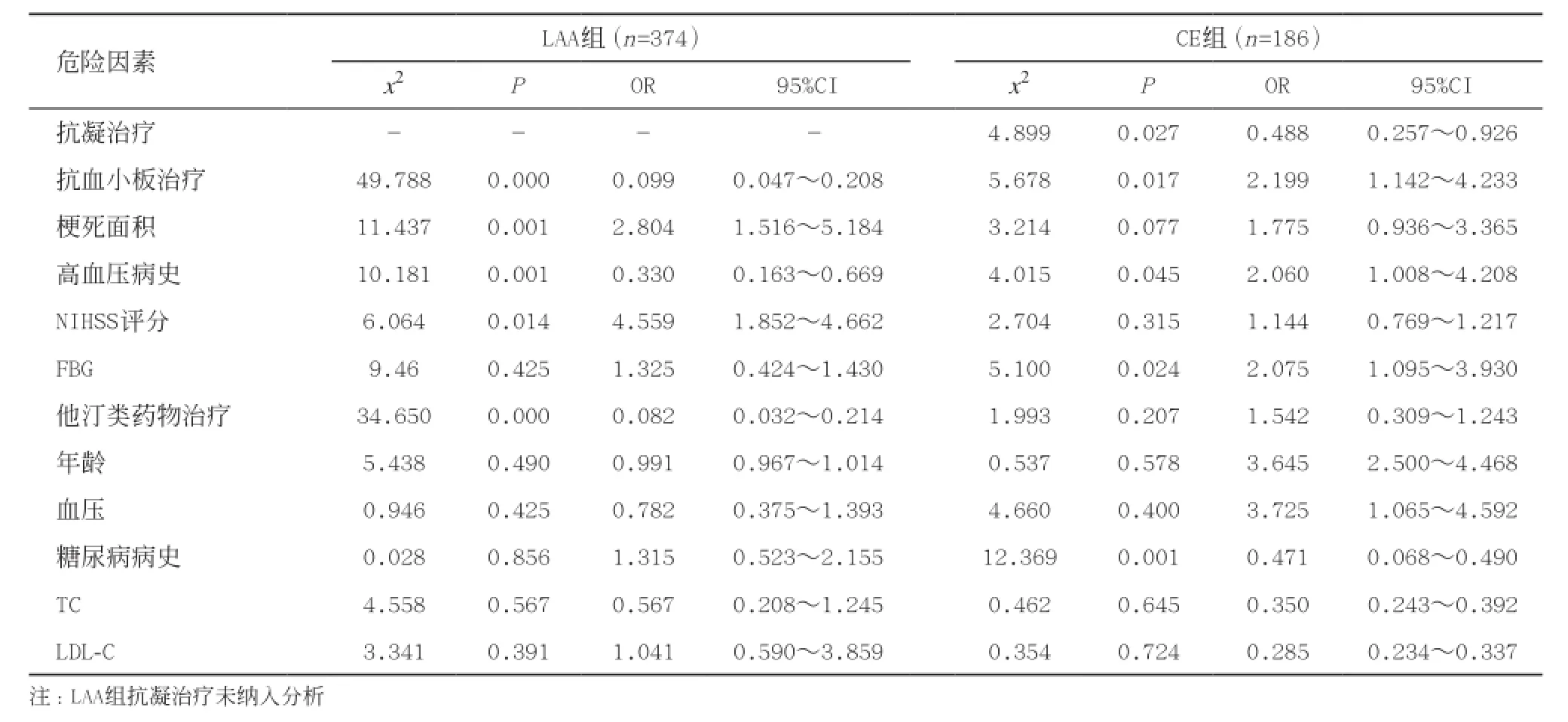
表1 单因素分析结果

表2 多因素Logistic回归分析结果
3.2 心房颤动、心源性栓塞与HT 研究[10-11]表明,在TOAST分型中,CE患者HT发生率最高,小动脉闭塞型脑梗死患者HT发生率最低。本研究共纳入CE患者186例,其中包括卵圆孔未闭1例,心尖附壁血栓1例,病态窦房结综合征1例,合并心房颤动者183例,HT发生率为29.5%;大动脉粥样硬化型患者共374例,HT发生率为13.6%,两者差异具有统计学意义(x2= 21.804,P=0.000,OR=2.728,95%CI:1.774~4.196)。其原因有以下几个方面:心脏来源的栓子稳定性相对较差,更容易发生碎裂、移动,发生栓塞时,栓塞处血管痉挛以及远端血管血流中断,血管壁因缺血缺氧及有害递质堆积而损伤,栓子裂解、移动后,血液通过已损伤的血管时发生渗漏性出血,导致梗死区域内出血[12];此外心源性栓子多阻塞血管近端,梗死面积通常较大,而大面积本身即为HT的危险因素之一。
3.3 他汀类药物治疗与HT 高胆固醇一直被认为是脑梗死尤其是LAA发生的一个主要危险因素。近年来随着胆固醇与脑梗死关系逐步清晰,他汀类药物治疗越来越受到临床医师的重视,2008年美国心脏协会更是将LDL-C降幅>50%或者目标LDL-C<70 mg/dL写入AHA/ASA卒中防治指南[13-14]。但是他汀类药物治疗与HT的关系,目前尚有争议。SPARCL研究[15]得出他汀类药物治疗可降低卒中再发风险及心血管事件的发生率,但同时也得出降低LDL-C水平会增加脑梗死患者HT的发生风险。Hackam等[16]通过一项Meta分析得出他汀类药物治疗并不会增加脑梗死患者的HT。另一项Meta分析也得出脑梗死患者急性期即开始使用他汀类药物治疗可改善患者预后[17]。本研究结果显示,他汀类药物治疗可降低LAA组患者HT的发生率(P=0.008,OR=0.212,95%CI:0.067~0.672)。他汀类药物是一种3-羟基-3-甲基戊二酸单酰辅酶A(HMG-CoA)还原酶抑制剂,除降低血脂水平、稳定动脉粥样硬化斑块外,还通过多种不同机制发挥防治卒中的作用。首先他汀类药物可通过抑制炎症因子产生,减轻缺血区域炎症反应,同时还可降低金属基质蛋白酶活性,维持血脑屏障的完整性;其次,他汀类药物可减少氧自由基生成,提高内皮型一氧化氮及血管内皮生长因子的活性,减轻血管内皮细胞的氧化损伤的同时促进修复血管内皮细胞功能,维持血管结构和功能的完整性[18-19]。目前他汀类药物治疗LAA患者降低HT发生率的机制尚不明确。
3.4 FBG与HT 多因素分析结果显示,FBG升高(>6.1 mmol/L)而非糖尿病病史是CE患者HT的独立危险因素。有研究指出,在所有类型的急性脑梗死患者中,约2/3的患者会出现血糖升高,并且其中多数患者并无糖尿病病史[20]。持续高血糖加强梗死区域及缺血半暗带细胞无氧代谢,使乳酸及自由基生成增加,进一步加重血脑屏障损伤,促进HT发生[21]。动物实验模型也证实,高血糖会加重脑水肿及血管周围细胞死亡[22],而急性期使用胰岛素将血糖控制在正常水平可减轻大鼠脑梗死区域组织损伤[23]。但在本研究中,FBG仅与CE患者HT有关,而在LAA患者中差异无统计学意义。考虑原因可能有以下几点:LAA组患者中合并糖尿病患者相对较多,基础血糖水平偏高,脑细胞对轻中度升高的血糖水平耐受性相对较好;其次,糖尿病患者脑梗死急性期多主张使用胰岛素降糖治疗,从而将血糖控制在一个相对正常的水平。因此对于脑梗死患者急性期控制血糖是否可减少HT的发生,可进一步完善前瞻性临床研究。
3.5 其他 本研究还提示抗血小板治疗可减少LAA组患者HT的发生率(OR=0.170,95%CI:0.074~0.388),但同时可能增加CE组HT的发生率(OR=2.224,95%CI:1.142~4.330)。该结果可能与两种类型脑梗死的发病机制有关,LAA患者基础病因是动脉粥样硬化,而血小板聚集参与其中,因此抗血小板聚集治疗有一定抑制血栓形成的效果,而CE患者主要是血流异常导致瓣膜或者心脏附壁血栓脱落,首选抗凝治疗,但是临床上考虑到出血风险高及患者基础情况差,部分患者不愿意行抗凝治疗而选择抗血小板治疗,因此本研究中抗血小板治疗为HT的危险因素这一结果有待于进一步研究明确。此外CE组患者HT发生率本就较LAA组患者高,影响分析结果。多因素分析还显示,NIHSS评分与LAA患者HT相关。既往多数研究结果中,HT的发生与病情的严重程度密切相关,而在缺乏影像学证据时,NIHSS评分可作为判定病情的一个辅助手段[24],但其特异性和灵敏度尚不明确。
综上所述,本研究可得出以下结论:①CE患者较LAA患者HT发生率高;②抗血小板治疗及他汀类药物治疗为LAA患者HT的保护因素,入院时NIHSS评分为LAA患者HT的危险因素,而高FBG为CE患者HT的危险因素。故临床上对于溶栓治疗时间窗以外的急性脑梗死患者,应综合考虑病因分型、NIHSS评分等因素,选择合适的治疗方案。
[1] Khatri R, McKinney AM, Swenson B, et al. Blood-brain barrier, reperfusion injury, and hemorrhagic transformation in acute ischemic stroke[J]. Neurology, 2012, 79(13): 52-57.
[2] Rosell A, Murata Y, Foerch C, et al. Mechanisms and markers for hemorrhagic transformation after stroke[J]. Acta Neurochirungica Supplements, 2008, 105: 173-178.
[3] Fiorelli M, Kummer R, Bastianello S, et al. Hemorrhagic transformation within 36 hours of a cerebral infarct: relationships with early clinical deterioration and 3-month outcome in the European Cooperative Acute Stroke Study I (ECASS I) cohort[J]. Stroke, 1999, 30(11): 2280-2284.
[4] Paciaroni M, Agnelli G, Corea F, et al. Early hemorrhagic transformation of brain infarction: rate, predictive factors, and infuence on clinical outcome: results of a prospective multicenter study[J]. Stroke, 2008, 39(8): 2249-2256.
[5] Park JH, Kim WJ, Ko Y, et al. Is asymptomatic hemorrhagic transformation really innocuous?[J]. Neurology, 2012, 78(6): 421-426.
[6] 赵洪禄, 荀丽颖. 脑梗死后出血的多种因素研究进展[J].首都医药, 2012, 14: 30-31.
[7] Terruso V, Amelio M, Benedetto N, et al. Frequency and determinants for hemorrhagic transformation of cerebral infarction[J]. Neuroepidemiology, 2009, 33(3): 261-265.
[8] 韩瑛, 吴晓华, 张颖琪. 脑梗死后出血相关因素的分析[J].临床神经病学杂志, 2004, 17(1): 50-51.
[9] Alexandrov AV, Black SE, Ehrlich LE, et al. Predictors of hemorrhagic transformation occurring spontaneously and on anticoagulant in patients with acute ischemic stroke[J]. Stroke, 1997, 28(6): 1198-1202.
[10] 张雯君, 王伟平, 李保华. 脑梗死出血转化危险因素分析[J]. 中国脑血管病杂志, 2012, 9(2): 72-75.
[11] Kablau M, Kreisel SH, Sauer T, et al. Predictors and early outcome of hemorrhagic transformation after acute ischemic stroke[J]. Cerebrovasc Disease, 2011, 32(4): 334-341.
[12] Kerenyi L, Kardos L, Szasz J, et al. Factors influencing hemorrhagic transformation in ischemic stroke: a clinicopathological comparison[J]. Eur J Neurol, 2006, 13(11): 1251-1255.
[13] Adams RJ, Albers G, Alberts MJ, et al. Update to the AHA/ ASA recommendations for the prevention of stroke in patients with stroke and transient ischemic attack[J]. Stroke, 2008, 39(5): 1647-1652.
[14] Lindsay P, Bayley M, McDonald A, et al. Toward a more effective approach to stroke: Canadian Best Practice Recommendations for Stroke Care[J]. CMAJ, 2008, 178(11): 1418-1425.
[15] Goldstein LB, Amarenco P, Zivin J, et al. Statin treatment and stroke outcome in the Stroke Prevention by Aggressive Reduction in Cholesterol Levels (SPARCL) trial[J]. Stroke, 2009, 40(11): 3526-3531.
[16] Hackam DG, Woodward M, Newby LK, et al. Statins and intracerebral hemorrhage: collaborative systematic review and meta-analysis[J]. Circulation, 2011, 124(20): 2233-2242.
[17] Ni Chroinin D, Asplund K, Asberg S, et al. Statin therapy and outcome after ischemic stroke: systematic review and meta-analysis of observational studies and randomized trials[J]. Stroke, 2013, 44(2): 448, 456.
[18] Endres M. Statins and stroke[J]. J Cereb Blood Flow Metab, 2005, 25: 1093-1110.
[19] 冯会芳, 刘景云, 周成业. 他汀类药物对脑梗死患者动脉粥样硬化的疗效观察[J]. 温州医学院学报, 2013, 43(1): 31-33.
[20] Lindsberg PJ, Roine RO. Hyperglycemia in acute stroke[J]. Stroke, 2004, 35(2): 363-364.
[21] Scott JF, Robinson GM, French JM, et al. Prevalence of admission hyperglycemia across clinical subtypes of acute stroke[J]. Lancet, 1999, 353(9150): 376-377.
[22] Song EC, Chu K, Jeong SW, et al. Hyperglycemia exacerbates brain edema and perihematomal cell death after intracerebral hemorrhage[J]. Stroke, 2003, 34(9): 2215-2220.
[23] Hamilton MG, Tranmer BI, Auer RN. Insulin reduction of cerebral nfarction due to transient focal ischemia[J]. J Neurosurg, 1995, 82(2): 262-268.
[24] Marsh EB, Llinas RH, Hillis AE, et al. Hemorrhagic transformation in patients with acute ischaemic stroke and an indication for anticoagulation[J]. Eur J Neurol, 2013, 20(6): 962-967.
(本文编辑:丁敏娇)
·读者·作者·编者·
本刊2015年起启用在线投稿
2015年1月起本刊在线投稿系统正式运行。请作者进入本刊网站http∶//xb.qk.wmu.edu.cn,点击左侧栏的“作者投稿”,按照系统提示进行注册、登录,然后开始投稿。投稿成功后,系统即自动发送“投稿成功通知”。
本刊一般会在1周内将符合要求的稿件入库,并发送“稿件收稿回执通知”告知作者稿件编号。请作者及时填写《温州医科大学学报》投稿介绍信(本刊网站首页右侧栏“下载中心→投稿介绍信”处可下载),经所有作者亲笔签名并单位盖章后,尽快邮寄给本刊编辑部。在介绍信中,请如实填写对稿件内容素材真实性的审查意见以及在我刊规定的期限内无一稿多投、不涉及保密、署名无争议等项。如来稿属于基金项目,务请提供基金项目名称及编号,例:[基金项目]国家自然科学基金资助项目(5937050),并将相关证明材料复印件(或者扫描件)邮寄或Email至编辑部。经审合格后,省级以上基金项目稿件将优先刊用。
如遇到问题导致投稿不成功,请发送Email或电话及时联系我们。
编辑部电话:0577-86699365,Email:wzyxyxb@vip.126.com。
本刊编辑部
Objective:To contrast the incidence of HT between large artery atherothrombosis (LAA) and cardioembolism (CE), and to investgate the risk factors for hemorhagic transformation (HT) in patients with anterior circulation infarction who was attributed to cardioembolism (CE) or large artery atherothrombosis (LAA).Methods:The clinical data of 560 acute ischemic stroke patients admitted to Wenzhou First Hospital Affliated to Wenzhou Medical University between January 2010 and December 2012 were retrospectively collected. They were divided into HT group and non-HT group. Baseline demographic and clinical information collected included gender, age at onset, hypertension, diabetes, atrial fbrillation, systolic blood pressure and diastolic blood pressure levels, fasting blood glucose level, levels of TC and low-density lipoprotein cholesterol, National Institute of Health Stroke Scale (NIHSS) score at admission, infarct size, use of antiplatelet or anticoagulant medications and statins treatment. Univariate analysis was performed using idependent-Student’s t-tests (for continuous variables) and chi-square test (for categorical variables) for each of the predictors of interest. Subsequent multivariable modeling included the presence of HT as the dependent variable in stepwise logistic regression.Results:Statins use [odds ratio (OR)=0.212, 95% confidence interval (CI): 0.067-0.672], antiplatelet treatment (OR=0.170, 95%CI: 0.074-0.388) and the NIHSS score (OR=1.088, 95%CI: 1.02-1.16) were predictors of hemorrhagic transformation in LAA patients, while antiplatelet treatment (OR=2.224, 95%CI: 1.142-4.330) and blood glucose level (OR=2.168, 95%CI: 1.131-4.155) in CE patients. Conclusion: A higher HT rate found in the CE group than that in the LAA group. In LAA patients, statins used and antiplatelet treatment can lower the incidence of HT while NIHSS score may be a risk factor.But antiplatelet trentment and high blood glucose level may be thepossible risk factors in CE patients.
brain infarction; hemorhagic transformation; risk factors
R743.32
A
1000-2138(2014)12-0877-05
2013-10-04
温州市科技计划资助项目(Y20l00068);温州市重大科研基金资助项目(Y20070038)。
兰清莲(1987-),女,四川内江人,硕士生。
周成业,主任医师,硕士生导师,Emai1:zhoucy86@126.com。
Analysis on the risk factors of hemorrhagic transformation after cerebral infarction
LAN Qinglian1, ZHOU Chengye1, WANG Xiaotong2. 1.The First Department of Neurology, the First Affliated Hospital of Wenzhou Medical University, Wenzhou, 325015; 2.Department of Neurology, the Second Affliated Hospital of Wenzhou Medical University, Wenzhou, 325027
