淋巴管癌栓和血管癌栓对非小细胞肺癌预后的影响
2014-03-02赖秀萍赵金波
赖秀萍,赵金波
(1.大连医科大学2007 级七年制,辽宁 大连116044;2.大连医科大学 附属第二医院 肿瘤内科,辽宁 大连116027)
肺癌是世界范围内常见的肿瘤,其发病率和死亡率仍逐年上升,在发展中国家,肺癌是死亡率最高的肿瘤。世界卫生组织(WHO)将肺癌分为小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)两大类,其中非小细胞肺癌约占80%,又分为腺癌、鳞癌、大细胞肺癌等,与过去不同的是目前腺癌的发生率高于鳞癌,可能与烟草成分的改变有关。目前根治性手术切除仍是非小细胞肺癌得到治愈的最好方法,尽管如此,早期的患者手术后仍有约70%会发生复发或转移,因此识别肺癌复发及转移的预测因子尤为重要,它对术后是否需要行辅助化疗及随访时间的长短具有重要的参考价值[1]。目前研究发现肿瘤的大小、分化程度、脉管癌栓、病理分期、癌胚抗原(CEA)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、细胞周期蛋白D1 等都是NSCLC 的独立的预后因子[2-3]。在本文中主要探讨脉管癌栓(vessel invasion,VI)对NSCLC 预后的影响。
脉管癌栓在NSCLC 的发生率约为5% ~30%,是肿瘤侵犯脉管系统和淋巴结转移的先决条件。脉管癌栓分为血管癌栓(blood vessel invasion,BVI)和淋巴管癌栓(lymphatic vessel invasion,LVI)。脉管癌栓的判定标准为镜下发现肿瘤的小静脉、小动脉或小淋巴管的管壁受侵、破坏或管腔内有瘤栓[4]。1992年,Macchiarini 等[5]首次发现血管癌栓对NSCLC 根治性术后的早期复发率及5年总生存期(overall survival,OS)和无复发生存期(relapse-free survival,RFS)有重要影响,进而引发大量针对BVI和LVI 对NSCLC 预后影响的研究[5-13]。目前大多数医学学者都认为BVI 和LVI 对预后有重要影响[11],但也有一些学者认为这两者的预后意义是不同的,例如Tomoyuki H 等[9]和Gabor S 等[10]认为在COX 回归多因素分析中淋巴管癌栓(LVI)对预后是没有影响的,但血管癌栓(BVI)是对根治性手术切除后的NSCLC 的独立预后因子;而Brechot JM等[11]和Hanagiri T 等[12]认为淋巴管癌栓才是对预后有意义的预测因子。因此,目前可以肯定脉管癌栓对根治性术后NSCLC 的预后,特别是早期复发及总生存率的预测有重要意义,其风险值约为HR3.0。尽管如此,血管癌栓和淋巴管癌栓对NSCLC 预后的预测仍存在争议,
因此应将脉管癌栓区分为血管癌栓和淋巴管癌栓,同时研究其导致早期肺癌发生复发及转移的机制对治疗可提供循证学依据。
1 血管癌栓和淋巴管癌栓的鉴别
目前认为,血管是管腔内由内皮细胞衬里且充满红细胞及在大血管壁内有丰富的弹性纤维的管道;淋巴管是由毛细淋巴管汇合而成,其形态结构与静脉相似,但管径较细,管壁较薄,仅由内皮和极薄的结缔组织构成,其管腔内无红细胞且几乎不存在淋巴细胞,其中大淋巴管壁还包含一层很薄的平滑肌纤维[13]。目前原发肿瘤标本一般用10%甲醛固定,然后行石蜡包埋[9-10,13]。
采用传统的HE 染色方法难以区分血管内癌栓和淋巴管癌栓。目前鉴别两者的最佳方法是采用链霉亲和素-生物素-过氧化物酶复合物法进行免疫组化染色。其中用来标记血管的抗体有CD34 和CD105 等抗体。CD34 在标记血管时,周围原位癌的基底膜及纤维间质可出现非特异性染色。CD105 是特异性内皮细胞标志物,主要选择内皮细胞,对新生血管具有高度敏感性,但仅具有相对特异性。Mineo等[14]研究发现CD34 标记的血管内皮细胞与CD105相比,与脉管癌栓的表达更具有相关性,Traweek等[15-16]也认为CD34 抗体对肿瘤内毛细血管和小血管内皮细胞的稳定性及敏感性较强,同时还具有较强的可重复性,因此CD34 抗体为目前评价血管癌栓的首选泛内皮细胞标志物,其免疫组化图如图1a 所示,CD34 染色阳性的内皮细胞管腔内出现癌细胞即表示为血管癌栓阳性。D2 -40 是近年来发现的特异性淋巴管内皮标记物,它特异性作用于淋巴管,对血管内皮包括毛细血管、静脉、动脉没有明显作用,因而D2 -40 被认为是目前最广泛应用的淋巴管癌栓的标志物抗体[17-19]。且朱伟等[20]研究证明D2 -40 可以特异性识别非小细胞肺癌组织中淋巴管内皮细胞,其标记的淋巴管主要位于癌周组织,如图1b 所示,D2 -40 染色阳性的内皮细胞管腔内出现癌细胞即表示为淋巴管癌栓阳性。
2 术前简单的CT 扫描对脉管癌栓发生的预测
Takuya I 等[4]认为术前简单的高分辨率CT 扫描可以预测脉管癌栓发生的可能性,其敏感性和特异性分别为75%和72%。图2a 显示先取肺窗中肿瘤的最大直径为L;图2b 显示同一层面纵膈窗中肿瘤的最大直径为M,在同一层面上肺窗中显示而纵膈窗中未显示的阴影即为磨玻璃样阴影。研究发现,可以采用受试者操作特征(receiver operating characteristic,ROC)曲线来比较通过M/L 的比值预测脉管癌栓发生率的准确性、敏感度和特异度。ROC 曲线下面积(the area under the ROC curve,AUC)在0.5 ~0.7 时有较低准确性,AUC 在0.7 ~0.9 时有一定准确性,AUC 在0.9 以上时有较高准确性,AUC =0.5 时,说明诊断方法完全不起作用,无诊断价值。在此研究中,AUC 为0.75,即用M/L的比值来预测脉管癌栓的发生率具有一定的准确性。同时还发现M/L≥0.67 的患者生存率小于M/L <0.67 的患者,差异具有统计学意义。Aoki T、Suzuki K 等[21-22]也发现在NSCLC 中磨玻璃样阴影越少,脉管癌栓的发生率越大,即M/L 的比值越大,脉管癌栓的发生率越大。但是并没有相关文献报道可应用MRI 及PET-CT 对脉管癌栓进行预测。
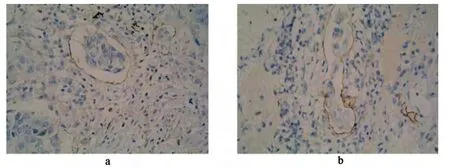
图1 不同抗体标记的癌栓微观组织照片(×400)Fig 1 Microstructure images of the cancer embolus marked by different antibody(×400)
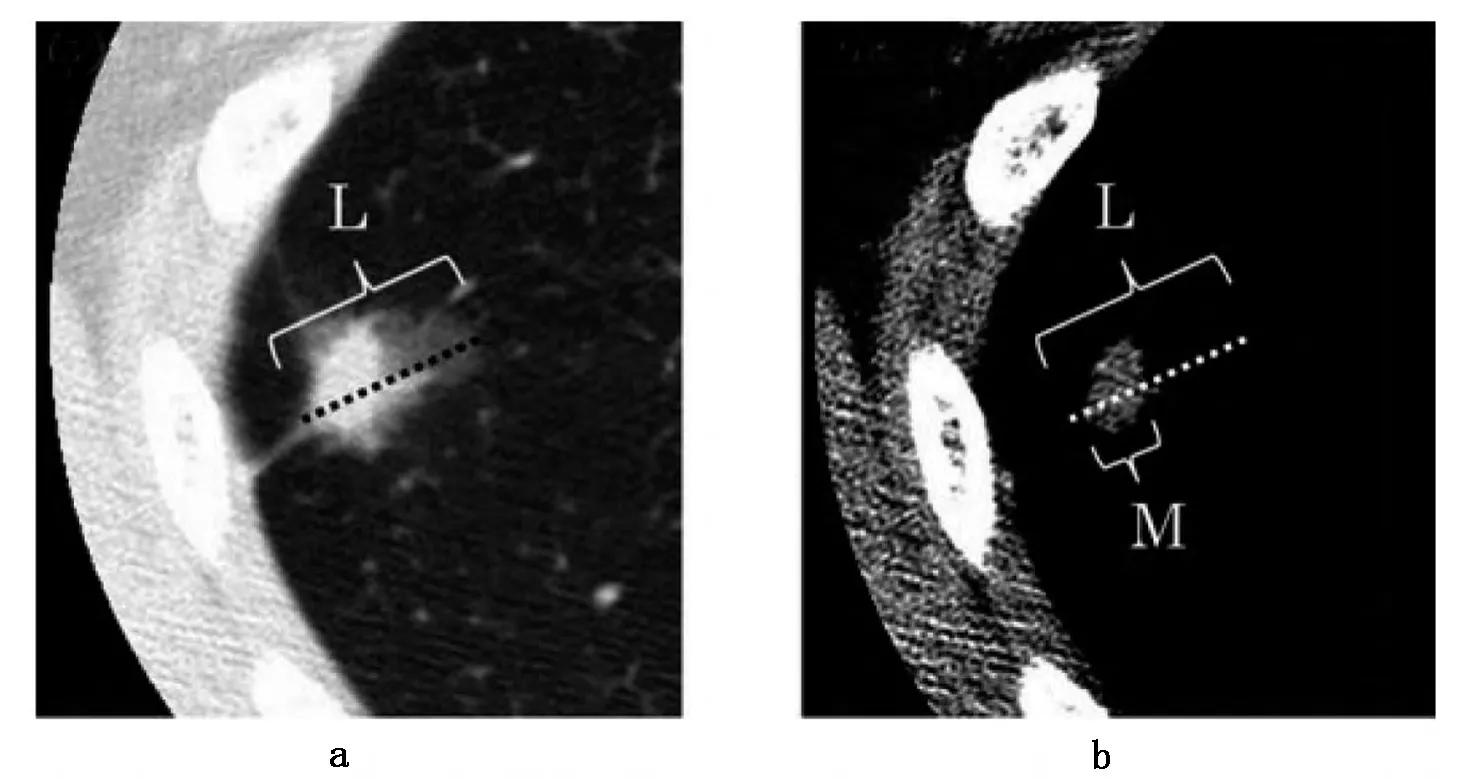
图2 肿瘤的高分辨CT 图Fig 2 High resolution CT images of lung tumor
3 脉管癌栓与血管内皮生长因子(VEGF)的关系
血管内皮生长因子是内皮细胞最强力和特异的生长因子,在NSCLC 异常血管生成中起核心作用,并促进肿瘤的生长和转移。Singhal 等[23-25]的研究结果表明VEGF 在体内可以增加血管的通透性,促进肿瘤发生侵袭和转移;在体外可促进内皮细胞增生和血管生成,因此它是NSCLC 预后不良因子,同时适用于抗VEGF 的单克隆抗体的治疗。Mineo等[14]研究发现存在脉管癌栓组的病人具有高的VEGF 表达。高禹舜等[26]发现VEGF 阳性表达者有脉管癌栓组的占74.2%,而在阴性表达者中有脉管癌栓组的只占13.4%,这些都充分表明脉管癌栓对早期术后肺癌发生复发及转移可能跟VEGF 表达上调有关,同时也暗示存在脉管癌栓的病人是否适用抗VEGF 的单克隆抗体的治疗需要进一步的研究。术前CEA >5 ng/mL 也是根治性术后NSCLC 的预后不良因子之一,CEA >5 ng/mL 组,其RFS 和5年OS 均降低,且降低的量值具有统计学意义[13,27]。Tomoshi 等[28]研究提出当脉管癌栓在术前CEA >5 ng/mL 时,脉管癌栓发生的可能性将会增高,这与Sakao 等[29]的研究结果相似。同时Kashiwabara等[7]发现在术后CEA≤2.5 ng/mL 和脉管癌栓阴性时预示Ⅰ期肺腺癌患者术后不会发生复发,这都提示脉管癌栓和CEA 对预后影响方面存在着协同性和相关性。
4 脉管癌栓与集群孤立肿瘤细胞(clustered isolated tumour cells,ITCs)的关系
肺静脉中集群孤立肿瘤细胞(clustered isolated tumour cells,ITCs)是近年来发现与肿瘤的预后、复发和转移具有相关性的因素。存在ITCs 的肿瘤患者其术后复发及转移率高于不存在ITCs 组的患者,可能是因为ITCs 从原发肿瘤流出,经过全身静脉循环发生远处转移[30-31]。Soichiro F 等[32]研究发现在ITCs 存在时,脉管癌栓的发生率明显提高。图3为不同形态学的ITC 与脉管癌栓阳性比的关系,在C 组中脉管癌栓的阳性比为79%,S 组中为40%,N组中为9%,这说明在集群孤立肿瘤细胞存在时,脉管癌栓的发生率明显提高。反过来说脉管癌栓的存在很可能预示着ITCs 的存在,其易发生远处转移和复发的机制很可能是因ITCs 的存在导致肿瘤细胞远距离播散,但是两者的关系仍需进一步研究证明。
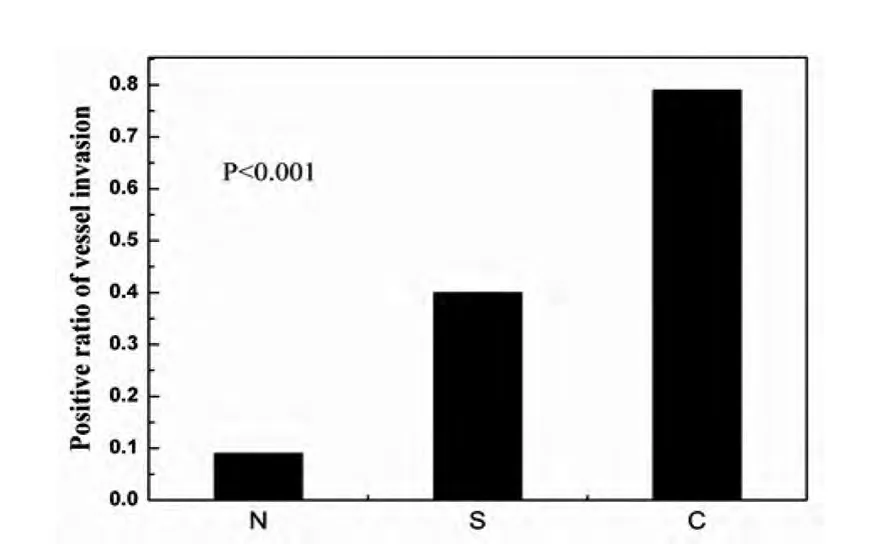
图3 不同形态学的ITC 与脉管癌栓阳性比的关系图Fig 3 Relationship between morphologically different ITC and PLR of lymphovascular invasion
此外,还有研究认为脉管癌栓跟肿瘤的分期、分化、肿瘤的大小和脏层胸膜侵犯有关,当分期越高、分化越低、发生侵犯脏层胸膜和肿瘤最大直径≥15 mm 时,脉管癌栓的发生率提高[10,12,16,30-31]。
5 脉管癌栓对NSCLC 预后的影响
2009年国际抗癌联盟/美国癌症联合会(UICC/AJCC)颁布的第7 版肺癌的TNM 分期,脉管癌栓并未纳入肺癌分期依据中。但是脉管癌栓从1992年开始研究后,众多学者认为脉管癌栓是根治性术后NSCLC 患者的不良预后因子,且认为其能提高TNM分期[6,13-14,16]。例 如,Tomoshi 等[13]和Tanaka F等[16]的研究表明具有脉管癌栓的ⅠA 期病人与不具有脉管癌栓的ⅠB 期病人5年OS 的差异不具有统计学意义,而ⅠB 期具有脉管癌栓的病人与ⅡA期不具有脉管癌栓的病人5年OS 的差异也不具有统计学意义,因而建议脉管癌栓应纳入TNM 分期中,同时还发现ⅠA 期具有脉管癌栓的患者术后进行尿嘧啶-替加氟(Uracil-tegafur)口服化疗后,其5年生存率从66.6%提高到93.3%。其他学者如Tomoyuki H 等[9],Gabor S 等[10]也发现脉管癌栓的存在会提高NSCLC 患者的TNM 分期。
Brechot 等[11,17-18]学者认为只有淋巴管癌栓对患者的预后有影响,是由于血管癌栓的发生率高于淋巴管癌栓,且淋巴管癌栓发生远处转移的几率相对较低;但Gabor 等[10]和Soichiro 等[32]认为只有血管癌栓才是NSCLC 的预后不良因素的原因是,癌栓从原发肿瘤排出,通过静脉系统在全身循环,然后发生远处转移,这与淋巴管和血管的解剖学特点相关:淋巴管和血管具有异常丰富的链接系统,癌细胞转移至淋巴管后,在淋巴结内,淋巴液同血液循环相联系,汇成输出淋巴管之前,有大约一半的淋巴液进入血液循环,因此大量癌细胞进入到血管中,导致肿瘤细胞发生远处转移和复发,提示血管内存在癌栓是肿瘤发生复发及转移的关键步骤。针对两者对NSLCL 的预后影响的争议,Wang 等[33]和Nathan等[34]综合国内外针对血管癌栓和淋巴管癌栓对NSCLC 预后影响的文章进行Meta 分析。Wang等[33]总结了从1980年至2011年7月间发表的关于血管癌栓对NSCLC 预后影响的52 篇入组文章,其结果表明血管癌栓无论对于RFS 还是OS 均是NSCLC 的独立预后不良因子,且对早期肺癌的预后影响意义较大。而Nathan 等[34]总结了从1990年至2012年12月间发表的关于淋巴管癌栓对Ⅰ期非小细胞肺癌预后影响的20 篇入组文章,通过分析未经调整及调整的效果评价,以4 个单独的Meta 分析表明不管是未经调整还是调整潜在的混杂因素后的结果,LVI 患者的RFS 和OS 均明显较差,这肯定了LVI 是根治性术后Ⅰ期NSCLC 的预后不良因子。但因目前对两者的预后影响意义仍然存在,所以还需继续进行研究,且未来可能还需要前瞻性研究来进一步验证这些结果以为临床提供更多治疗依据。
脉管癌栓还可分为瘤内癌栓(itratumor vessel invasion)和瘤外癌栓(extratumor vessel invasion)。Shimada Y 等[35]发现具有瘤外癌栓的患者组其远处转移率高于瘤内癌栓组,Alain J 等[36]的研究也表明未发现瘤内血管癌栓与长期预后有关系;但在Basse等[37]研究中,瘤内血管癌栓对OS 的差别是具有统计学意义的;也有学者认为这两者都具有意义[9]。
此外,血管癌栓还可细分为静脉癌栓和动脉癌栓。Ichinose Y 等[38]认为只有静脉癌栓对预后有影响,但动脉癌栓不具有,但目前相关文章较少,仍需进一步研究中。
6 总 结
综上所述,脉管癌栓也是根治性术后NSCLC 的预后不良因子之一,其对各个时期的肺癌均有预测意义,但在早期的意义大于晚期的,可能与促进肺癌发生早期复发及转移相关。同时术前高分辨率CT和CEA 水平可预测脉管癌栓发生的几率,其促进早期肺癌发生复发及转移的可能与使VEGF 表达上调、ITCs 的存在等有关;在免疫组化实验中,建议用CD34 抗体标记血管癌栓,用D2 -40 抗体标记淋巴管癌栓。行病理诊断时对血管癌栓和淋巴管癌栓进行鉴别,并且建议脉管癌栓纳入NSCLC 的TNM 分期依据中,重新评估ⅠA 期具有脉管癌栓的患者是否需行术后辅助化疗。
[1] 朱广卿,晋颖. 老年非小细胞肺癌治疗中存在的问题[J].医学与哲学:临床决策论坛版,2009,30(9):24 -26.
[2] Sandra LS,Peterson P,Jiang W,et al. Clinical and Molecular Predictors of Recurrence in Stage I Non-Small Cell Lung Cancer[J]. Ann Thorac Surg,2012,93(5):1606 -1613.
[3] John M,Abram R,John C,et al. Varying Recurrence Rates and Risk Factors Associated With Different Definitions of Local Recurrence in Patients With Surgically Resected,Stage I Nonsmall Cell Lung Cancer[J]. Cancer,2010,116(10):2390 -2400.
[4] Takuya I,Tomohiro M,Hajime S,et al. Simple preoperative computed tomography image analysis shows good predictive performance for pathological vessel invasion in c linical stage IA non-small cell lung cancer[J]. Interact Cardio Vasc Thorac Surg,2012,15(4):633 -638.
[5] Macchiarini P,Fontanini G,Hardin MJ,et al. Blood vessel invasion by tumor cells predicts recurrence in completely resected T1NOMO non - small cell lung cancer[J]. J Thorac Cardiovas Surg,1993,106(6):80 -89.
[6] Gao YS,Zhang CY,Li N,et al. Vascular Invasion as an Independent Prognostic Indicator in Radically Resected Non-small Cell Lung Cancer[J]. Chin J Cancer Res,2008,20(1):33 -38.
[7] Kashiwabara K,Saeki S,Sasaki J,et al. Combined evaluation of postoperative serum levels of carcinoembryonic antigen less than or equal to 2.5ng/ml and absence of vsucular invasion may predict no recurrence of stage I adenocarcinoma lung cancer[J]. J Thorac Oncol,2008,3(12):1416 -1420.
[8] Akopov AL,Dvorakovskaia IV. Vascular invasion by tumor in the absence of regional lymph node metastases in patients with locally advanced non - small cell lung cancer[J]. Vopr Onkol,2004,50(4):417 -420.
[9] Tomoyuki H,Junji Y,Ryo M,et al. Prognostic impact of intratumoural microvascular invasion and microlymphatic permeation on node-negative non-small-cell lung cancer:which indicator is the stronger prognostic factor?[J].Eur J Cardio Thorac Surg,2013,43(4):772 -777.
[10] Gabor S,Renner H,Popper H,et al. Invasion of blood vessels as significant prognostic factor in radically resected T1 -3N0M0 non - small - cell lung cancer[J]. Eur J Cardio Thorac Surg,2004,25(3):439 -442.
[11] Brechot JM,Chevret S,Charpentier MC,et al. Blood vessel and lymphatic vessel invasion in resected nonsmall cell lung carcinoma:Correlation with TNM stage and disease free and overall survival[J]. Cancer,1996,78(10):2111 -2118.
[12] Hanagiri MT,Takenaka S,Oka Y,et al. Prognostic significance of lymphovascular invasion for patients with stage I non-small cell lung cancer[J]. Eur Surg Res,2011,47(4):211 -217.
[13] Tomoshi T,Satoshi H,Shinji A,et al. Upstaging by vessel invasion improves the pathology staging system of non- small cell lung cancer[J]. CHEST,2007,132(1):170 -177.
[14] Mineo TC,Ambrogi V,Baldi A,et al. Prognostic impact of VEGF,CD31,CD34,and CD105 expression and tumour vessel invasion after radical surgery for IB - IIA non-small cell lung cancer[J]. J Clin Pathol,2004,57(6):591 -597.
[15] Traweek ST,Kandalaft PL,Mehta P,et al. The human hematopoietic progenitor cell antigen(CD34)in vascular neoplasia[J]. Am J Clin Pathol,1991,96(1):25 -31.
[16] Tanaka F,Otake Y,Yanagihara K,et al. Evaluation of angiogenesis in non -small cell lung cancer. Comparison between anti-CD34 and anti-CD105 antibody[J]. Clin Cancer Res,2001,7:3410 -3415.
[17] Kunio A,Yoshin A,Hiroyuki M,et al. Prognostic implication of lymphatic vessel invasion in stage IB(pT2aN0M0)non-small cell lung cancer[J]. Gen Thorac Cardiovasc Surg,2011,59(9):605 -608.
[18] Adachi Y,Nakamura H,KitamuraY,et al. Lymphatic vessel density in pulmonary adenocarcinoma immunohistochemistry evaluated with anti-podoplanin or anti-D2 -40 antibody is correlated with lymphatic invasion or lymph node metastases[J]. Pathol Int,2007,57(4):171 -177.
[19] Kadota K,Huang CL,Liu D,et al. The clinical significance of lymphangiogenesis and angiogenesis in non -small cell lung cancer patients[J]. Eur J Cancer,2008,44(7):1057 -1067.
[20] 朱伟,金时代,郭人花.D2 -40 标记阳性淋巴管密度在非小细胞肺癌中的临床应用[J]. 江苏医药,2013,6:651 -653.
[21] Aoki T,Tomoda Y,Wata nabe H,et al. Peripheral lung adenocarcinoma:correlation of thin -section CT findings with histologic prognostic factors and survival[J]. Radiology,2001,220(3):803 -809.
[22] Suzuki K,Asamura H,Kusumoto M,et al. "Early" peripheral lung cancer:prognosticsignificance of ground glass opacity on thin-section computed tomographic scan[J]. Ann Thorac Surg,2002,74(5):1365 -1369.
[23] Singhal S,Vachani A,Antin-Ozerkis D,et al. Prognostic implications of cell cycle,apoptosis,and angiogenesis biomarkers in non-small cell lung cancer:a review[J].Clin Cancer Res,2005,11(11):3974 -3986.
[24] Maeda R,Yoshida J,Ishii G,et al. Long-term outcome and late recurrence in patients with completely resected stage IA non-small cell lung cancer[J]. J Thorac Oncol,2010,5(8):1246 -1250.
[25] 林文俐,刘杰,刘传勇,等.PDGF -BB、Podoplanin 在非小细胞肺癌中的表达与淋巴管生成的关系[J].医学与哲学:临床决策论坛版,2011,32(4):62 -64.
[26] 高禹舜,邢学忠,王兵,等. VEGF、Fit -1、PIGF 和脉管瘤栓与非小细胞肺癌预后的相关性研究[J].中国肿瘤临床与康复,2009,16(1):1 -6.
[27] Koo HK,Jin SM,Lee CH,et al. Factors associated with recurrence in patients with curatively resected stageⅠ-Ⅱlung cancer[J]. Lung Cancer,2011,73(2):222 -229.
[28] Tomoshi T,Shinji A,Masashi M,et al. Stage IA nonsmall cell lung cancer:Vessel invasion is a poor prognostic factor and a new target of adjuvant chemotherapy[J].Lung Cancer,2007,56(3):341 -348.
[29] Sakao Y,Tomimitsu S,Takeda Y,et al. Carcinoembryonic antigen as a predictive factor for postoperative tumor relapse in early - stage lung adenocarcinoma[J]. Eur J Cardiothorac Surg,2004,25(4):520 -522.
[30] Pantel K,Brakenhoff RH,Brandt B. Detection,clinical relevance and specific biological properties of disseminating tumour cells[J]. Nat Rev Cancer,2008,8(5):329 -340.
[31] Tanaka F,Yoneda K,Kondo N,et al. Circulating tumor cell as a diagnostic marker in primary lung cancer[J].Clin Cancer Res,2009,15(22):6980 -6986.
[32] Soichiro F,Noriyoshi S,Abulimiti A,et al. Significance of tumour vessel invasion in determining the morphology of isolated tumour cells in the pulmonary vein in non-small cell lung cancer[J]. Eur J Cardio Thorac Surg,2013,43(6):1126 -1130.
[33] Wang J,Wang BC,Bi JW,et al. Prognostic significance of microvascular invasion and microlymphatic permeation in non-small-cell lung cancer[J]. Eur J Cardio Thorac Surg,2013,43(6):1269.
[34] Nathan M Mollberg,Carrie Bennette,Eric Howell,et al.Lymphovascular Invasion as a Prognostic Indicator in StageⅠNon - Small Cell Lung Cancer:A Systematic Review and Meta - Analysis[J]. Ann Thorac Surg,2014,97(3):965 -971.
[35] Shimada Y,Ishii G,Hishida T,et al. Extratumoral vascular invasion is a significant prognostic indicator and a predicting factor of distant metastasis in non - small cell lung cancer[J]. J Thorac Oncol,2010,5(7):970 -975.
[36] Alain J Poncelet,Julien C. Intra - tumoral vascular or perineual invasion asprognostic factors for long-term survival in early stage non -small cell lung carcinoma[J].Eur J Cardio Thorac Surg,2008,33(5):799 -804.
[37] Basse SA,Kathy G,Siobhan N,et al. Prognostic impact of vascular and lymphovascular invasion in early lung cancer[J]. Asian Cardiovasc Thorac Ann,2014,22(1):55 -64.
[38] Ichinose Y,Yano T,Asoh H,et al. Prognostic factors obtained by a pathologic examination in completely resected non - small - cell lung cancer. An analysis in each pathologic stage[J]. J Thorac Cardiovasc Surg,1995,110(3):601 -605.
