大鼠乳鼠成骨细胞建立及其生物学活性的研究
2014-03-02易东升
易东升,林 琳,高 峰
(1.大连市第二人民医院 骨外科,辽宁 大连116001;2.大连医科大学,辽宁 大连116044 )
1965年,Urist[1]将动物脱钙的骨基质种植于动物肌袋内,发现种植部位有大量软骨和骨组织生成,并发现其中一种具有诱导间充质细胞向成骨细胞分化成骨的蛋白,此后这种蛋白被命名为骨形态发生蛋白(bone morphogenetic protein,BMP)。目前,通过基因重组的方法已获得20 余种BMPs,这些BMPs均能诱导间充质干细胞向成骨细胞及软骨细胞分化,对成骨细胞及其他骨组织工程种子细胞也有同样的诱导作用,其中BMP -2 和BMP -7 是研究最广泛,诱导成骨活性最强的两种BMPs,这两种BMPs在骨发生、诱导、修复和骨量保持方面发挥着重要而关键的作用。但是,在BMPs 的实验研究中最多见的是关于单独应用BMP-2 和BMP -7 对成骨细胞生物学活性影响的报道,而联合应用BMP -2 和BMP-7 对成骨细胞生物学活性影响未见报道。本实验对制备的大鼠乳鼠成骨细胞,联合应用BMP -2 和BMP-7,探讨联合应用后对大鼠乳鼠成骨细胞生物学活性影响,以便进一步为临床上治疗骨缺损,骨折不愈合,促进骨折愈合和椎体融合提供理想的移植细胞。
1 材料和方法
1.1 实验动物及主要试剂仪器
出生5日龄的SD 大鼠4 只(雌雄不限):由大连医科大学动物实验中心提供,许可证号:SCXK(辽)2008 -0002;胎牛血清:杭州四季清生物技术有限公司产品;胰蛋白酶、MTT:上海生工生物工程技术服务有限公司产品;倒置相差显微镜:重庆光学仪器厂;CO2孵育箱:英国Thermo 公司;BMP -2 和BMP-7(Rehovot Science Park);碱性磷酸酶测定试剂盒(南京建成生物工程研究所);骨钙素放射免疫分析药盒(北京普尔伟业生物科技有限公司);MTT细胞增殖检测试剂盒(凯基生物科技发展有限公司);12 孔,24 孔培养板,25 cm2培养瓶(Nunc 公司);二甲基亚飒(天津登峰化学试剂厂);酶联免疫检测仪(MRX-II 型,美国Dynex 公司);CO2孵育箱(英国Thermo 公司)。
1.2 原代成骨细胞培养方法
1.2.1 成骨细胞的分离培养:将5日龄的SD 乳鼠4 只放入750 mL/L 乙醇中浸泡10 min,无菌取颅盖骨,置于含PBS 液的培养皿中,尽量剔除附着的血管及结缔组织,加入适量2.5 g/L 的胰蛋白酶,于37 ℃气浴振荡,预消化20 min,终止消化,PBS 液清洗。再将颅盖骨剪成1 mm ×1 mm 碎块,加入适量1.0 g/L 的Ⅱ型胶原酶,37 ℃气浴振荡消化1 h,终止消化,液体移入另一离心管,1 500 r/min 离心10 min,弃去上清液,沉淀即为成骨细胞。用含100 mL/L 胎牛血清的α-MEM 培养液重悬,吹打均匀,接种至培养瓶,37 ℃50 mL/L CO2饱和湿度下培养24 h 后换液,以后每3 d 换液1 次,待细胞长满后,用2.5 g/L 的胰蛋白酶消化传代。
1.2.2 成骨细胞的传代:吸掉以前的培养液;用PBS 液洗涤细胞1 ~2 次;加入胰酶溶液(1 mL/25 cm2、2 mL/75cm2)37 ℃作用数分钟,于倒置相差显微镜下观察,当细胞将要分离而呈现圆粒状时,吸掉胰酶溶液;轻拍培养瓶使细胞自瓶壁脱落,加入适量之新鲜培养基,以吸管上下吸放数次以打散细胞团块。混合均匀后,依稀释比例(1∶2)转移到新的培养瓶中,以正常培养条件培养,以每孔9 ×104接种到预先放有无菌盖玻片的24 孔培养板,并以每孔4.8 ×103接种到96 孔培养板中。
1.2.3 活细胞的观察检测:台盼蓝染色测细胞成活率:取1 滴5 g/L 的台盼蓝染液(取0.5 g 台盼蓝充分溶于50 mL 的双蒸水中,滤纸过滤,再加入18 g/L的NaCl 溶液至100 mL)与9 滴细胞悬液混合后,滴入细胞计数板,静置2 min 后,在显微镜下计数200个细胞,重复2 次,未着色的为活细胞,呈蓝色的为死细胞,计算活细胞的百分率。
倒置相差显微镜观察:原代培养至细胞汇合后传代,进行观察拍片。
噻唑蓝(MTT)法检测细胞活力:在测定前4 h取出1 块96 孔板,更换成无血清的α -MEM 培养液100 μL(含10 μL 5 g/L 的MTT),培养箱孵育4 h,加100 μL 无水乙醇,振荡10 min,在酶标仪上读取D490nm 值,绘制生长曲线。
1.3 分组及各组处理方法
采用本实验制备和培养的大鼠乳鼠成骨细胞,以下实验中所用的细胞均为第3 ~5 代细胞。传代细胞的培养板孔中加有消毒盖玻片,制备细胞爬片。将传代细胞(3 ~5 代)按6.0 ×104/mL 接种于96 孔培养板,100 μL/孔,培养24 h 后,弃去培养液。并将其分为单独应用BMP -2 组和单独应用BMP -7组,联合应用BMP-2 和BMP-7 组,对照组不加任何处理因素(每组3 孔),48 h 后,加入15 μL 5.0g/LMTT(新鲜配制),37 ℃继续培养4 h 后弃培养液,每孔加150 μL 的二甲基亚砜,振荡,室温10 min,570 nm 下测定A 值。
取生长良好的培养细胞,用胰酶消化,计数,按2.0 ×104/mL 接种于24 孔培养板,培养24 h 后,弃去培养液及未贴壁细胞,加入用无血清的α -MEM稀释的BMP(单独应用BMP-2 和BMP -7,联合应用BMP-2 和BMP -7),对照组仅加培养液。48 h后收集细胞裂解液,检测ALP 活性,OCN 含量和总蛋白含量(每组3 孔)。细胞裂解液中总蛋白含量测定用Pierce 公司的BCA(Bicinchininic acid)试剂盒,按试剂说明进行测定。
1.4 测定方法
1.4.1 细胞裂解液(加入TritonX -100 过夜)中碱性磷酸酶活性测定:采用磷酸对硝基苯醋二钠盐为底物,405 nm 波长比色,测定吸光度值,换算成国际单位,以IU/L·mg 蛋白表示ALP 活性,蛋白含量的测定用BCA 法(Pierce 公司试剂盒)。
1.4.2 OCN 含量检测:OCN 含量检测用放射免疫法(大连医科大学附属第一医院核医学科),用ng/L·mg 蛋白表示细胞裂解液中OCN 含量。
1.5 统计学方法
采用SPSS 13.0 统计软件,多组样本均数比较采用方差分析,进一步两两比较采用q 检验,以P <0.05 为差异有统计学意义。
2 结 果
2.1 细胞成活率
胶原酶消化的原代细胞成活率88.69%;待细胞长满后用胰酶消化传代的细胞成活率94.12%。
2.2 MTT 法绘制生长曲线
用MTT 法检测细胞活力的结果显示,成骨细胞在接种后第4 ~5 天进入对数生长期,第10 天达到生长峰值,此后进入生长衰减期(见图1)。

图1 成骨细胞的生长曲线Fig 1 The growth curve of osteoblasts
2.3 原代及传代培养成骨细胞的生物学特征
用胶原酶消化下来的成骨细胞接种培养12 h后,倒置显微镜下可见贴壁生长的细胞呈现成纤维细胞样外观,为不规则梭形,三角形或多角形,有较多突起,部分细长突起常跨越细胞与远处的细胞突起相连接,胞核呈圆形或椭圆形,居中或偏于一侧,轮廓清晰,可见1 ~3 个核仁(图2A)。细胞长满瓶壁时,细胞多呈梭形或立方形,排列紧密。继续进行传代,以每孔9 ×104接种到24 孔培养板继续培养,待细胞大部分汇合后,换成成骨细胞诱导液,培养至第6 天细胞重叠生长,开始形成细胞团块,第10 天可见钙化结节形成,第17 天可见多个钙化结节融合在一起。
2.4 ALP 染色的光镜观察
用NBT/BCIP 染色试剂盒染色的结果显示,成骨细胞呈蓝色,且颜色深浅不等,功能活跃细胞着色较深,功能不活跃的细胞着色较浅(图2B)。Gomori改良钙-钴法染色的结果显示,成骨细胞胞质内有灰黑色颗粒或块状沉淀(图2C)。且ALP 染色阳性率为98.06%。
2.5 矿化结节的光镜观察
用倒置相差显微镜观察成骨细胞,可见多个大小不等的矿化结节(图2D),茜素红染色时矿化结节红染,有的多个矿化结节融合(图2E),四环素标记后用荧光显微镜观察,矿化结节呈绿色(图2F)。
2.6 BMP 对成骨细胞增殖和分化的影响
联合应用BMP-2 和BMP-7,单独应用BMP-2 和BMP-7,不应用BMP-2 和BMP -7(对照组)处理成骨细胞48 h 后,成骨细胞增殖(MTT 法),ALP 活性和OCN 含量检测结果见表1。
结果显示,单独应用BMP -2 和BMP -7,48 h后,均能刺激大鼠乳鼠成骨细胞的增殖,增加成骨细胞ALP 活性和OCN 含量,但与对照组比较差异无显著性意义(P >0.05)。但联合应用BMP-2 和BMP-7 后对大鼠乳鼠成骨细胞的增殖,增加成骨细胞ALP活性和OCN 含量较对照组,单独应用BMP -2 和BMP-7 组比较差异有显著性意义(P <0.05)。
3 讨 论
BMP(bone morphogenetic protein)最早定义为在骨骼外的部位能诱导骨形成的蛋白质[2],它属于转移生长因子- β(transforming growth factor - β,TGF-β)超家族成员。现己发现有20 多种BMPs,在形态发生和胚胎形成的过程中BMPs 影响骨、软骨及骨骼的形成[2-3]。
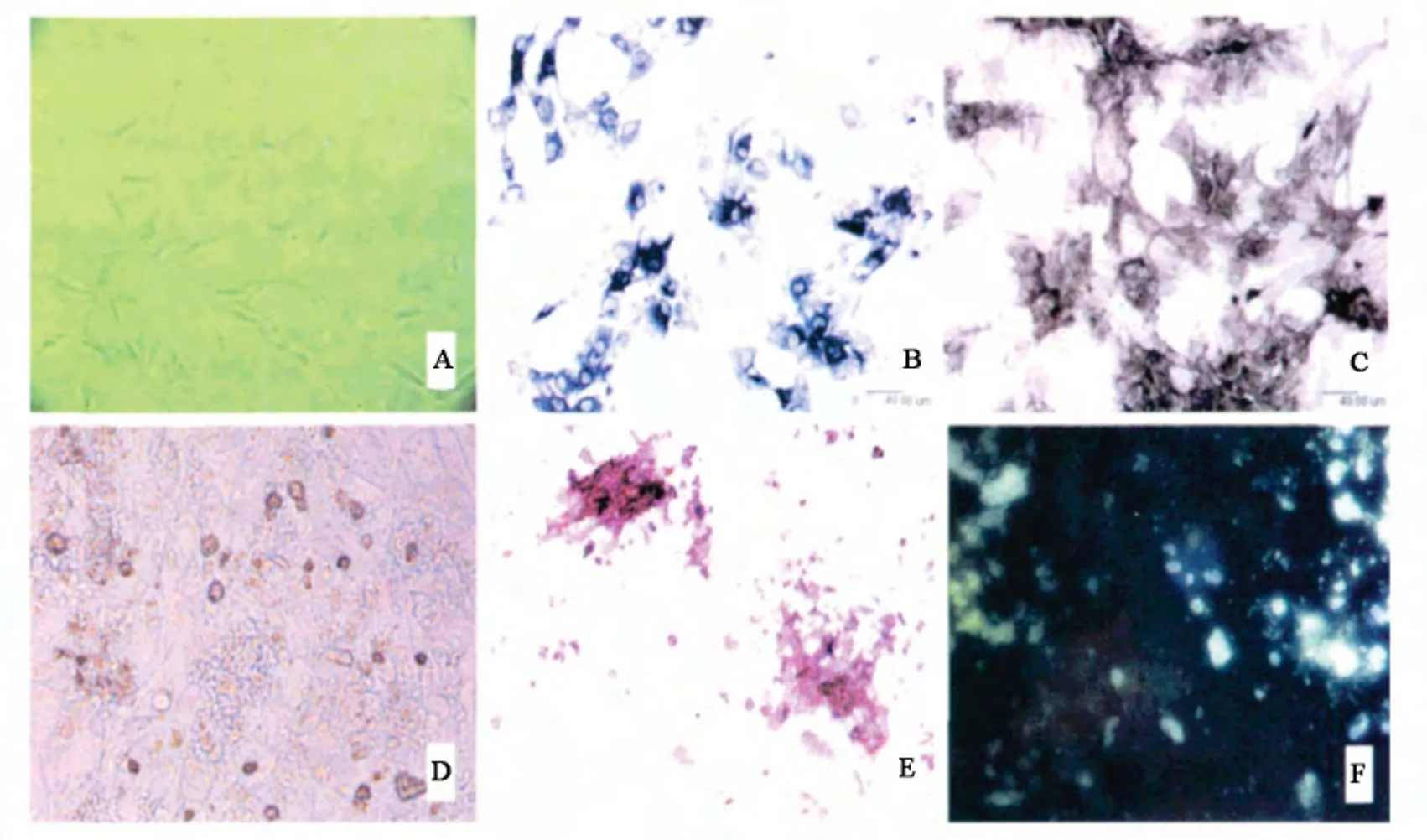
图2 贴壁生长的成骨细胞及鉴定观察Fig 2 Identification observe about the growth of osteoblasts
表1 BMP 对成骨细胞增殖和分化的影响Tab 1 BMP effects on osteoblast proliferation and differentiation ( ± s)
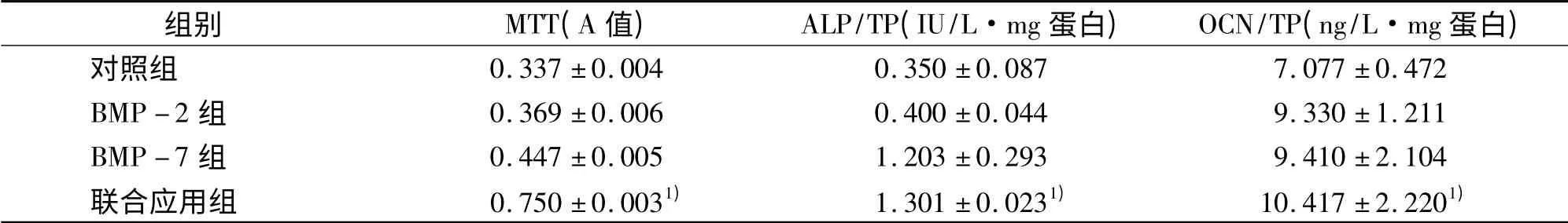
表1 BMP 对成骨细胞增殖和分化的影响Tab 1 BMP effects on osteoblast proliferation and differentiation ( ± s)
1)与对照组、BMP-2 组和BMP-7 组比较,P <0.05
组别 MTT(A 值) ALP/TP(IU/L·mg 蛋白) OCN/TP(ng/L·mg 蛋白)对照组0.337 ±0.004 0.350 ±0.087 7.077 ±0.472 BMP-2 组 0.369 ±0.006 0.400 ±0.044 9.330 ±1.211 BMP-7 组 0.447 ±0.005 1.203 ±0.293 9.410 ±2.104联合应用组 0.750 ±0.0031) 1.301 ±0.0231) 10.417 ±2.2201)
BMP-2 作为TGF-β 超家族成员,具有很强的促进成骨的功能。有研究报道了BMP-2 对人未成熟成骨细胞前体细胞——新生儿颅骨细胞(human neonetal calvariacells,HNC)的短期(48 h)和长期(3周)作用,发现BMP-2(0.1 ~100 ng/mL)无论在短期还是长期的培养中都抑制HNC 细胞的增殖,48 h时,ALP 活性明显增加,但OCN 含量并无明显变化。3 周时,ALP 活性,OCN 含量,钙沉积都明显增加[4]。本实验的细胞模型来源于大鼠乳鼠颅骨的成骨细胞,BMP-2 作用48 h 后,成骨细胞的增殖,成骨细胞ALP 活性和OCN 含量都有所增加,但与对照组比较差异无显著性意义。本研究中并未涉及到BMP-2 对成人成骨细胞的长期作用,但目前的结果至少可以说明来源于新生儿颅骨的成骨细胞和来源于大鼠乳鼠颅骨的成骨细胞对BMP-2 的反应并不一致,后者BMP-2 作用48 h 后,OCN 含量已明显增加,而前者并无明显变化,提示两者可能在分化程度上不同。
骨形成蛋白-7(bone morphogenetic protein-7,BMP-7)具有较强的骨诱导能力,是骨形成蛋白家族中诱导成骨能力最强的生长因子之一。BMP -7分布范围极其广泛,主要存在于骨,体外实验为在体实验提供了佐证与理论支持。Gu 等[5]在鼠成肌细胞的前体细胞C2C12 培养液中添加BMP -7,结果可引起该细胞由成肌细胞分化途径转变为成骨细胞途径。当BMP-7 浓度在200 μg/L 时,可完全抑制肌小管形成并强烈诱导碱性磷酸酶(ALP)活性,与未处理的对照组相比其ALP 活性升高20 倍。骨特异性转录调节子Runx2/Cbfa1 是成骨细胞分化的分子开关,其mRNA 水平在BMP-7 处理24 h 达到高峰,升高达6 倍。另外,BMP -7 还可使骨钙素mRNA 水平升高55 倍,本实验中BMP -7 虽然对成骨细胞的增殖,成骨细胞ALP 活性和OCN 含量有所增加,但同单独使用BMP-2 效果一致。
ALP 是成骨细胞分化的早期指标,其表达随着细胞分化的发展而增强,其作用是水解有机磷酸释放出无机磷而用于羟磷灰石的形成,是骨形成所必需的酶,它的表达代表着骨形成的状况[6]。ALP 的表达紧接着细胞增殖的下调,代表着细胞分化的开始[7]。骨钙素作为成骨细胞分化的中期指标,有学者认为,骨钙素在维持正常矿化率和抑制软骨的矿化中起作用[8],当骨形成和骨吸收解偶联时,骨钙素是反映骨形成的特异指标,而这3 项指标(细胞的增殖,ALP 活性,骨钙素含量)是检测成骨细胞生物学活性的标志性指标。研究结果表明,联合应用BMP-2 和BMP-7 作用大鼠乳鼠成骨细胞,成骨细胞的增殖MTT(A值),成骨细胞ALP 活性,骨钙素含量都较对照组,BMP-2 组,BMP -7 组有了明显的增加(P <0.05)。结果可能与BMP 的生物学活性有关,BMP 本身就有诱导成骨细胞形成的作用。而其更重要的意义在于:BMP 在骨的发生与修复过程中具有重要作用,因而BMP 在骨科的疾病治疗中具有十分广阔的应用前景,BMP 具有治疗大块骨缺损以及骨不连的功能。除治疗骨缺损和骨不连外,临床上将BMP 用于脊柱融合也取得了很好的疗效,Cook SD 等[9]将BMP 作为骨移植的替代物用于椎体融合,结果显示融合效果良好,且与自体骨移植相比,融合速度更快,融合后脊柱的生物力学稳定性更佳。
联合应用BMP -2 和BMP -7 刺激成骨细胞后,使成骨细胞生物学活性得到显著增强,使得联合应用BMP-2 和BMP-7 对骨组织工程学以及临床上治疗骨缺损,骨折不愈合,促进骨折愈合和脊柱融合提供了依据。
[1] Urist MR. Bone:formation by autoindution[J]. Science,1965,150(3698):893 -899.
[2] Nishimura R,Hata K,Matsubara T,et al. Regulation of bone and cartilage development by network between BMP signalling and transcription factors[J]. J Biochem,2012,151(3):247 -254.
[3] Enomoto-lwamoto M,Iwamoto M,Mukudai Y,et al. Bone morphogenetic proteins ignalingis required form aintenance of differentiat phenotype,control of proliferation and hypertrophyin chondrocytes[J]. J Cell Biol,1998,140(2):409 -418.
[4] El-Hoss J,Sullivan K,Cheng T,et al. A murine model of neurofibromatosis type 1 tibial pseudarthrosis featuring proliferative fibrous tissue and osteoclast-like cells[J]. J Bone Miner Res,2012,27(1):68 -78.
[5] Gu K,Zhang L,Jin T,et al. Identification of potential modifiers of Runx2/Cbfa1 activity in C2C12 cells in response to bone morphogenetic Protein -7[J]. Cells Tissues Organs,2004,176:28 -40.
[6] Chaudhary LR,Spelsbetg TC,Riggs BL. Production of various cytokines by normal human osteoblast - like cells in response to interleukin-1 beta and tumor necrosis factoralpha:lack of reglation by 17 beta-estradiol[J].Endo crinology,1992,130:2528 -2532.
[7] 邓力,郑虎,翁玲玲.用培养成熟大鼠头盖骨的成骨细胞筛选药物[J].华西药学杂志,1998,13(2):85 -87.
[8] 史筱璐,李化静,马艳,等. 小鼠胚胎干细胞向成骨样时段性细胞分化的形态学特点[J]. 中国组织工程研究,2012 (32):5967 -5972.
[9] Cook SD,Tan EH,Dalton JE,et al. In Vivo evalution of the OP-1 implants as a bone graft substitute for spinal fusion[J].Spine,1994,19:1655.
