水难溶性药物硝苯地平固体分散体的制备及体外溶出度研究
2014-03-01薛健飞于世华
王 洁,金 刚,薛健飞,张 扬,于世华,张 艳
(吉林化工学院化学与制药工程学院,吉林吉林132022)
硝苯地平(nifedipine)为二氢吡啶类钙通道阻断剂,是钙拮抗剂中的一种,具舒张外周及冠状动脉的功能[1],由于难溶于水的特性,导致其生物利用度较低,影响临床疗效[2].固体分散体(solid dispersion,SD)是将难溶性药物高度分散在水溶性载体材料中,从而提高药物的溶解度、溶出速率及生物利用度的中间剂型[3-4],近年来该技术已经被广泛使用[5-7].本研究通过将硝苯地平制成固体分散体,以固体分散体中药物的体外溶出度为指标,筛选制备固体分散体最佳辅料及比例.
1 实验材料与方法
1.1 实验药品与仪器
FD-1冷冻干燥机(北京博医康实验仪器有限公司);RCZ-6B2溶出度仪(上海黄海药检仪器有限公司);UV-752N紫外分光光度计(上海申光仪器仪表有限公司);DT-5台式离心机(北京时代北利离心机有限公司);BS-600L电子分析天平(上海精密科学仪器有限公司);;XK-96A快速混匀器(姜堰市新康医疗器械有限公司);79-1磁力加热搅拌器(金坛市中大仪器厂)BPG-9070A电热恒温鼓风干燥箱(上海一恒科学仪器有限公司).
硝苯地平(郑州德宝精细化工有限公司);泊洛沙姆407(湖北兴银河化工有限公司)十二烷基硫酸钠(天津市大茂化学试剂厂);羟丙甲基纤维素(上海晶纯生化科技股份有限公司);聚乙烯吡咯烷酮(上海蓝季科技发展有限公司);甲醇、乙醇为分析纯,水为重蒸馏水.
1.2 实验方法
1.2.1 硝苯地平在不同载体水溶液中的溶解度实验
分别选取Poloxamer407、HPMC、PVPK30精密配制成1%(w/v)的水溶液(10 mL),置入离心管中,将过量的硝苯地平原料药500 mg分别加入到10 mL上述配制的辅料水溶液及蒸馏水中,37℃、100 rpm条件下水浴震荡24h,取出离心,取上清液稀释定容,在333 nm处测紫外吸光度.选取几种可以提高原料药溶解度的载体材料.
1.2.2 硝苯地平速释固体分散体的制备
按一定比例(药物载体 =1 3、1 5、1 7)精密称量硝苯地平原料药及载体,且加入药物与载体总量1%的表面活性剂.首先,将300 mg硝苯地平原料药加入到200 mL丙酮中,用磁力搅拌器搅拌至溶解,溶解完全后加入900 mg载体、12 mg SDS及50 mL蒸馏水,持续搅拌2 h至混合均匀.50℃水浴加热蒸去大部分溶剂后,将剩余溶液放入-82℃超低温冰箱预冻,取出后进行冷冻干燥处理24 h,所得粉末放入45℃烘箱中进一步干燥,所得产物即硝苯地平固体分散体粉末(10份),使用前需进行过筛处理.
1.2.3 物理混合物的制备
按最佳比例(药物 HPMC SDS=30 mg 90 mg 1.2 mg)精密称取药物、载体及表面活性剂,放入保鲜袋中,吹气密封后,放置在混匀器上混匀处理10 min,待用.
1.2.4 溶出度的测定
按药典标准,采用桨法进行溶出度测定,首先将30 mg硝苯地平原料药及含硝苯地平30 mg固体分散体粉末分别加入到已加热至37±0.2℃的900 mL的蒸馏水中,调节搅拌桨速度为100 rpm,分别在 5、10、15、30、45、60、90、120 min 时分别用移液枪吸取5 mL溶液,进行离心处理,取上清液、稀释、定容,在333 nm处测吸光度.
2 结果与讨论
2.1 硝苯地平在不同载体水溶液中的溶解度
从图1中看出,药物在3种载体水溶液的溶解度都高于原料药在水中的溶解度,由此可推断,3种载体都有提高药物水溶性的作用.因此,将分别选用3种载体制备固体分散体来考查药物的溶出度.

图1 硝苯地平原料药在水中及各载体水溶液中的溶解度
2.2 原料药、物理混合物及固体分散体在水中的溶出度
如图2所示,原料药在水中的溶出度极低,在2 h仅能溶出20%左右.而当选用同种比例不同载体制备成固体分散体时,药物的溶出度都有所提高,对比来看,当以HPMC为载体时药物的溶出度最高,在2 h内溶出度可达80%左右,因此选用HPMC为最优载体.

图2 原料药及不同载体(1.PVPK30;2.Poloxamer;3.HPMC)制备的固体分散体(药物载体=1 5)在水中的溶出度曲线
从图3中不同比例HPMC制备的固体分散体中药物的溶出度曲线可以看出,药物的溶出度随着载体使用量的增加,并没有显著的差异,仅在溶出初期,溶出速率随着载体用量的增加速率有所减小,本着尽可能减少使用载体用量的原则,且药物载体=13时溶出初期的溶出度高于其余两组,因此确定药物与载体的最佳比例为1 3.
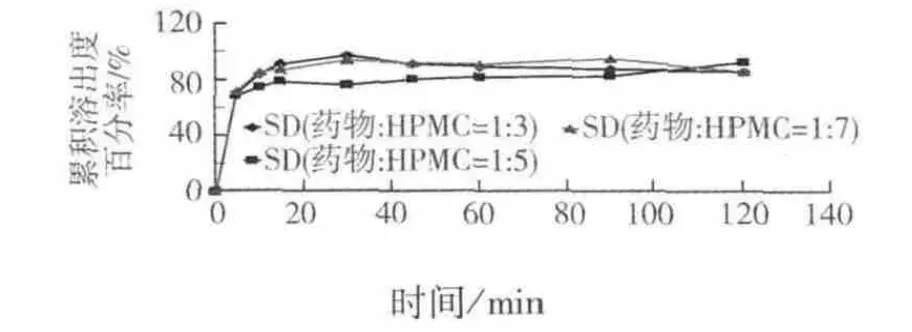
图3 不同比例HPMC制备的固体分散体在水中的溶出度曲线
如图4所示,在制备固体分散体时添加了1%SDS,通过观察溶出度曲线可以看出,当添加SDS时,药物的溶出度较单独使用HPMC制备固体分散体的溶出度得到了进一步提高.在2 h内达到了98%左右,且在10 min时即可达到90%以上,因此,最终确定硝苯地平固体分散体的最优处方为,药物 HPMC SDS=1 3 1%.
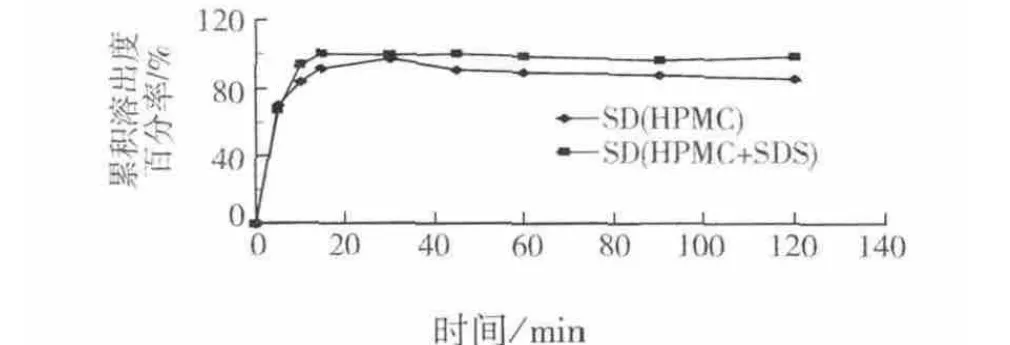
图4 添加SDS的固体分散体在水中的溶出度曲线
图5中,对比硝苯地平原料药、物理混合物(药物 HPMC SDS=30 mg 90 mg 1.2 mg)及固体分散体的溶出度曲线可以看出,固体分散体的溶出度远远高于原料药及其物理混合物.进而表明将水难溶性药物硝苯地平制成速释固体分散体后很大程度上提高了药物的水溶性,而将药物及辅料进行简单的物理混合却不能达到提高水溶性的效果.
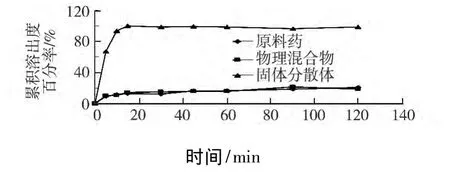
图5 原料药、最优处方的物理混合物及固体分散体在水中的溶出度曲线
3 结 论
实验结果表明,采用溶剂-冷冻干燥法将水难溶性药物硝苯地平制备成固体分散体后,硝苯地平在水中累计溶出度显著提高.主要因为水溶性载体材料不仅可以提高药物的润湿性,还可保证药物的高度分散性,在此基础上添加适量的表面活性剂可以进一步的调节药物的溶出速率.因此,高分子水溶性载体材料与表面活性剂的联合使用可以更好的达到提高药物溶出度的目的.
[1] MinamiJ,NumabeA,AndohN,et al.Comparisonof oncedaily nifedipine controlled-release with twice-2daily nifedipine retard in the treatment of essential hypertension [J].British Journal of Clinical Pharmacology,2004,57(5):632.
[2] Vippagunta SR,Maul KA,Tallavajhala S,et al.Solid-state characterization of nifedipine solid dispersions[J].Int J Pharm,2002,236(1-2):111-123.
[3] Ganesh C,Piyush P,Sharwaree H,et al.Formulation and evaluation of solid dispersions of furosemide in sodium starch glycolate [J].Trop J Pharm Res,2009,8(1):43-51.
[4] 乔艳丽,黄雷鸣,赵 琪,等.溶剂蒸发法和热熔挤出法制备苯扎贝特固体分散体[J].中国医药工业杂志,2011,42(9):660-664.
[5] 王展,韩立炜,任天池.葛根素-聚乙二醇6000固体分散体的制备及其溶解性能的研究[J].北京中医药大学学报,2009,30(5):346-349.
[6] Pokharkar V,Kutwal M,Mandpe L.Pioglitazone solid dispersion system prepared by spray drying method:in vitro and in vivo evaluation[J].PDAJ Pharm Sci Technol,2013,67(1):23-34.
[7] Khan S,Batchelor H,Hanson P,et al.Dissolution rate enhancement in vitro evaluation and investigation of drug release kinetics of chloramphenicol and sulphamethoxazole solid dispersions[J].Drug Dev Ind Pharm,2013,39(5):704-715.
