燃烧轻气炮氢氧燃烧特性详细反应动力学模拟
2014-03-01邓飞张相炎
邓飞,张相炎
(南京理工大学 机械工程学院,江苏 南京210094)
0 引言
美国UTRON 公司[1]从20 纪90年代就已经开始研究燃烧轻气炮发射技术,研究表明,这种新型发射技术所能提供的炮口动能比先进的固体发射药火炮高出至少30%,在火炮射程和发射弹丸质量上有着明显的优势。
UTRON 研究人员[1]使用氢氧8 步简化化学反应模型对45 mm 口径燃烧轻气炮发射弹丸过程进行了数值模拟,结果表明,与使用涡耗散EDM、预混等燃烧模型的计算结果相比,采用详细化学反应模型的压力和温度最大值更高。LIU 等[2]采用氢氧层流燃烧速度拟合公式建立了某燃烧轻气炮氢氧燃烧准维内弹道模型,数值模拟了燃烧轻气炮高压低温氢氧混合气体燃烧内弹道过程,计算结果与实验值符合得较好。
贾明等[3]应用CHEMKIN 化学动力学软件包模拟了正庚烷在HCCI 发动机中的燃烧过程,在正庚烷详细氧化机理中加入氮氧化物的生成机理,将此程序纳入发动机燃烧的零维模型。本文初步尝试将详细的19 步氢氧反应动力学机理应用于某燃烧轻气炮的氢氧燃烧模拟中。以氢气、氧气和稀释气体为燃料气体,建立氢氧燃烧单区模型,编制求解程序,在程序中调用CHEMKIN 化学反应速率子程序[4],对不同参数条件下的氢氧燃烧过程进行了系统的计算,研究分析各参数条件对燃烧轻气炮氢氧燃烧特性以及内弹道性能的影响,为下一步实验研究提供依据。
1 计算模型
1.1 单区模型
根据某燃烧轻气炮高压低温氢氧燃烧的特点,在推导单区模型(把整个燃烧室视为温度、压力和组分分布相同的反应器[5])控制方程时假设:1)燃烧室内质量固定不变,无气体泄露;2)所有气体组分均满足理想气体状态方程;3)温度和压力在整个燃烧室内处处相同,温度和压力仅是时间的函数,其值随着氢氧的燃烧而变化。
根据热力学第一定律和气体状态方程,可推导得

(1)式可以看作为一个由T、vp、lp和Wk组成的、包含K +3 个未知数的一阶非线性方程组,通过指定初始温度和各组分的初始浓度等,可以解得整个燃烧过程中温度和各组分的变化过程,进而由状态方程求得压力变化规律。
1.2 化学动力学模型
近年来对氢氧燃烧化学反应的机理研究越来越多,例如Jochen Strohle 等针对氢气在汽轮机较高压力环境中燃烧提出了一个详细的化学反应机理[6],以便更好地研究氢气燃烧过程。本文采用详细19 步氢氧化学反应机理[7]来描述氢氧燃烧过程。该反应机理由8 种组分和19 个化学反应构成,经过大量研究者的检验,该模型基本与实验结果相符合。其中,气体组分热力学参数通过CHEMKIN 软件数据库获得。
2 模型检验
为检验该单区模型的正确性与合理性,以文献[1]中描述的两次实验为例进行计算对比分析。
文献[1]中的实验装置为长100 倍口径的45 mm氢氧燃烧发射装置,燃烧室容积V=5 000 mL.当弹底压力达到172 MPa 时弹丸开始运动,燃料气体为过量氢气、氧气混合气体,氢氧摩尔比为8∶1,弹丸质量为mp,燃料气体总能量为E,燃烧室最大压力为pmax,弹丸速度为vp.表1为计算结果与实验结果的对比表。
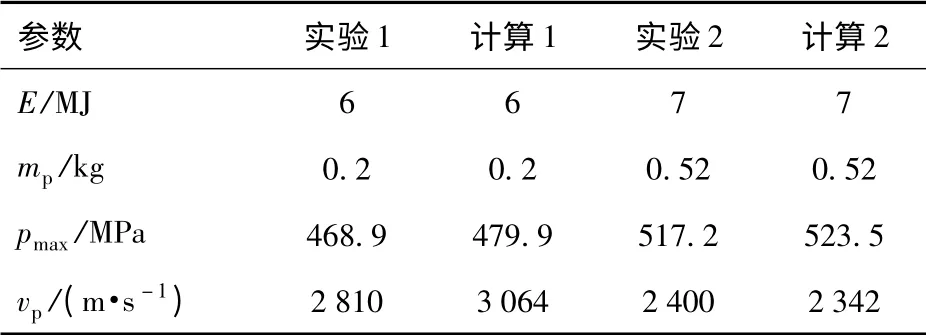
表1 计算结果与实验结果对比Tab.1 Comparison of computed and experimental results
从表1可以看出,计算结果与实验值较为接近,说明该单区模型可以用于计算燃烧轻气炮氢氧燃烧过程,且具有一定的准确性和适用性。
3 计算结果与讨论
为了分析某燃烧轻气炮中高压低温氢氧燃烧特性,以下选择不同参数条件,对氢氧燃烧发射弹丸过程进行系统数值计算,以分析不同参数条件对氢氧燃烧特性和内弹道性能的影响,以及氢氧燃烧过程中各化学组分浓度变化规律。
3.1 初始温度的影响
所有计算都是从点火时刻开始,直至弹丸出炮口。图1显示了在其他条件不变的情况下,改变燃料混合气体初始温度T0时燃烧室内温度的变化情况。

图1 初始温度T0对燃烧室温度的影响Fig.1 Influence of initial temperature on chamber temperatures
从图1可以看出,每当初始温度提高10 K,氢氧气体开始反应燃烧的着火时间依次提前了约0.3 ms,由此可见初始温度对氢氧着火时刻有着重要影响。随着燃烧室温度上升至900 K,氢氧气体立即反应燃烧,燃烧室内温度急剧上升。
图2为在不同初始温度条件下燃烧室内压力的变化曲线。
与燃烧室温度曲线相类似,随着初始温度的提高,燃烧室最大压力峰值出现时刻提前,同时由于发射药总能量E 相同,最大压力峰值相差很小,约为335 MPa.
3.2 燃料加注总质量(初始压力)的影响
在相同的发射药气体组分和燃烧室容积等条件下,可通过改变加注燃料气体总质量m 来增加或降低燃烧室燃料混合气体的初始压力。
图3为改变燃料加注总质量m 对燃烧室压力的影响规律。
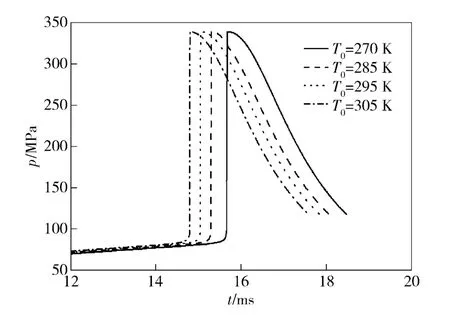
图2 初始温度T0对燃烧室压力的影响Fig.2 Influence of initial temperature on chamber pressures

图3 燃料总质量m 对燃烧室压力的影响Fig.3 Influence of total mass of fuel on chamber pressures
从图3中可看出,随着氢氧燃料加注总质量m的增加,氢氧燃烧着火时刻略有提前,这是因为增加燃料总质量m,在相同的初始温度和气体组分条件下,相当于增加了各组分的浓度,而在高温阶段的着火时刻,浓度的变化对化学反应的影响作用是非常重要的。当m 为400 g 时,燃烧室最大压力值约为275 MPa,当m 提高至550 g,初始压力增大,燃烧室最大压力值上升至375 MPa,同时压力下降速度也更大,这主要与弹丸速度的相应增大有关。
图4为改变燃料总质量m 时,氢氧燃烧过程中燃烧室温度变化曲线。
从图4中可知,混合气体的初始温度相同,随着点火过程的进行,燃烧室温度以相同的速率缓慢上升,当温度达到着火点时,氢氧气体迅速反应燃烧,燃烧室温度急剧上升。增大燃料加注总质量m 使氢氧燃烧着火时刻提前,但燃烧室内最高温度值与其他条件相差很小,这对于提高燃烧室压力同时不增加最高火焰温度有着重要意义。
图5为燃烧室装填不同的氢氧燃料总质量m时弹丸速度的变化曲线。
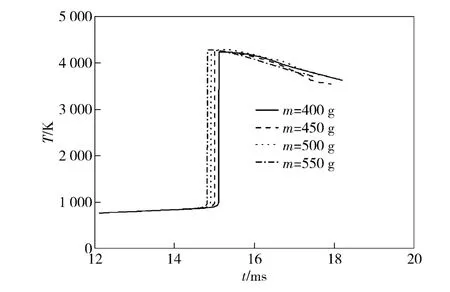
图4 燃料总质量m 对燃烧室温度的影响Fig.4 Influence of total mass of fuel on chamber temperatures
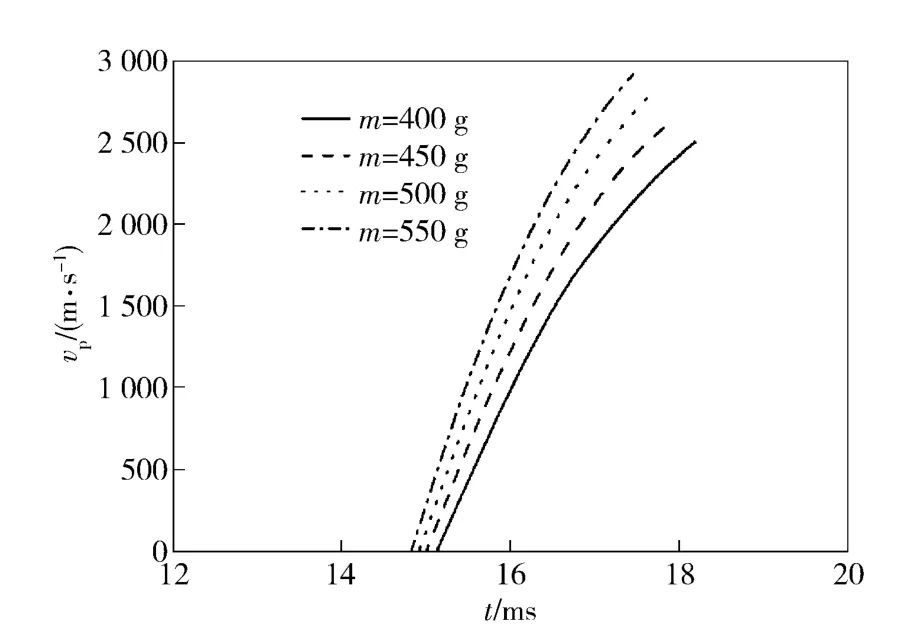
图5 燃料总质量m 对弹丸速度的影响Fig.5 Influence of total mass of fuel on projectile velocities
由图5可知,增加燃料气体加注总质量m,提高了初始压力,明显提高了弹丸速度,当燃料气体加注总质量m 从400 g 增加到550 g 时,弹丸速度从2 506 m/s增加到2 919 m/s.
3.3 稀释气体成分的影响
燃烧轻气炮氢氧燃料气体中通常会添加适量的稀释气体,以控制氢氧燃烧速率以及燃烧室内温度、压力波动等。稀释气体成分一般为过量的氢气或者氦气。为了分析选用不同稀释气体对氢氧燃烧特性的影响,分别计算了过量氢气和氦气作为稀释气体时氢氧燃烧过程,其中过量氢气中氢氧摩尔比为4∶1,氦气稀释时氢氧氦摩尔比为2∶1∶2,其他条件不变。
图6为分别采用过量氢气和氦气作为稀释气体时燃烧室内温度变化曲线。从图中可以看出,采用氦气作为稀释气体时,燃烧室温度上升速度更快,在15 s 时达到氢氧着火温度开始反应燃烧,温度直线上升。当采用过量氢气作为稀释气体时,着火温度延迟至18.2 ms.同时,采用氦气稀释气体时燃烧室最大火焰温度值比采用氢气时高,最大温度提高了近200 K.产生这一现象的原因是主要是氦气的比热值比氢气低。
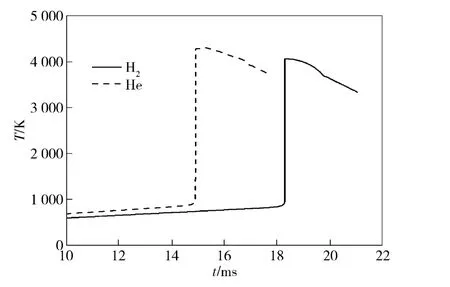
图6 稀释气体成分对燃烧室温度的影响Fig.6 Influence of diluents composition on chamber temperatures
3.4 稀释气体比例的影响
通过改变稀释气体的摩尔比来计算分析稀释气体含量对燃烧轻气炮氢氧燃烧特性及内弹道性能的影响。计算的发射药气体化学组成为2H2+ O2+xHe,其中稀释气体氦气的比例x 分别取1、2、3、4.
图7为加入不同比例的氦气稀释气体时燃烧室温度变化曲线。
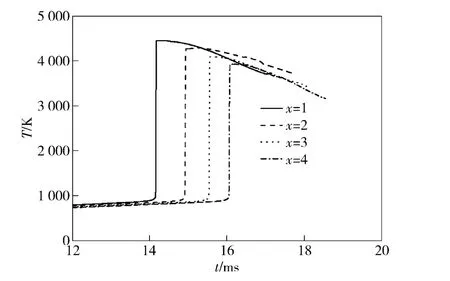
图7 稀释气体比例对燃烧室温度的影响Fig.7 Influence of diluents ratio on chamber temperatures
从图7中可知,随着稀释气体摩尔比的增加,燃烧室温度上升速度减缓,氢氧燃烧着火时间延迟,同时燃烧室内最高温度值减小。当x=1 时,燃烧室最高温度约为4 500 K,当x=4 时,燃烧室最高温度减小至3 928 K,这主要是因为稀释气体氦气起着稀释氢氧气体组分浓度,吸收燃烧热量的作用。
图8为采用不同比例的稀释气体时燃烧室内压力变化曲线。从图中可以看出,在相同的发射药能量和燃烧室容积时,随着稀释气体比例增大,燃烧室初始压力和最大压力值相应提高。当x=4 时,燃烧室最大压力值为424 MPa,远大于x =1 时的压力峰值285 MPa.
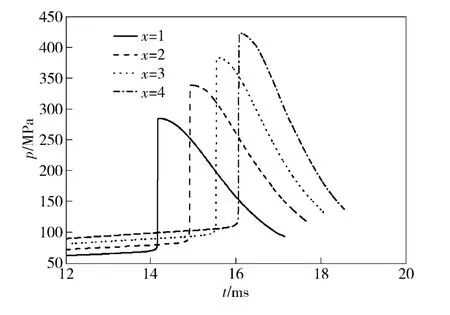
图8 稀释气体比例对燃烧室压力的影响Fig.8 Influence of diluents ratio on chamber pressures
图9为采用不同比例的稀释气体时弹丸速度的变化规律。
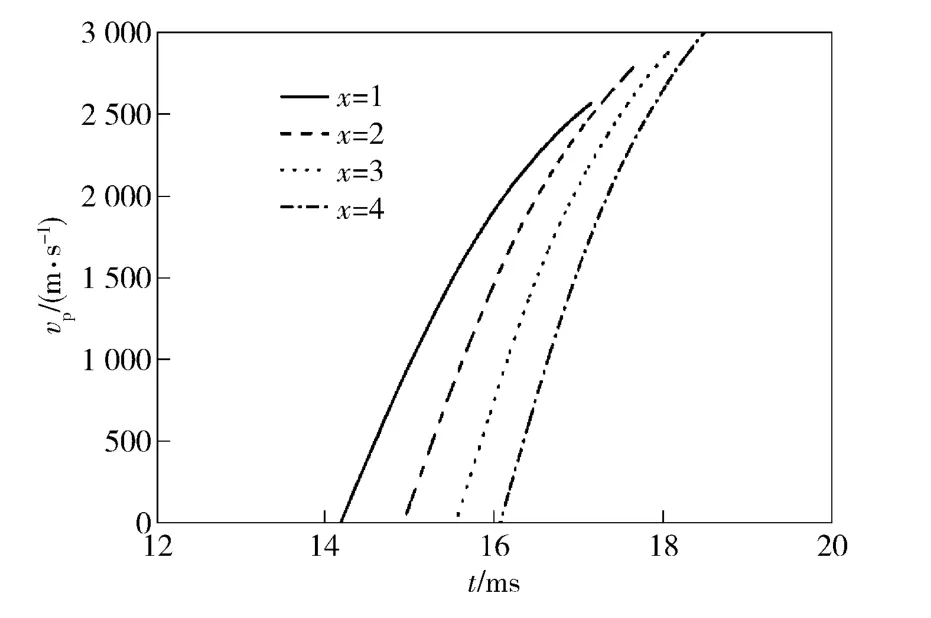
图9 稀释气体比例对弹丸速度的影响Fig.9 Influence of diluents ratio on projectile velocities
如图9中所示,随着稀释气体比例的增加,弹丸开始启动的时刻延迟,同时由于燃烧室内最大压力的增加,弹丸速度增大,x =1 时,弹丸速度为2 569 m/s,当x=4 时,弹丸速度增加至3 044 m/s。
由上述可以得知,合理地增加稀释气体比例,既可以降低燃烧室最大温度,又能够提高燃烧室最大压力值,增大弹丸初速,进而提高燃烧轻气炮氢氧燃烧特性及相应的内弹道性能。
3.5 燃烧过程中各化学组分的变化
氢氧燃烧19 步详细化学反应机理中包含有8 个不同的组分,分别为H2,O2,H,O,OH,HO2,H2O2,H2O.图10为在初始温度T0=300 K,氢氧氦摩尔比为2∶1∶2时燃烧室内温度和主要的反应物、生成物摩尔浓度变化曲线。

图10 温度和反应-生成物摩尔浓度随时间变化曲线Fig.10 Temperature and main reactant-product mole concentration versus time
如图10中所示,在燃烧室温度达到着火温度前,氢气和氧气没有发生反应,其摩尔浓度几乎不变。在15 ms 时,氢氧气体开始反应燃烧,H2O 的摩尔浓度直线上升,H2和O2的摩尔浓度急速下降,弹丸出炮口时燃烧室内依然存在少量的未燃烧完的H2和O2,氢氧燃烧瞬间放出大量的热量,燃烧室温度迅速上升至4 286 K.
图11为氢氧燃烧过程中燃烧室温度和过氧化氢H2O2和HO2摩尔浓度的变化曲线。

图11 温度和H2O2、HO2摩尔浓度随时间变化曲线Fig.11 Temperature and H2O2,HO2 mole concentration versus time
从图11中可知,随着温度的逐渐上升,在t =13.6 ms 时,氢氧混合气体燃烧的部分基元反应开始,H2O2摩尔浓度逐渐增加,在着火时刻时达到最大值。当温度继续上升至900 K 时,H2O2迅速分解成OH 根,H2O2浓度直线下降。如图12中所示,此时OH 根的摩尔浓度直线上升,OH 根的加入使得氢氧混合气体的燃烧反应速率加快。在图11中,t=14 ms 时燃烧室内HO2浓度开始缓慢增加,基元反应H + O2+ M = HO2+ M 变得活跃,此时生成H2O2的部分基元反应及逆反应开始起作用,H2O2和HO2摩尔浓度逐渐增大,并在着火时刻达到最大值。过氧化氢H2O2的分解反应是高温阶段中最为重要的一个反应,此反应放出大量的热量。H2O2和OH的形成和转化分解过程对氢氧气体反应燃烧起到了非常重要的作用。

图12 温度和OH 根摩尔浓度随时间变化曲线Fig.12 Temperature and OH mole concentration versus time
4 结论
通过使用氢氧详细反应动力学机理,建立燃烧轻气炮高压低温氢氧燃烧的单区模型,模拟燃烧轻气炮氢氧燃烧发射弹丸过程,分析了各参数条件对氢氧燃烧特性及内弹道性能的影响,主要结论如下:
1)初始温度对氢气着火时刻有着显著的影响,在其他条件相同的情况下,初始温度对燃烧室最大温度和最大压力值影响不明显。
2)提高燃料气体加注总质量,增大初始压力,可以使氢氧着火时刻略微提前,并提高燃烧室最大压力值和弹丸初速,但对燃烧室内温度影响不大。
3)与氢气相比,采用氦气作为稀释气体会使燃烧室温度最大值增大,氢氧着火时刻提前。
4)增加发射药气体中稀释气体的比例,可以降低燃烧室温度,提高燃烧室压力峰值和弹丸速度,合理的稀释气体比例对提高燃烧轻气炮内弹道性能有着重要作用。
5)H2O2的快速分解过程放出大量热量,H2O2和OH 的形成和转化对氢氧反应燃烧起到了非常重要的作用。
References)
[1] Kruczynski D,Massey D.Combustion light gas gun technology demonstration,ADA462130[R].Arlington,VA,US:Office of Naval Research,2007.
[2] LIU Ning,ZHANG Xiang-yan.Quasi-dimensional interior ballistic model and numerical simulation of combustion light gas gun[C]∥Proceedings of the 26th International Symposium on Ballistics.Miami,US:IBC,2011:625 -632.
[3] 贾明,解茂昭.均质压燃发动机燃烧特性的详细反应动力学模拟[J].内燃机学报,2004,22(2):122 -128.JIA Ming,XIE Mao-zhao.The simulation of HCCI engine combustion using detailed chemical kinetics model[J].Transactions of CSICE,2004,22(2):122 -128.(in Chinese)
[4] Kee R J,Rupley F M,Meeks E.Chemkin-Ⅲ:a FORTRAN chemical kinetics package for analysis of gas phase chemical and plasma kinetics,SAND96-8216[R].Livermore,CA,US:Sandia National Laboratories,1996.
[5] 解茂昭.内燃机计算燃烧学[M].大连:大连理工大学出版社,2005.XIE Mao-zhao.Combustion engine calculations[M].Dalian:Dalian University of Technology Press,2005.(in Chinese)
[6] Ströhle J,Myhrvold T.An evaluation of detailed reaction mechanisms for hydrogen combustion under gas turbine conditions[J].International Journal of Hydrogen Energy,2007,32(1):125 -135.
[7] Li J,Zhao Z,Kazakov A,et al.An updated comprehensive kinetic model of hydrogen combustion[J].International Journal of Chemical Kinetics,2004,36(10):566 -575.
