原生质体激光诱变选育假白布勒弹孢酵母辅酶Q10高产菌株
2014-03-01赵有玺罗忠智冀颐之北京联合大学生物化学工程学院北京100023
赵有玺,龚 平,罗忠智,冀颐之(北京联合大学生物化学工程学院,北京100023)
原生质体激光诱变选育假白布勒弹孢酵母辅酶Q10高产菌株
赵有玺,龚 平,罗忠智,冀颐之*
(北京联合大学生物化学工程学院,北京100023)
对一株产辅酶Q10的菌株假白布勒弹孢酵母BUQ-3进行了原生质体制备、再生及激光诱变育种的研究。结果显示假白布勒弹孢酵母BUQ-3原生质体形成及再生的最佳条件为:菌龄26h,蜗牛酶浓度2g/L,酶溶液pH7.5,酶解温度25℃,酶解时间1.5h。He-Ne激光诱变的最佳诱变时间为4.5min。以色素突变型为筛选模型,经激光诱变,获得具有遗传稳定特性的高产突变株BUQJ-012,其辅酶Q10产量比亲本株提高了87%,达到1.53mg/L。
假白布勒弹孢酵母,辅酶Q10,原生质体,激光,诱变选育
辅酶Q10(CoQ10)是一种存在于动、植物及微生物中的脂溶性醌类化合物,具有细胞抗氧化[1]、阻止细胞凋亡[2]、辅助线粒体膜质子梯度解偶联[3]、增强免疫系统的消炎功能[4]等重要的生理作用,广泛的应用于药品、食品、化妆品等领域[5-7]。
辅酶Q10可由动植物组织提取法、化学合成法和微生物发酵法三种生产方法获得[8],其中利用微生物发酵生产辅酶Q10具有原料成本低、无光学异构体,生物学活性高,临床应用效果好,可实现规模化生产等优势,目前已成为最具发展潜力的辅酶Q10生产方法[9]。然而,微生物发酵法中存在的最大问题是:发酵菌株普遍不能积累高水平辅酶Q10、发酵产率低、生产成本高[10]。通过从自然界中筛选高产辅酶Q10菌株,并对其代谢途径进行研究,通过诱变育种和基因工程手段提高菌株的产量成为目前研究的热点[11-12]。由于辅酶Q10合成途径复杂,基因工程高产菌株的构建至今尚未取得突破性进展[13]。因此,采用传统的物理或化学方法进行诱变育种,仍是提高辅酶Q10产量较为有效的途径[14]。
原生质体激光诱变技术是一种重要的工业微生物育种技术。原生质体因失去了细胞壁的保护而对外界刺激更为敏感,从而更易显现诱变的生物学效应,有利于高产菌株筛选。激光诱变技术是一种新型的诱变技术,在微生物诱变研究上取得了较好的结果[15]。目前,利用原生质体激光诱变技术选育高产辅酶Q10菌株的研究还未见报道。本文探讨了假白布勒弹孢酵母原生质体制备及再生条件,并对原生质体激光诱变条件进行了研究,以表型效应-色素突变株作为辅酶Q10高产菌的筛选模型进行筛选,以期为辅酶Q10的原生质体激光育种工作提供一定的理论依据及实验方法。
1 材料与方法
1.1 材料与仪器
假白布勒弹孢酵母(Bullera pseudoalba)BUQ-3本实验室保藏;CoQ10标准样品 Sigma公司;蜗牛酶、β-巯基乙醇 北京欣经科生物技术有限公司;EDTA·Na2北京北化精细化学品有限责任公司;蛋白胨、酵母浸粉 北京奥博星生物技术有限责任公司;Tris 北京赛百盛基因技术有限公司;焦性没食子酸 广西汕头市西陇化工厂。
SJ-8型He-Ne激光器 河北迪生医疗器械有限公司;SP-2000UV型紫外可见分光光度计 上海光谱仪器有限公司;5810R型高速离心机 eppendorf;R-201型旋转蒸发仪 上海申顺生物科技有限公司。
1.2 培养基
1.2.1 种子培养基(g/L) 葡萄糖10,酵母浸粉5,蛋白胨10,pH6.0。
1.2.2 发酵培养基(g/L) 葡萄糖10,酵母浸粉5,蛋白胨5,K2HPO40.5,KH2PO40.5,MgSO4·7H2O 0.3,pH自然。
1.2.3 再生培养基(g/L) 葡萄糖10,酵母浸粉5,蛋白胨10,蔗糖100,琼脂粉20,pH6.0。
1.3 试剂制备
1.3.1 0.5mol/L EDTA溶液 在800mL水中加入186.1g EDTA-Na2·2H2O,在磁力搅拌器上剧烈搅拌,用NaOH调节溶液的pH至8.0,然后定容至1L。
1.3.2 ST溶液 蔗糖171.15g/L,MgCl2·6H2O 2.03g/L,Tris 1.21g/L,用0.1mol/L的HCl调节pH,灭菌后备用。1.3.3 STC溶液 ST溶液中加入CaCl21.11g/L,灭菌后备用。
1.3.4 蜗牛酶液 按一定比例将蜗牛酶溶于10mL ST溶液中,并用微孔滤膜过滤除菌。
1.3.5 前处理液 10mL 0.05mol/L EDTA溶液中加入14滋L β-巯基乙醇。
1.4 实验方法
1.4.1 摇瓶培养 将假白布勒弹孢酵母斜面菌种取一环接种至种子培养基中,种子培养基装液量为250mL三角瓶装50mL,27℃,200r/min,振荡培养1d。然后再将其转接至发酵培养基中,发酵培养基装液量为250mL三角瓶装50mL,接种量5%,27℃,200r/min,振荡培养2d。
1.4.2 辅酶Q10的提取 10000r/min,10min离心收集菌体,生理盐水洗涤2次,采用皂化法[16]进行辅酶Q10提取。
1.4.3 紫外分光光度法测定辅酶Q10含量
1.4.3.1 标准曲线绘制 称取1mg辅酶Q10标准品,用无水乙醇定容至100mL,配成质量浓度为10滋g/mL的标准溶液。分别移取0.5、1、1.5、2、2.5、3、3.5、4、4.5、5mL标准溶液定容至10mL,在辅酶Q10最大吸收波长275nm处测定其吸光度值。
1.4.3.2 辅酶Q10质量浓度的测定 在275nm处测定辅酶Q10提取液的吸光度值,并根据标准曲线计算出相应的辅酶Q10含量。
1.4.4 生长曲线的测定 按方法1.4.1进行摇瓶培养,每隔一段时间取样,菌液经适当稀释后,以空白培养基为对照,在560nm下测定其吸光度,并根据吸光度绘制假白布勒弹孢酵母生长曲线。
1.4.5 原生质体的制备与再生 3500r/min离心10min收集培养至对数期的菌体,生理盐水离心洗涤2次,将细胞悬浮于10mL前处理溶液中,恒温水浴30℃振荡处理10min。前处理后菌液适当稀释,涂布平板,记录细胞菌落数A。将前处理后的菌液3500r/min离心10min收集菌体。方法同前面描述,将菌体悬浮于一定浓度和pH的蜗牛酶溶液中,水浴振荡进行酶解。酶解后3000r/min离心10min收集细胞备用。一组酶解细胞,用ST溶液离心洗涤后重悬于ST溶液中,经无菌水适当稀释后,涂布于固体培养基平板上,27℃培养2~3d,待菌落形成后,记录未形成原生质体的菌落数B,计算原生质体形成率,见式(1)。另一组酶解细胞,用STC溶液离心洗涤后重悬于STC溶液中,STC溶液适当稀释后,取0.1mL稀释液加入45~50℃再生培养基软琼脂中,摇匀后迅速倒入再生固体培养基平板上,27℃倒置培养2~3d,形成菌落即为原生质体再生菌落及未形成原生质体的菌落之和C。计算原生质体的再生率,见式(2)。

1.4.6 原生质体的制备与再生条件优化实验
1.4.6.1 不同酶浓度实验 将前处理后的菌体分别悬浮于浓度为0.5、1、1.5、2、2.5g/L的蜗牛酶溶液中,pH7,30℃水浴振荡,酶解1h。酶解后,进行原生质体的再生,并计算原生质体的形成率和再生率。
1.4.6.2 不同酶溶液pH实验 将前处理后的菌体分别悬浮于酶溶液pH为6.0、6.5、7.0、7.5的2g/L的蜗牛酶溶液中,30℃水浴振荡,酶解1h。酶解后,进行原生质体的再生,并计算原生质体的形成率和再生率。
1.4.6.3 不同酶解温度实验 将前处理后的菌体悬浮于2g/L的蜗牛酶溶液中,pH7.5,水浴温度20、25、30、35℃,振荡酶解1h。酶解后,进行原生质体的再生,并计算原生质体的形成率和再生率。
1.4.6.4 不同酶解时间实验 将前处理后的菌体悬浮于2g/L的蜗牛酶溶液中,pH7.5,25℃水浴振荡,酶解时间分别为1、1.5、2、2.5、3、3.5、4h。酶解后,进行原生质体的再生,并计算原生质体的形成率和再生率。
1.4.7 He-Ne激光诱变时间的确定 开启He-Ne激光,将功率调节至12W,预热30min后,将装有200滋L假白布勒弹孢酵母原生质体悬液的试管垂直置于激光照射镜头上,进行激光诱变,诱变时间分别为:1.5、3.0、4.5、6.0、7.5、9.0min。诱变后,进行原生质体的再生培养,计算致死率,见式(3)。
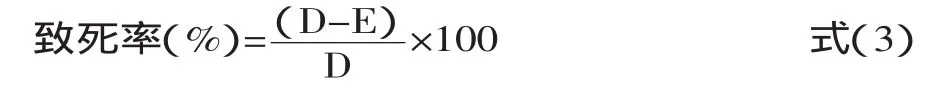
其中,D为未诱变对照组在再生平板上的菌落,E为激光诱变组在再生平板上的菌落数。
1.4.8 激光诱变及突变株的筛选 在最佳诱变时间下对假白布勒弹孢酵母原生质体进行He-Ne激光诱变。诱变后进行原生质体的再生培养,观察再生菌落的颜色变化,选择颜色发生变化的菌落,即色素突变型作为初筛对象,分别进行摇瓶发酵实验,提取胞内辅酶Q10并进行含量的检测。
1.4.9 遗传稳定性实验 将复筛获得的高产菌株斜面传10代,考察其菌落颜色变化情况,同时进行摇瓶发酵,检测胞内辅酶Q10含量,以确定其遗传稳定性。
2 结果与讨论
2.1 辅酶Q10标准曲线绘制
按照方法1.4.3,根据不同质量浓度的辅酶Q10标准溶液在275nm处的吸光度绘制标准曲线,见图1。其线性回归方程为y=0.47958x+0.01602,相关系数为R2=0.99919。

图1 辅酶Q10标准曲线Fig.1 Standard curve of coenzyme Q10
2.2 假白布勒弹孢酵母原生质体的制备
2.2.1 制备原生质体最佳菌龄的确定 由图2可知,假白布勒弹孢酵母0~4h为其延滞期,菌体生长处于静止状态,菌数增幅较小,此期菌体正在合成生长所需酶类;4~26h菌体生长旺盛,OD值呈指数增加,此期为菌体对数生长期;26~50h OD值在一定范围趋于平稳,菌体达到稳定期;50h后生长曲线呈迅速下降趋势,菌体进入衰亡期。
制备原生质体时,处于不同生长时期的菌体,对各种溶壁酶的敏感性不同,菌龄过短,可制备原生质体菌量过少,原生质体形成率较低;菌龄过大,酶解效果较差,不宜形成原生质体。本实验选择假白布勒弹孢酵母菌体对数期中后期,菌龄为26h的菌体进行原生质体制备,此时菌体生长旺盛,菌量多,对溶壁酶较敏感,易形成原生质体。

图2 假白布勒弹孢酵母的生长曲线Fig.2 Growth curve of Bullera pseudoalba
2.2.2 酶浓度对原生质体制备及再生的影响 考察不同浓度蜗牛酶对假白布勒弹孢酵母原生质体形成及再生的影响,结果如图3所示。假白布勒弹孢酵母原生质体的形成率随酶浓度的增大而逐渐升高,蜗牛酶酶浓度为2g/L时,其原生质体的形成率最高,可达到25.53%。而再生率却随着酶浓度的升高变化不大,基本处于21%~22%之间。综合考虑原生质体的形成率和再生率,确定2g/L蜗牛酶浓度为最佳酶解浓度。

图3 酶浓度对原生质体制备及再生的影响Fig.3 Effect of snail enzyme content on protoplast preparation and regeneration
2.2.3 pH对原生质体制备及再生的影响 考察pH对原生质体制备及再生的影响。结果如图4所示,假白布勒弹孢酵母原生质体的形成率是随pH变化呈抛物线状,酶溶液pH为7.0时原生质体的形成率最高,达到22.79%,pH为6.5和7.5时形成率相近,分别为20.69%和20.41%;pH为6.0时,形成率最低为19.72%。而假白布勒弹孢酵母原生质体的再生率却在pH7.5时最高,达到23.33%。分析原因可能是pH为7时,酶解作用较强,原生质数形成率较高。但此时细胞脱壁太彻底,失去了细胞壁再生的基础,因此导致了较低的再生率。综合考虑原生质体形成率和再生率,选择两者乘积最大值的pH7.5为最佳酶解条件。
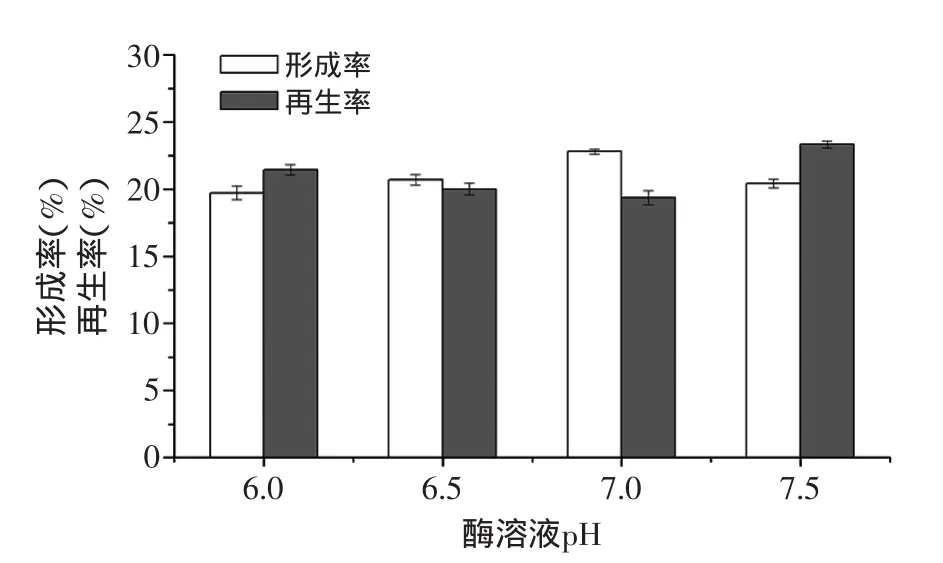
图4 酶溶液pH对原生质体制备及再生的影响Fig.4 Effect of enzyme system pH on protoplast preparation and regeneration
2.2.4 酶解温度对原生质体制备及再生的影响 考察了不同温度对假白布勒弹孢酵母原生质体制备及再生的影响。结果如图5所示,酶解温度为25℃和30℃时原生质体的形成率较高,分别达到22.7%和22.97%。酶解温度为20℃和35℃时,原生质体的形成率却有所下降,在20%左右。原生质体的再生率在35℃时最高,为23.33%。分析原因可能是因为25~30℃为酶解的最适温度,因此酶解更彻底,形成的原生质体数较多。但同样最适的酶解作用对原生质体细胞壁结构破坏较大,从而导致了较低的再生率。综合考虑原生质体形成率和再生率,选择25℃为最佳酶解温度。
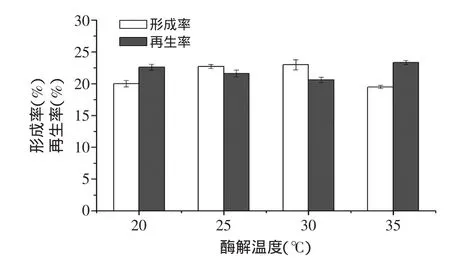
图5 酶解温度对原生质体制备及再生的影响Fig.5 Effect of enzymolysis temperature on protoplast preparation and regeneration
2.2.5 酶解时间对原生质体制备及再生的影响 酶解时间对原生质体制备的质量和产量是较为重要的因素,酶解时间过短,原生质体形成不完全,酶解时间过长,对细胞壁结构造成破坏,导致原生质体的再生率下降。不同酶解时间实验结果如图6所示,假白布勒弹孢酵母原生质体的形成率是随酶解时间的增加呈现缓慢上升的趋势,酶解3.5h时其原生质体形成率达到最大值26.7%。原生质体的再生率随着酶解时间的延长而出现缓慢下降的趋势。基于兼顾原生质体的形成率和再生率的原则,选择1.5h为其最佳酶解时间,此条件下原生质体的形成率为25.6%,再生率为22.8%。

图6 酶解时间对原生质体制备及再生的影响Fig.6 Effect of enzymolysis time on protoplast preparation and regeneration
2.3 假白布勒弹孢酵母原生质体激光诱变
2.3.1 He-Ne激光诱变时间的确定 选择不同诱变时间对假白布勒弹孢酵母原生质体进行He-Ne激光诱变,实验结果如图7所示。通常认为宜选择致死率在70%~80%的诱变剂量,在此剂量范围内,虽产量提高幅度较小,但正突变几率较大。He-Ne激光诱变工作剂量为4.5min时假白布勒弹孢酵母原生质体的致死率为77%,因此确定4.5min为He-Ne激光诱变最佳诱变时间。

图7 假白布勒弹孢酵母原生质体激光诱变致死率Fig.7 The mortality rate of the protoplast of Bullera pseudoalba induced by He-Ne laser
2.3.2 He-Ne激光诱变及突变株筛选 假白布勒弹孢酵母原生质体经He-Ne激光诱变后,获得色素突变菌株31株。摇瓶复筛测定其胞内辅酶Q10含量,获得4株辅酶Q10高产突变菌株。实验结果如表1所示,其中突变菌株BUQJ-012胞内辅酶Q10含量最高,达到1.53mg/L,较出发菌株BUQ-3提高了87%。分析原因可能是由于激光辐照使亲本株代谢途径发生改变[17-18]。辅酶Q10和类胡萝卜素的微生物合成途径中都存在一个相同的聚异戊二稀长链的合成途径,因此理论上若诱变使胡萝卜素和辅酶Q10相同合成途径中的前体物质增加,则可促进两者产量的增加;而若能阻断两者相同合成途径后的胡萝卜素的合成途径的物质的生成,则也能对辅酶Q10的合成产生积极的影响[19]。代谢途径的改变直接导致色素产物积累量的变化,表观则表现为菌落颜色的改变。本实验野生菌株呈深黄色,激光诱变之后可获得红色、粉色、橙色、白色等色素突变株,所获得的辅酶Q10高产突变菌株BUQJ-012为橙色突变株。

表1 突变株辅酶Q10产量Table 1 The coenzyme Q10production of mutant
2.3.3 遗传稳定性研究 选择突变菌株BUQJ-012进行遗传稳定型实验,将BUQJ-012连续传代10次,分别测定其胞内辅酶Q10含量,考察突变株的稳定性。所得结果如表2所示,突变株BUQJ-012胞内辅酶Q10含量维持在1.53mg/L左右,菌体形态未发生变异,表明He-Ne激光诱变所获得的高产突变株BUQJ-012具有良好的遗传稳定性。
3 结论
本研究对辅酶Q10生产菌株假白布勒弹孢酵母原生质体制备及再生条件进行了优化。选择26h为假白布勒弹孢酵母菌体进行原生质体制备的最佳菌龄;蜗牛酶浓度2g/L,酶溶液pH7.5,酶解温度25℃,酶解时间1.5h为最优酶解条件。为制备大量的假白布勒弹孢酵母原生质体以用于其菌种性能的改造奠定了良好的实验基础。
Breeding of the coenzyme Q10producing strain Bullera pseudoalba by laser induced protoplast mutagenesis
ZHAO You-xi,GONG Ping,LUO Zhong-zhi,JI Yi-zhi*
(Biochemical Engineering College,Beijing Union University,Beijing 100023,China)
The conditions of protoplast formation,regeneration and laser mutagenesis of Bullera pseudoalba BUQ-3strain were studied.As a result,the optimal conditions for protoplast preparation and regeneration of Bullera pseudoalba BUQ-3strain were showed as follows:26h of cell growth time,the content of snail enzyme was 2g/L,the pH of enzyme system was 7.5,enzymolysis temperature was 25℃,enzymolysis time was 1.5h. The optimal time of Laser induced was 4.5min.The coenzyme Q10high yield mutant strain with good genetic stability,numbered BUQJ-012,was obtained based on pigment mutants.Its coenzyme Q10yield was up to 1.53mg/L,which was 87%higher than that of the parent strain.
Bullera pseudoalba;coenzyme Q10;protoplast;laser;mutation breeding
TS201.2
A
1002-0306(2014)14-0230-05
10.13386/j.issn1002-0306.2014.14.042
2014-04-18 *通讯联系人
赵有玺(1979-),男,硕士研究生,讲师,主要从事工业微生物方面的研究。
北京市优秀人才培养资助项目(2012D005022000007);启明星大学生科技创新项目(201411417SJ085)。
