响应曲面法优化三七根多酚的提取工艺
2014-03-01朱素英菏泽学院生命科学系山东菏泽274015
朱素英(菏泽学院生命科学系,山东菏泽274015)
响应曲面法优化三七根多酚的提取工艺
朱素英
(菏泽学院生命科学系,山东菏泽274015)
目的:为探明三七根多酚的优化提取工艺。方法:在单因素实验基础上,选取提取温度、提取时间、乙醇浓度三因素,用Design Expert软件采用响应曲面的Box-Behnken设计进行实验设计和分析,得到三因素以及之间的交互作用对三七根多酚得率影响的多元回归模型、响应曲面图及等高线图。结果:三七多酚提取的最佳条件为:乙醇浓度62%、温度58℃、提取时间45min、多酚得率36.924mgGAE/g。结论:在最佳条件下三七根多酚得率的实验值达到预测值的98.35%,说明结果可靠,可做为三七根多酚的提取最优条件。
三七根,多酚,响应曲面,提取工艺
三七(Panax notoginseng(Burk)F.H.Chen),又名田七、金不换、南国神草等,三七隶属五加科人参属,三七根为我国名贵传统药材[1],具有止血、滋补、增强免疫力等功效[2],同时三七根亦广泛应用于烹饪、保健品行业。多酚在植物中广泛分布,具有较强的清除自由基[2]、抗氧化活性[3]、保护心脑血管系统、抗肿瘤以及预防神经退行性疾病等[4]的能力,前期研究表明[5],三七含有丰富的多酚类物质,具有较强的清除自由基的能力。但对于三七多酚提取工艺优化尚未见报道。响应曲面法(Response surface methodology,RSM)能够评价各提取因素对化学物质提取量的影响,以及各因素间相互关系[6]。RSM实验周期短,回归方程的精度高,并能同时研究几种因素间的交互作用等[7-8]。目前,RSM已成功应用于多酚等天然化合物的提取[9-10],如蓝莓渣[11]、南瓜果肉[12]等多种植物多酚的提取。本工作拟在单因素的基础上,利用响应曲面法对三七多酚进行提取优化,考察不同提取条件对多酚提取率的影响,以期为三七进一步开发利用提供依据。
1 材料与方法
1.1 材料与仪器
三七根 购于菏泽青年药店,经菏泽学院植物学教研室鉴定为三七(Panax notoginseng(Burk)F.H. Chen)的三年生干燥根;Folin-Ciocalteu试剂 上海荔达有限公司;没食子酸、甲醇等 均为分析纯。
TU-1810型紫外可见分光光度计 北京普析通用仪器有限责任公司;DZF-6050型真空干燥箱 上海博讯实业公司;FW-100型高速万能粉碎机 北京市永光明医疗仪器厂;HH-8型数显恒温水浴锅 江苏省金坛市江南仪器厂。
1.2 实验方法
1.2.1 三七根多酚提取流程 称取三七根40g,粉碎过40目筛,真空干燥箱中干燥至恒重,取1g粉末,置于三角烧瓶中,保鲜膜封口,置于水浴锅中,按照实验设计条件进行提取,提取重复两次合并三次提取液,得总多酚提取液,定容至30mL,4℃保存备用。
1.2.2 多酚含量的测定 多酚含量的测定采用Folin-Ciocalteu法[13],取1mL提取液,加入5mL的稀释10倍福林酚,摇匀,反应5min,再加入4mL的7.5%Na2CO3,定容至10mL,摇匀,在室温下放置60min,765nm测定吸光值,先以没食子酸作为标准物,制作多酚回归曲线:y=8.0213x+0.047;R2=0.9961,y为吸光度,x为没食子酸浓度(mg/g),线性关系良好,根据回归方程,和测定的多酚吸光度,计算出三七根提取液多酚的没食子酸当量浓度(mgGAE/g)。
三七根多酚的得率(mgGAE/g)=(多酚浓度×提取液定容后体积)/三七根粉末干质量
1.2.3 单因素实验及响应曲面设计 选取单因素:提取溶剂(醇、乙醇、水;固定条件:料液比1∶10、温度80℃、时间60min);乙醇浓度(10%、30%、50%、70%、90%;固定条件:料液比1∶10、温度80℃、时间60min);提取温度(20、40、60、80、100℃;固定条件:料液比1∶10、时间60min、乙醇浓度70%);提取时间(15、30、45、60、75min;固定条件:料液比1∶10、温度80℃、乙醇浓度70%);进行三七根多酚的提取,考察其对三七根多酚提取率的影响。
在单因素实验结果上,使用Design Expert软件采用响应曲面的Box-Behnken实验设计,选取乙醇浓度、提取温度、提取时间三个因素作为自变量,多酚得率为响应值(因变量),实验设计的因素水平如表1所示。

表1 Box-Behnken实验设计的因素与水平Table 1 The factors and the leves for Box-Behnken experimental design
2 结果与分析
2.1 不同的提取溶剂对多酚得率的影响

图1 不同提取溶剂对多酚得率的影响Fig.1 Effect of extraction solvent on the extraction rate of polyphenols from the root of Panax notoginseng
植物各种成分的提取受提取溶剂影响较大,当提取溶剂与提取成分极性相似时,成分就可以很好的被提取出来[14]。根据三七在日常生活中常用热水蒸煮方式食用,以及在酚类提取过程中常用的甲醇、乙醇。因此选用甲醇、乙醇、水三种溶剂。结果如图1所示,乙醇、甲醇提取率较高,最低的是水,结果与雪莲果多酚的提取类似[15]。且在p<0.05水平差异显著。因乙醇安全性好,价格便宜,因此选择乙醇作为进一步实验的溶剂。
2.2 不同的乙醇浓度对多酚得率的影响

图2 不同乙醇浓度对三七根多酚得率的影响Fig.2 Effect of ethanol concentration on the extraction rate of polyphenols from the root of Panax notoginseng
在乙醇中加入一定比例的水可以提高植物有效成分的提取率[16],因此选用一定浓度的乙醇作为提取的溶剂。结果如图2所示,随着乙醇浓度的从10%增至70%,多酚得率从17.36mgGAE/g逐渐增加到36.42mg/g达到最大;乙醇浓度从70%增加到90%,多酚得率又有所降低。在乙醇浓度过低时,水含量高,在植物体内酚类常与多糖、蛋白质质等以氢键和疏水键形成稳定的复合物。水对氢键的断裂作用较弱,不足以破坏样品中多酚类物质与蛋白、多糖或其他物质的键,多酚得率低[17];乙醇浓度过高时,脂溶性成分被溶出较多,不利于多酚的提取[18]。因此选择70%乙醇作为响应曲面因素的中心点。
2.3 不同提取温度对多酚提取率的影响

图3 不同提取温度对三七根多酚得率的影响Fig.3 Effect of extraction temperature on the extraction rate of polyphenols from the root of Panax notoginseng
如图3所示,提取温度对三七根提取率影响较大,多酚的得率随着温度的增高而增加,60℃时提取率达到最大34.86mgGAE/g,但当温度继续增加,多酚得率却略有下降。当温度增加,可以提高多酚溶质的溶解度和扩散系数,多酚得率增大[19];当温度过高时,会造成多酚一定程度的降解,多酚得率下降。因此选择提取温度60℃。
2.4 提取时间对多酚得率的影响

图4 不同提取时间对三七根多酚得率的影响Fig.4 Effect of extraction time on the extraction rate of polyphenols from the root of Panax notoginseng
结果如图4所示,在15~45min范围内随着提取时间增加三七根多酚得率增加速率较快,说明三七多酚溶出需要一定的时间,45min达到最大,提取时间继续增加,多酚得率变化不大,说明45min多酚基本完全溶出。说明45min可作为三七多酚的最佳提取时间点。
2.5 响应曲面法优化多酚的提取
采用design-expert软件,三七根多酚提取的Box-Behnken设计实验结果如表2。

表2 三七根多酚提取的Box-Behnken实验设计与结果Table 2 Box-Behnken design and result for the extraction of polyphenols the root of Panax notoginseng
2.5.1 建立回归模型 分析表2中数据用designexpert软件进行多元回归,模型如下:
Y=37.16-1.37A-2.11B+0.55C-2.65AB+1.39AC-1.94BC-1.40A2-5.51B2-7.41C2。
对该模型进行显著性分析结果如表3所示。可以看出回归模型的p<0.01达到极显著水平,失拟项p>0.05说明失拟项不显著,残差由随机误差引起,该回归模型拟合度较好。相关系数R2=0.9904,说明99.04%的响应值是由变量引起,说明此模型的相关性较好。校正决定系数R2Adj=0.9779说明有97.79%数据的变异性可以用此模型解释。综合上述分析可以以该方程代替实际值进行优化。
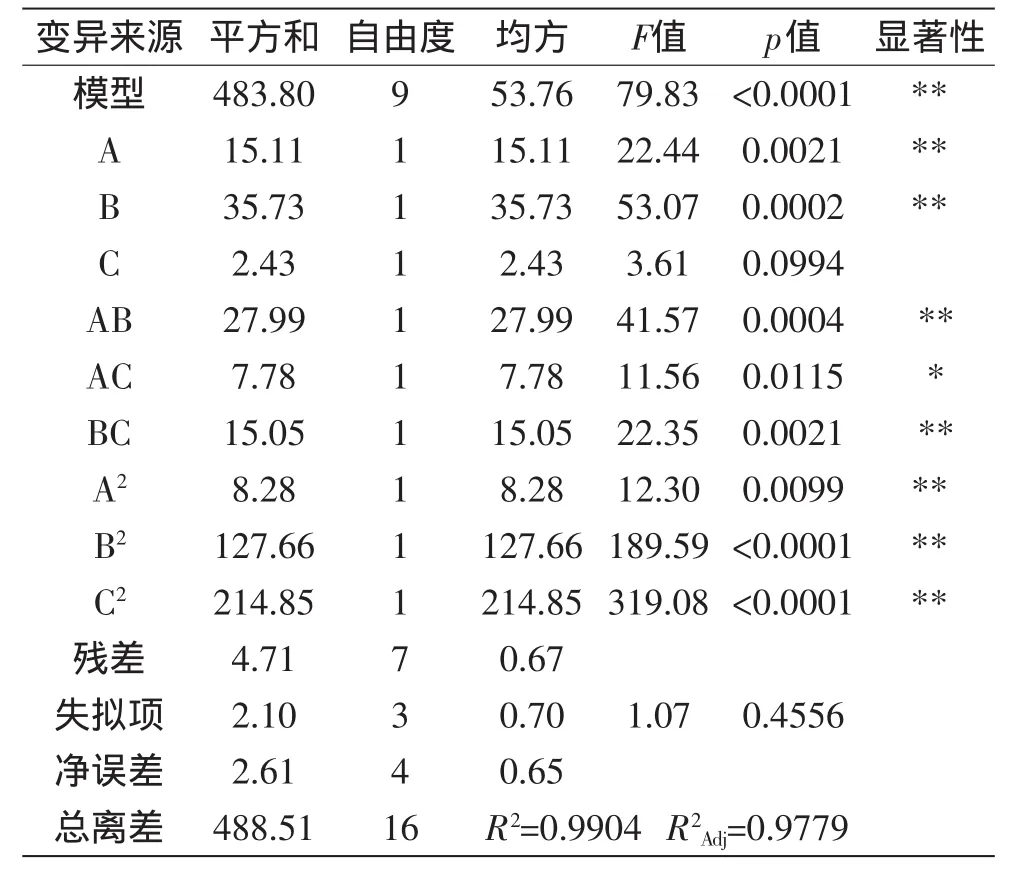
表3 二次回归的方差分析Table 3 Variance analysis of regression model
2.5.2 各因素的交互作用 其极值处于等高线的圆心处,等高线越扁说明两因素的交互作用对提取率的影响越大。从图5和表3可以看出A、B、AB、BC、A2、B2、C2对提取率的影响较大,达到极显著p<0.001,其次是AC,达到显著p<0.05,C影响不显著。将不显著因素剔除,多元回归方程优化结果为:
Y=37.16-1.37A-2.11B-2.65AB+1.39AC-1.94BC-1.40A2-5.51B2-7.41C2。
由图5和表3可知,各因素对多酚得率的影响大小依次为:提取温度>乙醇浓度>提取时间,交互效应对提取率的影响:AB>BC>AC,且影响显著。
优化后的最佳提取条件:乙醇浓度62.30%、温度57.96℃、提取时间45.22min、多酚得率37.5418mgGAE/g。为便于优化条件在实际应用中操作可行,优化条件调整为:乙醇浓度62%、温度58℃、提取时间45min,并在该实验条件进行,进行验证实验,重复三次,得多酚得率36.924mgGAE/g,高达预测值的98.35%,说明该优化条件结果较为可靠。
3 结论
采用Box-Behnken设计与响应曲面法,建立了三七多酚提取率与三因素(提取温度、提取时间、乙醇浓度)之间的二次项模型,根据该模型确定三七多酚提取的最佳条件为:乙醇浓度62%、温度58℃、提取时间45min、多酚得率36.924mgGAE/g,对该条件进行验证得到很好的实验结果,说明在对三七多酚的提取中,利用响应曲面法进行优化,实验步骤少、方法简单经济,可以在三七多酚的提取中进行推广应用。

图5 两因素(AB、AC、BC)之间交互作用对三七多酚得率的影响的响应面图Fig.5 Response surface for the effects of two factors(AB、AC、BC)on the extraction rate of polyphenols from the root of Panax notoginseng
[1]中国科学院植物研究所.中国高等植物图鉴[M].北京:科学出版社,1983:1024-1025.
[2]Aneta W,Jan O,Renata C,et al.Antioxidant activity and phenolic compounds in 32 selected herbs[J].Food Chemistry,2007,105(3):940-949.
[3]Diana B M,Guillermo C M,Guillermo C M,et al.Ultrasoundassisted extraction of phenolic compounds from Laurus nobilis L. and their antioxidant activity[J].UltrasonicsSonochemistry,2013,20(5):1149-1154.
[4]Augustin S,Ian T J,Mike,S,et al.Polyphenols:antioxidants and beyond[J].Am J Clin Nutr,2005,81(Sl):215-217.
[5]朱素英.三七根不同溶剂组分抗氧化性比较[J].食品科技,2013(7):216-219.
[6]Chandrika L,Fereidoon S.Optimization of extraction of phenolic compounds from wheat using response surface methodology[J].Food Chemistry,2005,93(1):47-56.
[7]刘洋,赵谋明,杨宁.响应面分析法优化仙人掌多糖提取工艺的研究[J].食品与机械,2006,22(6):42-45.
[8]杜俊娜,陈书霞,程智慧,等.响应曲面法优化大蒜中总酚提取工艺及其抗氧化活性测定[J].食品科学,2012,33(10):72-77.
[9]Cacace J E,Mazza G.Optimization of extraction of anthocyanins from black currants with aqueous ethanol[J]. Journal of Food Science,2003,68(1):240-248.
[10]赵慧芳,居正英,李维林,等.黑莓果实多酚超声提取工艺的响应曲面优化[J].食品工业科技,2011,32(6):299-303.
[11]安晓婷,王兴娜,周涛,等.响应曲面法优化蓝莓渣多酚提取工艺[J].食品工业科技,2012,33(15):269-273.
[12]郭涛,马重华,王雅,等.响应面优化南瓜果肉多酚提取工艺及抗氧化性能研究[J].食品工业科技,2012,33(7):315-318.
[13]中华全国供销合作总社杭州茶叶研究院.GB/T 8313—2008茶叶中茶多酚和儿茶素类含量的检测方法[S].北京:中国标准出版社,2008.
[14]Najla T,Wided M,Riadh K,et al.Solvent effects on phenolic contents and biological activities of the halophyte Limoniastrum monopetalum leaves[J].Food Science and Technology,2010,43(4):632-639.
[15]陈红惠,吕静,彭郦,等.雪莲果叶中多酚的提取工艺研究[J].食品科学,2009,30(2):88-91.
[16]Yu Liangli,Haley S,Perret J,et al.Free radical scavenging properties of wheat extracts[J].Journal of Agricultural and Food Chemistry,2002,50(6):1619-1624.
[17]程正涛,丁庆波,张昊,等.海红果多酚提取工艺优化[J].食品科学,2010,31(24):172-176.
[18]Wang Jing,Sun Baoguo,Cao Yanping,et al.Optimisation of ultrasound-assisted extraction of phenolic compounds from wheat bran[J].Food Chemistry,2008,106(2):804-810.
[19]Manuel P,Monica R,Mar′za J,et al.Effect of solvent,temperature,and solvent-to-solid ratio on the total phenolic contentand antiradicalactivity ofextractsfrom different components of grape pomace[J].J Agric Food Chem,2005,53(6):2111-2117.
Optimization of polyphenol extraction from Panax notoginseng roots using response surface methodology
ZHU Su-ying
(Department of Life Science,Heze University,Heze 274015,China)
Objective:To predict optimum conditions of polyphenol extraction from Panax notoginseng roots. Methods:Box-Behnken design was used to experimental design and analyze on the basis of single-factor experiments.Effect of ethanol concentration,extraction time,extraction temperature and their cross-interaction on the extraction rate of polyphenols were researched,and multiple regression model,the response surface plot and contour plots was established.Results:Optimum conditions of polyphenol extraction were ethanol concentration 62%,extraction temperature 58℃,extraction time 45min and the extraction rate of polyphenols reached 36.924mgGAE/g.Conclusion:At the optimal processing conditions,the actual extraction rate can reach predicted extraction rate 98.35%.Thus optimum conditions were reliable and that could be used for polyphenol extraction from Panax notoginseng roots.
Panax notoginseng roots;polyphenol;response surface methodology;extraction
TS201.1
B
1002-0306(2014)14-0278-04
10.13386/j.issn1002-0306.2014.14.053
2013-10-08
朱素英(1980-),女,硕士研究生,讲师,研究方向:中草药的活性成分提取与利用。
山东省“十二五”高等学校重点实验室。
