D-最优混料设计优化菊花枸杞饮料配方及其抗氧化活性的研究
2014-03-01胡立明胡文忠何煜波刘程惠大连民族学院生命科学学院辽宁大连6600空军勤务学院航空军需系江苏徐州006
邹 宇,胡立明,胡文忠,*,何煜波,刘程惠(.大连民族学院生命科学学院,辽宁大连6600;.空军勤务学院航空军需系,江苏徐州006)
D-最优混料设计优化菊花枸杞饮料配方及其抗氧化活性的研究
邹 宇1,胡立明2,胡文忠1,*,何煜波1,刘程惠1
(1.大连民族学院生命科学学院,辽宁大连116600;2.空军勤务学院航空军需系,江苏徐州221006)
优化了菊花枸杞饮料的配方并测定了饮料的抗氧化能力。D-最优混料设计实验结果表明:菊花枸杞饮料的最佳配方为30%菊花提取液、51%枸杞提取液和19%绵白糖溶液。在此条件下,饮料感官评定最大值达到86.20。菊花枸杞饮料浓度为100%时,可清除67.97%的DPPH自由基和51.15%的羟自由基,具有较强的抗氧化活性。本饮料颜色淡黄色,酸甜适中,口感润滑,具有浓郁的菊花和枸杞香味,是一种绿色、营养、健康的保健饮品。
菊花,枸杞,D-最优混料设计,抗氧化活性
菊花是菊科植物的头状花序,富含绿原酸、氨基酸和多种微量元素[1]。菊花中还含有叶黄素和多酚类物质,尤其是黄酮类化合物具有良好的保健功能[2]。现代药理学研究表明,菊花具有抗菌、降血脂、降血压、抗氧化和预防心血管疾病的作用[3]。枸杞是常用的传统中药,富含枸杞多糖、必需氨基酸、牛磺酸、类胡萝卜素、甜菜碱、多种维生素和矿质元素等。枸杞中的主要生物活性成分包括枸杞多糖、类胡萝卜素和甜菜碱等[4]。枸杞多糖具有抗衰老、调节免疫力、降血糖、降血脂和抗肿瘤等作用;甜菜碱对肝损害具有保护功能;而类胡萝卜素具有很强的抗氧化能力[5-6]。因此,以菊花和枸杞为主要原料可开发出多种具有保健功能的食品。
目前,以菊花和枸杞为主要原料,已研制出饮料[7-9]、果冻[10]、面包[11]和发酵酒[12]等多种功能食品,但这些食品均未对其功能性进行测定和评价。本实验在前人研究基础上,采用D-最优混料设计优化菊花枸杞饮料的配方,使其外观和口感俱佳,同时对饮料的抗氧化能力进行测定和分析,旨在为菊花枸杞功能食品的进一步开发提供参考。
1 材料与方法
1.1 材料与仪器
菊花、枸杞和绵白糖 市售,购于大连本地超市;DPPH 美国Sigma-Aldrich公司;羟自由基测定试剂盒 南京建成生物有限公司。
PL203电子天平 梅特勒-托利多仪器有限公司;FW177中草药粉碎机 天津市泰斯特仪器有限公司;DKS-24电热恒温水浴锅 上海嘉兴市中新医疗仪器有限公司;TG16-WS台式高速离心机 长沙湘仪离心机仪器有限公司。
1.2 实验方法
1.2.1 饮料的生产工艺流程[8]
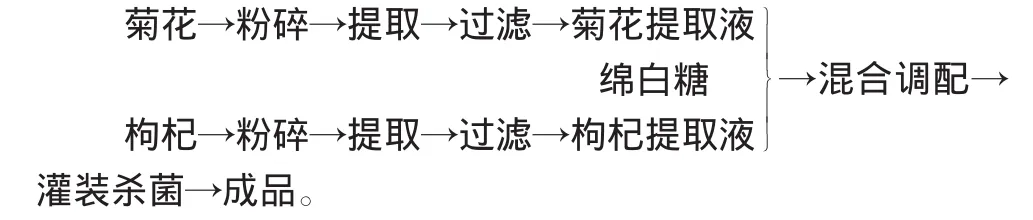
1.2.2 操作要点 将菊花和枸杞分别粉碎后,菊花按1∶40料液比加水80℃浸提30min,枸杞按1∶40料液比加水90℃浸提1h,过滤,得到菊花提取液和枸杞提取液[8]。将两种提取液与绵白糖溶液混合调配,脱气灌装后常压沸水杀菌10min,迅速冷却至室温。
1.3 D-最优混料设计优化菊花枸杞饮料配方
1.3.1 D-最优混料实验设计 采用混料回归设计,以制备的菊花提取液(X1)、枸杞提取液(X2)、绵白糖溶液(X3)作为饮料配制的三种溶液,进行混料比优化实验。各因子的体积百分比总和为100%。建立各因子成分比例与感官评定分数之间的回归方程,通过探索效应面来估计整个多分量系统的性质。三种溶液的百分含量分别限定在菊花提取液0.30≤X1≤0.60,枸杞提取液0.30≤X2≤0.60,绵白糖溶液0.10≤X3≤0.40范围内,X1、X2、X3均为实际值。X1+X2+X3=1(100%)。
实验模型采用Scheffe不完全三次多项式拟合:

方程中,Y滋为预测响应值;xj,xh,xk为自变量编码值;bj为一次项系数,bhj为二次项系数,bhjk为三次项系数;N为因子个数,本实验取值为3。方程中每个自变量的显著性由F值和p值决定。回归系数经过分析后得到等高线图和回归方程。实验因素水平设计见表1。
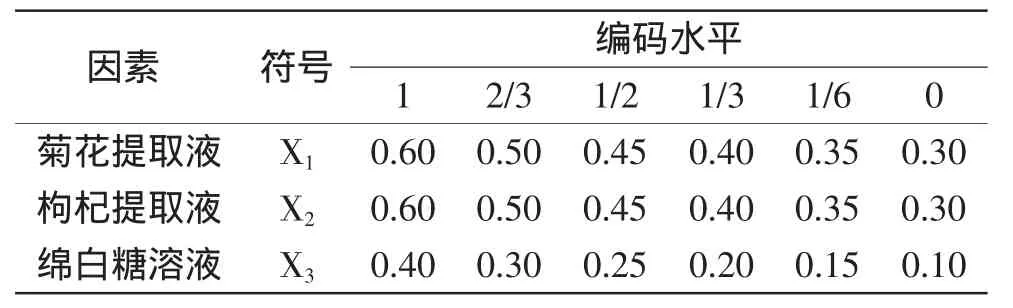
表1 D-最优混料设计成分取值编码表Table 1 Pseudo-component values with D-Optimal mixture design
3种溶液按照上表的实验设计混合,响应值为感官评定分数,全部实验设计包括14种组合。其中包括6个最小模型点,4个失拟项评估点和4组重复。
1.3.2 饮料感官评定方法 参考曲永鑫等[8]的饮料感官评定方法,从样品的色泽、气味、滋味和组织状态等方面做出评定,评分标准见表2。由10位食品专业大学生组成评价小组,对样品的四个指标分别进行打分,满分为100分。以平均分为感官评定的结果。
1.4 菊花枸杞饮料抗氧化活性的测定
取配制好的菊花枸杞饮料,分别测定浓度在25%、 50%、75%和100%时,其清除DPPH自由基和羟自由基的能力,以此来评价饮料的抗氧化活性。
1.4.1 DPPH自由基清除能力的测定 参考Shimada等[13]的测定方法,分别取2mL样品溶液及2mL 2× 10-4mol/L DPPH乙醇溶液加入具塞试管,摇匀,室温(25℃)下反应30min,以无水乙醇作参比,517nm处比色,测定其吸光度A1,同时测定2mL无水乙醇与2mL DPPH溶液混合液的吸光度值A0,2mL提取液与2mL无水乙醇的吸光度值A2。

表2 菊花枸杞饮料评分标准(总分100分)Table 2 Evaluation standard of drink of chrysanthemum and medlar

1.4.2 羟自由基清除能力的测定 采用羟自由基测定试剂盒,Fenton反应产生羟自由基,H2O2的量与羟自由基量呈正比,当给予电子受体后,用griess试剂显色,形成红色物质,其呈色与羟自由基的量成正比关系。
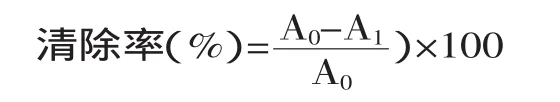
式中,A0为空白样品反应后吸光度值;A1为样品反应后吸光度值。
1.5 数据处理
实验结果为3次平行实验的平均值,数据采用Design Expert 7.1.6软件进行处理和分析。
2 结果与分析
2.1 菊花枸杞饮料D-最优混料设计及结果分析
以饮料配方中的菊花提取液(X1)、枸杞提取液(X2)和绵白糖溶液(X3)为自变量,采用D-最优混料实验设计方法优化饮料配方,以获得最佳感官评价结果。实验设计与结果见表3。
为预测实验范围内感官评定分数的最大值,利用Design Expert软件,得到拟合感官评定实验结果的二次多项式回归模型如下:
Y=-28.93X1+10.09X2-24.73X3+356.94X1X2+ 165.42X1X3+288.17X2X3
利用F检验检测回归模型的统计学显著性和方差分析结果见表4。通过方差分析得到模型的F值是9.89,这表明模型显著(p<0.05)。同时,失拟项F值1.00以及相关的p值0.5006表明失拟项并不显著。决定系数(R2)为0.8608,这表明模型中86.08%的感官评定分数变化归因于自变量。这些结果证明所建模型足以表现出各条件参数之间的真实关系,可以用来预测感官评定的分数。

表3 饮料配方D-最优混料实验设计与结果Table 3 D-Optimal mixture design and experiment result of drink formula
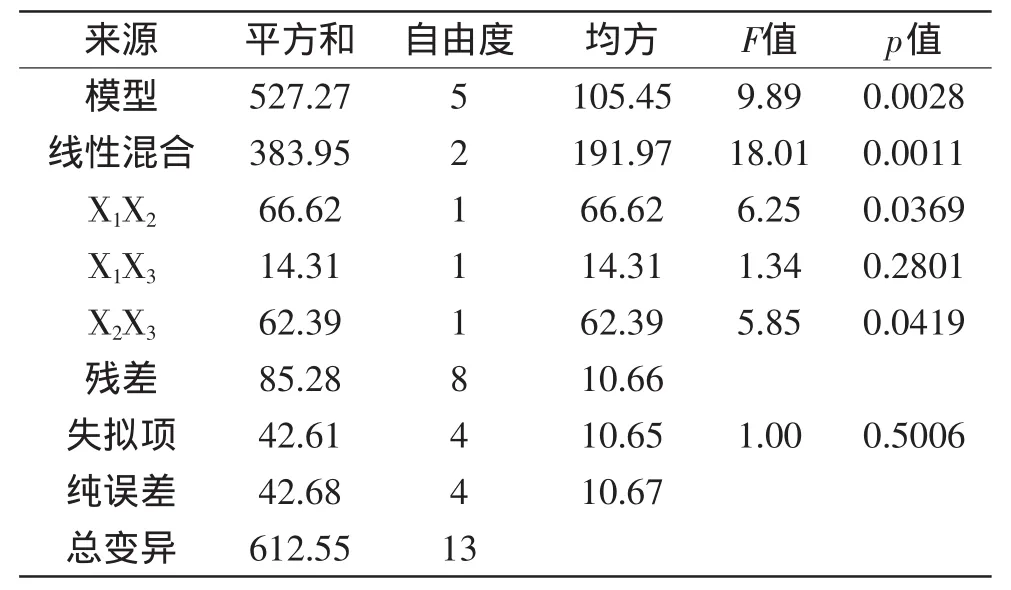
表4 感官评定回归模型的方差分析Table 4 Analysis of variance of sensory evaluation with regression model
菊花提取液,枸杞提取液和绵白糖溶液对感官评定分数影响的三角曲面图见图1。三种溶液的线性混合显著(p<0.05);菊花提取液与枸杞提取液以及枸杞提取液与绵白糖溶液交互作用显著(p<0.05)(表4)。由三角曲面图可知,当枸杞提取液占有较大比例且固定不变时,感官评定分数随着菊花提取液的增加而持续减小;当绵白糖溶液占有较大比例且固定不变时,感官评定分数随着菊花提取液的增加而呈现先增大后减小趋势。当菊花提取液或绵白糖溶液占有较大比例且固定不变时,感官评定分数均随着枸杞提取液的增加而增大。当菊花提取液占有较大比例且固定不变时,感官评定分数随着绵白糖溶液的增加而增加,直到0.20左右达到最大值,然后缓慢减小;当枸杞提取液占有较大比例且固定不变时,感官评定分数随着绵白糖溶液的增加而持续减小。
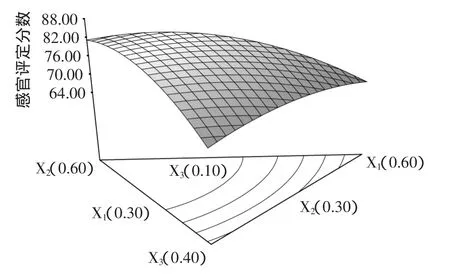
图1 菊花提取液、枸杞提取液和绵白糖溶液对感官评定分数影响的三角曲面图Fig.1 Triangular surface for the effects of chrysanthemum extract,medlar extract and soft sugar solution on sensory evaluation
根据三角曲面实验结果,经Design Expert软件优化得到菊花枸杞饮料的最佳配方为:菊花提取液30%、枸杞提取液51%、绵白糖溶液19%。在此条件下,模型预测饮料的感官评定最大值为85.73。验证实验结果表明,菊花枸杞饮料感官评定最大值达到86.20,这与预测值相吻合,说明实验得到的模型有效且可靠。本饮料颜色淡黄色,酸甜适中,口感润滑,具有浓郁的菊花和枸杞香味,是一种绿色、营养、健康的保健饮品。
2.2 菊花枸杞饮料抗氧化活性的测定结果
从表5可知,在菊花枸杞饮料浓度为25%时,其对DPPH自由基和羟自由基清除率分别为45.05%和23.12%,随着饮料浓度的不断增加,其自由基清除能力也逐渐增大,当饮料浓度增加到100%时,其DPPH自由基和羟自由基清除率分别达到67.97%和51.15%。由此可见,在测试浓度范围内,菊花枸杞饮料能够清除大多数自由基,具有较强的抗氧化活性。

表5 菊花枸杞饮料清除DPPH自由基和羟自由基的测定结果Table 5 Scavenging activities of drink of chrysanthemum and medlar on DPPH radicals and hydroxyl radicals
3 结论
采用D-最优混料设计优化菊花枸杞饮料的配方,实验结果表明最佳配方为:菊花提取液30%、枸杞提取液51%、绵白糖溶液19%。在此条件下,饮料感官评定达到最大值86.20,与预测值相吻合。随着饮料浓度的不断增大,菊花枸杞饮料清除自由基能力也逐渐增强,当饮料浓度为100%时,可清除67.97%的DPPH自由基和51.15%的羟自由基,这表明菊花枸杞饮料具有较强的抗氧化活性。
[1]Pukalskas A,Venskutonis PR,Dijkgraaf I,et al.Isolation,identification and activity of natural antioxidants from costmary(Chrysanthemum balsamita)cultivated in Lithuania[J].Food Chemistry,2010,122:804-811.
[2]王婷婷,王少康,黄桂玲,等.菊花主要活性成分含量及其抗氧化活性测定[J].食品科学,2013,34(15):95-99.
[3]王存琴,汪荣斌,张艳华.菊花的化学成分及药理活性[J].长春中医药大学学报,2014,30(1):28-30.
[4]如克亚,孙玉敬,钟烈州,等.枸杞植物化学成分及其生物活性的研究进展[J].中国食品学报,2013,13(8):161-172.
[5]李丹丹,吴茂玉,于滨,等.枸杞多糖的制备、结构与生理活性研究进展[J].食品工业,2013,34(8):203-207.
[6]黄丽,於洪建,吴巍.枸杞中类胡萝卜素的研究进展[J].食品研究与开发,2012,33(5):233-236.
[7]高盈娴,李保国.山楂枸杞菊花甘草中总黄酮的提取及功能保健饮料研制[J].食品科技,2008(3):163-166.
[8]曲永鑫.山楂、大枣、枸杞、菊花天然复合保健饮料的工艺研究[J].食品科学,2008,29(10):710-713.
[9]陈晓义,胡丽娜,田波.复合花果饮料的研制[J].食品工业,2010(6):621-623.
[10]朱晓红,于颖.枸杞菊花果冻的研制[J].饮料工业,2010,13(1):20-23.
[11]陈东海,宋宏光,张谦益,等.枸杞菊花保健玉米面包的研制[J].食品工业,2004(6):31-33.
[12]张惠玲,王玲,王玉林.枸杞菊花发酵酒的制备[J].食品工业,2001(4):24-25.
[13]Shimada S,Otsuki H,Sakuta M.Transcriptional control of anthocyanin biosynthetic genes in the Caryophyllales[J].Journal of Experimental Botany,2007,58(5):957-967.

表2 辅酶Q10高产突变株遗传稳定性实验Table 2 Stability experiment results of mutant strain BUQJ-012
确定了He-Ne激光诱变时间为4.5min。在此条件下,假白布勒弹孢酵母原生质体经激光诱变选育获得具有稳定遗传特性的高产突变菌株BUQJ-012,其辅酶Q10产量为1.53mg/L,较出发菌株BUQ-3提高了87%。
本论文的研究表明,以色素突变型为筛选模型,采用原生质体激光诱变技术选育假白布勒弹孢酵母辅酶Q10高产菌株是行之有效的。
参考文献
[1]Maroz A,Anderson R,Smith R A J,et al.Reactivity of ubiquinone and ubiquinol with superoxide and the hydroperoxyl radical:implications for in vivo antioxidant activity[J].Free Radic Biol Med,2009,46:105-109.
[2]Chen C C,Liou S W,Chen C C,et al.Coenzyme Q10reduces ethanol-induced apoptosis in corneal fibroblasts[J].PLoS One,2011,6(4):1-12.
[3]Echtay K S,Winkler E,Frischmuth K,et al.Uncoupling proteins 2 and 3 are highly active H+transporters and highly nucleotide sensitive when activated by coenzyme Q(ubiquinone)[J].ProcNatl Acad Sci USA,2001,98:1416-1421.
[4]Doring F,Schmelzer C,Lindner I,et al.Functional connections and pathways of coenzyme Q10-inducible genes:an in-silico study [J].IUBMB Life,2007,59:628-633.
[5]Gian PL,Luca T.Clinical aspects of coenzyme Q10:anupdate. Nutrition,2010,26:250-254.
[6]Kumar A,Kaur H,Devi P,et al.Role of coenzyme Q10(CoQ10)in cardiac disease,hypertension and Menierelikesyndrome[J]. Pharmacol Ther,2009,124:259-268.
[7]李家洲.辅酶Q10的功能与应用研究进展[J].食品与药品,2013,15(6):433-435.
[8]Kawamukai M.Biosynthesis and bioproduction of coenzyme Q10by yeasts and other organisms[J].Biotechnology and applied biochemistry,2009,53(4):217-226.
[9]郑毅,王娅,朱志春.发酵法生产辅酶Q10研究进展[J].海峡科学,2012(8):128-129.
[10]许激扬,肖海蓉,岳小飞.半导体激光和紫外线对辅酶Q10产生菌的复合诱变效应[J].天然产物研究与开发,2007,19(10):827-829.
[11]邵庆伟,柯崇榕,杨威.辅酶Q10的微生物合成[J].生命的化学,2013,33(2):91-95.
[12]孔卓怡,钟莉,邱乐泉.基因工程策略强化生物法生产CoQ10研究进展[J].黑龙江科学,2013,4(7):45-47.
[13]吴祖芳,翁佩芳,李寅,等.辅酶Q10发酵生产的育种思路及发酵条件优化策略[J].食品与发酵工业,2001,27(7):49-53.
[14]曹燕妮,岳田利,袁亚红.辅酶Q10高产菌株的诱变选育[J].食品科学,2012,33(11):121-125.
[15]冀颐之,李政,谭天伟.原生质体激光诱变选育少根根霉脂肪酶高产菌株[J].工业微生物,2011,41(3):38-43.
[16]王根华,钱和,肖刚.发酵菌体中辅酶Q10的提取及其测定方法[J].无锡轻工大学学报,2003,22(2):59-62.
[17]武标,张千,李辉.氩离子激光照射对类球红细菌的诱变效应及对辅酶Q10产生量的影响[J].激光生物学报,2007,16(3):364-368.
[18]党磊,田菁,印红.利用空间诱变选育辅酶Q10高产菌[J].科技导报,2010,28(14):40-43.
[19]张延静.假白布勒弹孢酵母发酵生产辅酶Q10的研究[M].北京:北京化工大学,2003:38-41.
Optimization of drink formula of chrysanthemum and medlar using D-optimal mixture design and its antioxidant activity
ZOU Yu1,HU Li-ming2,HU Wen-zhong1,*,HE Yu-bo1,LIU Cheng-hui1
(1.College of Life Science,Dalian Nationalities University,Dalian 116600,China;2.Quartermaster Department of Air force Logistics College,Xuzhou 221006,China)
Drink formula of chrysanthemum and medlar was optimized and its antioxidant activity was determined. By D-optimal mixture design,the best drink formula of chrysanthemum and medlar was:30%of chrysanthemum extract,51%of medlar extract and 19%of soft sugar solution.In this condition,the maximum value of sensory evaluation of drink was 86.20.At concentration of 100%,the drink could eliminated 67.97%DPPH radicals and 51.15%hydroxyl radicals and showed strong antioxidant activity.This drink was yellow,sweet and sour moderate,taste lubrication,with rich chrysanthemum and medlar fragrance.Thus,this drink would be a green,nutritive and healthy functional beverage.
chrysanthemum;medlar;D-optimal mixture design;antioxidant activity
TS201
B
1002-0306(2014)14-0241-04
10.13386/j.issn1002-0306.2014.14.045
2014-01-20 *通讯联系人
邹宇(1979-),男,博士,讲师,研究方向:食品生物技术。
国家科技支撑计划项目(2012BAD38B05);大连市科技计划项目(2012E13SF106)。
