双重PCR熔解曲线峰快速检测食品中猪源性成分方法的建立
2014-03-01蒲红州沈林園蒋小兵雷怀刚李学伟四川农业大学动物科技学院四川雅安6504四川省马边金凉山农业开发有限公司四川马边64600
高 菲,蒲红州,沈林園,蒋小兵,雷怀刚,沈 静,李学伟,朱 砺,*(.四川农业大学动物科技学院,四川雅安6504;.四川省马边金凉山农业开发有限公司,四川马边64600)
双重PCR熔解曲线峰快速检测食品中猪源性成分方法的建立
高 菲1,蒲红州1,沈林園1,蒋小兵1,雷怀刚1,沈 静2,李学伟1,朱 砺1,*
(1.四川农业大学动物科技学院,四川雅安625014;2.四川省马边金凉山农业开发有限公司,四川马边614600)
基于国际生命条码联盟(CBOL,the Consortium for the Barcode of Life)提出的barcoding技术所确定的序列区域,针对猪的线粒体COⅠ基因序列设计特异性引物。为了避免食品中PCR抑制剂的影响,本实验设置GCG(胰岛素受体)基因125bp的纯化片段为内参照,控制假阴性结果的出现。通过优化PCR反应条件,猪和GCG基因的特异性产物在79.2℃和75℃有特异性熔解峰。设置牛、羊、鸡、兔、鼠和空白对照,均无扩增。测序结果表明,该猪特异性引物的PCR产物含有245bp的核苷酸序列与GenBank中相应序列吻合;该方法检出限为0.001%。
双重荧光PCR,DNA条形码,猪源性成分,细胞色素C氧化酶基因Ⅰ,内参照
肉类食品作为人类膳食结构的重要组成部分,因价格差异、风俗习惯、疾病传播等方面的原因,造成了食品掺假、检验防疫、宗教信仰等问题的出现。比如,用相对便宜的猪肉掺假牛、羊肉;猪肉被用在回族和伊斯兰教人的食品中;疫情的传播等。特别是将猪肉非法加工冒充牛、羊等其他肉类的行为,严重侵犯了消费者的利益。所以建立有效检测猪源性成分的方法显得特别重要[1-3]。
目前,主要的动物源性成分检测方法以分子生物学为主[4]。在国外,已经出现了常见物种的检测试剂盒。但是试剂盒的灵敏度较低,且对样品的质量要求较高[5]。为了探究更为快速、灵敏的方法,本研究采用双重SYBR GreenⅠReal-Time PCR技术。该技术能实时监测PCR产物累积信号,得出准确的结果。这样减少了以往电泳时繁琐步骤的干扰,使检测结果更加准确和灵敏。引入单拷贝基因GCG为内参照基因,用来监控抑制剂对PCR反应的影响,避免了假阴性结果的出现。选择DNA条形码特定区域序列作为目的片段来检测猪源性成分,为国际DNA条形码计划在分类学上的应用,提供了佐证[6-8]。
1 材料与方法
1.1 材料与仪器
猪、牛、羊、鸡、兔、鼠等肌肉样品 采自四川农业大学教学农场;Takara DNA Isolation Reagent for Meat and Meat Products Kit、SYBR®Prime Script TMRT-PCR Kit购自宝生物工程(大连)有限公司;DNA MarkerⅡ、蛋白酶K等 购自北京天根生化科技有限公司;chelex-100 购自成都博奥维新生物科技有限公司;COⅠ基因序列的上游引物P1:CTATCCCAGG ACGACTAAA,下游引物P2:TTGTGGCATACCATT GAG;GCG单拷贝基因序列的上游序列P3:GCAAC TGCTCCTTACCAATGAAA,下游引物P4:CAGAATG TCAGGCG-RTTCAGATAT 深圳华大基因科技有限公司。
Smart Spec TMPlus分光光度计、凝胶成像系统、iQTM5 Multicolor Real-TimePCR 美国BIO-RAD公司;离心机 德国Thermo公司。
1.2 实验方法
1.2.1 PCR引物的设计和合成 根据DNA条形码技术的规定,用Primer Premier 5.0和Oilgo 6.0软件,根据GenBank中猪的线粒体COⅠ基因序列设计引物;内参照基因采用猪GCG(胰岛素受体)单拷贝基因纯化片段,并设计引物,使两对引物的退火温度在60℃左右。
1.2.2 DNA抽提 取出冻存在-80℃冰箱环境下的新鲜样品,用研钵在液氮环境下碾碎,然后采用Chelex-100法抽提总DNA[9]。最后总DNA保存于-20℃备用。
1.2.3 双重PCR反应体系的建立 通过温度梯度PCR方法,分别探索猪引物GCG基因引物的退火温度。在确定退火温度以后,探索双重实时荧光PCR反应体系:该反应总体系为20滋L,其中SYBR GreenⅠPreMix设置10、11、12、13滋L四个梯度,上下游引物(10滋mol/L)各1滋L,DNA模板(50ng/滋L)各1滋L,用DEPC水补至20滋L。反应程序:预变性95℃,2min;95℃,30s;57℃,30s;72℃,1min,进行35次循环。在此前的反应基础上,优化PCR体系中各物质的最佳浓度。其中猪COⅠ基因引物和内参基因引物的比例采用1滋L∶0.8滋L、1滋L∶0.9滋L、1滋L∶1滋L用量进行实验;猪COⅠ基因模板和内参基因模板DNA的采用2滋L∶2滋L、2滋L∶1.5滋L、2滋L∶1滋L、2滋L∶0.5滋L用量进行实验。引物和模板采用一一配对的方式,总共16次组合,都采用同一退火温度进行双重实时荧光PCR扩增。
1.2.4 特异性检测 分别选取牛、羊、鸡、兔、鼠样品的DNA为模板与猪肉样品的阳性对照;用DEPC水代替DNA模板做阴性对照;并加入GCG基因片段和引物P3、P4作为内参照,检测模板中是否含有PCR抑制剂。
1.2.5 灵敏度检测 将猪DNA模板样品稀释至0.1%、0.01%、0.001%、0.0001%的含量。取各浓度DNA 2滋L,并加入GCG基因片段DNA 1滋L共同作为模板,进行PCR灵敏度检测。
1.2.6 样品检测 将牛、羊、鸡、兔、鼠样品的DNA做为模板进行检测,评价该方法的可靠性。
1.2.7 PCR产物序列测定 将PCR产物纯化后送深圳华大科技有限公司测序,检验产物。
2 结果与分析
2.1 双重实时荧光PCR反应条件的建立及优化
通过温度梯度PCR的结果,显示两个单重反应的最适退火温度为60℃。经过对1.2.2的排列组合优化筛选,2种引物的用量为1滋L∶0.8滋L;猪COⅠ基因模板和内参照基因模板的用量分别为2滋L和1.5滋L。优化后结果如图1所示。能在不同温度点形成清晰可见的峰图,峰的荧光值都达到了4000以上,每个样品中IPC都能在75℃时形成特异性的熔解曲线峰,猪源性成分的特异性熔解曲线在79.2℃形成。
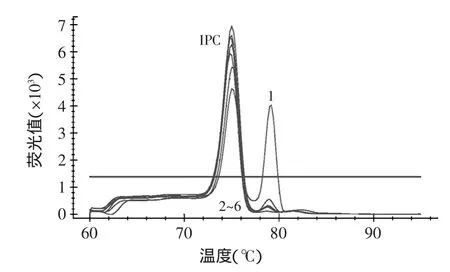
图1 猪源性成分特异性熔解曲线图Fig.1 Porcine endogenous component-specific melting curves
2.2 方法特异性检验
将鸡、狗、羊、兔、鼠样品的DNA和猪样品的DNA按1∶1混合,做为扩增模板,用于检验该方法的特异性。结果表明(见图2),常见动物样本DNA为模板和空白对照组都未在79.2℃形成特异性熔解峰(Ct>35)。该结果表明,该方法特异性良好,且所有模板中不含有PCR抑制剂成分。
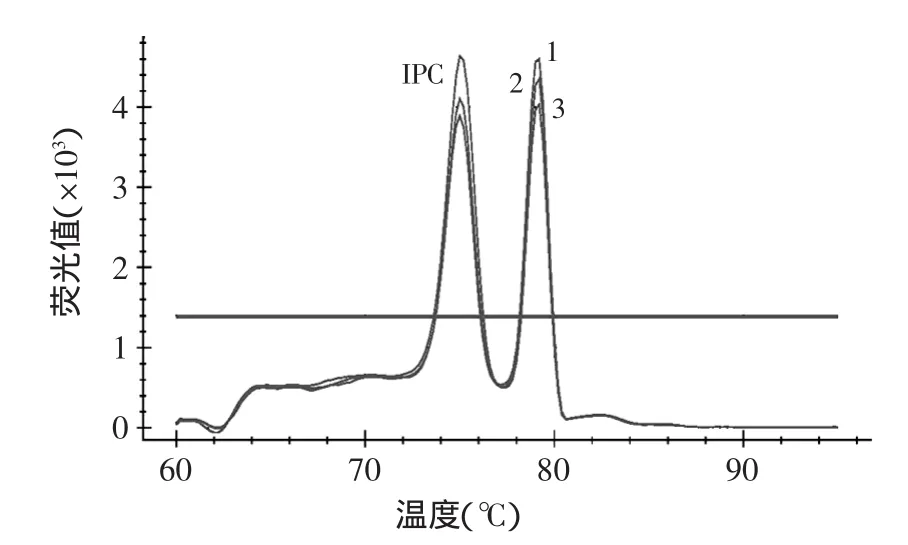
图2 混合DNA中猪特异性熔解曲线Fig.2 Swine specific melting curve of mixed DNA template
2.3 方法灵敏度检验
根据上述实验结果,进一步将猪DNA模板稀释至含量为1%、0.01%、0.001%、0.0001%后再进行灵敏度检验。结果表明(见图3),在PCR过程中只有0.0001%浓度没有生产有效的熔解曲线峰。表明此SYBR GreenⅠRealtime-PCR熔解曲线法的检出限为0.001%。
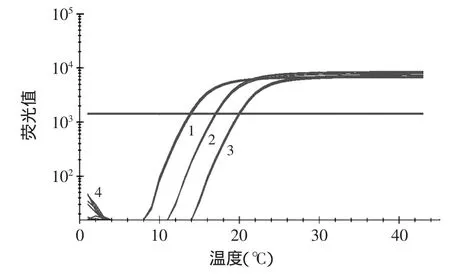
图3 灵敏度检测Fig.3 Sensitivity Detection
2.4 研究方法的验证与应用
在餐厅里买回两份牛、羊肉样品,在市场上购买了鸡、兔、牛、羊肉样品进行检测,用于验证本方法。检测结果如图4所示,烧烤餐厅的牛、羊肉有猪肉掺假。可能是因为猪肉比牛、羊肉便宜,且外观上不容易分辨它们的差别。
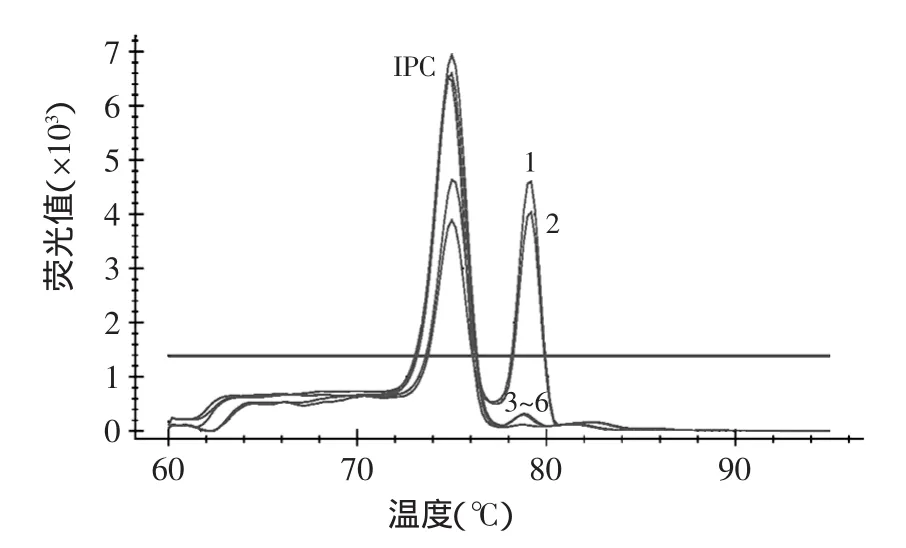
图4 实例检测中猪源性特异性熔解曲线图Fig.4 Porcine endogenous specific melting curves of examples of detection
2.5 测序验证
特异性扩增片段的测序结果与GenBank相应序列的比对结果表明,该片段全长245bp,位于猪线粒体细胞色素C氧化酶亚基Ⅰ(CO I)序列的3’端,该短序列具有相对适中的保守性,适合用于种属鉴别。
3 讨论
本实验采集了商业肉制品进行验证,显示该方法实现了现代分子诊断技术快速、准确、大批量和经济的要求。本实验使用了chelex-100法和商业DNA抽提试剂盒,提取样品中的总DNA,能满足浓度0.0001%含量的检测要求。与传统的凝胶电泳检测方法比较,该方法不需要使用琼脂糖凝胶、核酸染料等有害物质,从而避免了污染环境。
双重PCR溶解曲线峰快速检测法最重要的两个部分就是引物设计和退火温度的设定。根据Arong Luo等[7,10-11]报道以线粒体DNA做为标记基因有以下四个优点:覆盖物种的数量多;种间和种内的序列差异适中;能够解决不同分类阶元的问题;基因序列的突变率较低,与本实验结果相符。Vrijenhoek等[12]提出,线粒体基因具有组织中含量大,无组织特异性,易于获取等优点。在实验技术方面,特异性差的引物,在PCR过程中产生较多的非特异性扩增,影响实验结果;引物扩增的产物过长或过短,引物的GC含量太高或太低都会影响该方法的熔解温度(Tm值)。在减少误差方面,本实验采用以扩增内参照GCG基因片段的方法来解决,促进了多重PCR的应用,同时减少了误差。在PCR过程中,GCG基因片段会与检测目的片段竞争反应体系中的dNTP。样品DNA浓度偏低会导致,熔解曲线峰不明显,太高可能抑制GCG基因片段的扩增。调节引物之间的浓度比和DNA浓度比,是该方法的另一关键步骤。
4 结论
通过实验证明,P1、P2引物在猪源性成分的检测中,具有很高的特异性,其检出限为0.001%,满足检测条件。该方法可以用于食品中猪源性成分的特异性检测。
[1]李巧玲,刘景艳.市场鲜猪肉掺假状况的调查监测[J].食品科学,2004,25(10):273-276.
[2]罗家琴,王加启,卜登攀,等.饲料中牛,羊,猪,鸡源性成分的PCR检测方法及其应用[J].中国农业科学,2008,41(7):2112-2119.
[3]李家鹏,乔晓玲,田寒友,等.食品和饲料中动物源性成分检测技术研究进展[J].食品科学,2011,32(9):340-347.
[4]Nakyinsige K,Man YB,Sazili AQ.Halal authenticity issues in meat and meat products[J].Meat Sci,2012,91(3):207-214.
[5]Chen SY,Liu YP,Yao YG.Species authentication of commercial beef jerky based on PCR-RFLP analysis of the mitochondrial 12S rRNA gene[J].Journal of Genetics and Genomics,2010,37(11):763-769.
[6]Hebert PD,Ratnasingham S,deWaard JR.Barcoding animal life:cytochrome c oxidase subunit 1 divergences among closely related species[J].Proc Biol Sci,2003,270(S1):96-99.
[7]Luo A,Zhang A,Ho SY,et al.Potential efficacy of mitochondrial genes for animal DNA barcoding:a case study using eutherian mammals[J].BMC Genomics,2011(12):84.
[8]Min XJ,Hickey DA.DNA barcodes provide a quick preview of mitochondrial genome composition[J].PLoS One,2007,2(3):325.
[9]Walsh PS,Metzger DA,Higuchi R.Chelex 100 as a medium for simple extraction of DNA for PCR-based typing from forensic material[J].Biotechniques,1991,10(4):506.
[10]Hebert P,Gregory TR.The Promise of DNA Barcoding for Taxonomy[J].Systematic Biology,2005,54(5):852-859.
[11]Hebert PDN,Stoeckle MY,Zemlak TS,et al.Identification of birds through DNA barcodes[J].PLoS Biology,2004,2(10):e312.
[12]Vrijenhoek R.DNA primers for amplification of mitochondrial cytochrome c oxidase subunit I from diverse metazoan invertebrates [J].Molecular Marine Biology and Biotechnology,1994,3(5):294-299.
Establishment of duplex PCR melting curve for rapid identification of swine origins in foodstuff
GAO Fei1,PU Hong-zhou1,SHEN Lin-yuan1,JIANG Xiao-bing1,LEI Huai-gang1,SHEN Jing2,LI Xue-wei1,ZHU Li1,*
(1.College of Animal Science and Technology,Sichuan Agricultural University,Ya’an 625014,China;2.Mabian Gold Liangshan Agricultural Development Co.,Ltd.,Mabian 614600,China)
Primers specific to swine was designed for species-specific COⅠgene-amplification from barcoding was proposed by CBOL.Simultaneously in order to prevent false negative results,GCG gene fragment was used for the internal positive control(IPC).Gene products of swine and GCG were represented in two melting peaks generated simultaneously at temperatures of 79.2℃and 75℃respectively.The specificity of the method was evaluated using template DNAs from bovine,chevon,chicken,rabbit,rat and NTC,whereas only amplification products of GCG gene were obtained.DNA sequencing results showed that the sequence of swine-specific products was 245bp,and which were 100%matching the corresponding sequence in the GenBank.The LOD of this method was 0.001%.
duplex SYBR green real-time PCR;DNA barcoding;swine;COⅠ;IPC
TS201.1
A
1002-0306(2014)14-0081-03
10.13386/j.issn1002-0306.2014.14.008
2013-01-05 *通讯联系人
高菲(1987-),男,在读研究生,研究方向:猪肉品质。
四川省科技支撑计划项目;国家生猪产业技术体系项目(CARS-36);四川省“十二五”畜禽育种攻关项目(2011NZ0099-1)。
