食品过敏原巴西坚果环介导等温扩增检测方法的建立与应用
2014-03-01陈源树李志勇高东微广东出入境检验检疫局检验检疫技术中心广东广州5063广州迪澳生物科技有限公司广东广州50663
刘 津,陈源树,凌 莉,李志勇,张 璜,高东微,*(.广东出入境检验检疫局检验检疫技术中心,广东广州5063;.广州迪澳生物科技有限公司,广东广州50663)
食品过敏原巴西坚果环介导等温扩增检测方法的建立与应用
刘 津1,陈源树1,凌 莉1,李志勇1,张 璜2,高东微1,*
(1.广东出入境检验检疫局检验检疫技术中心,广东广州510623;2.广州迪澳生物科技有限公司,广东广州510663)
根据巴西坚果2S白蛋白基因序列,利用设计软件Primer Explorer Version 4设计并筛选了食品过敏原巴西坚果的环介导等温扩增引物,对反应体系和反应条件进行了优化,建立了巴西坚果的环介导等温扩增检测方法,结果判断可采用实时荧光法和荧光染料终点显色法。以澳洲坚果、开心果、碧根果等17种常见坚果来验证方法的特异性;将巴西坚果DNA进行梯度稀释后验证方法的灵敏度;将0.5%、1%和1.5%3个浓度梯度的巴西坚果DNA重复检测20次来验证方法的稳定性。结果表明,本方法能够特异、灵敏、稳定地检测食品中的巴西坚果成分,检测低限为0.5%。此外,对7种市售食品样品的检测结果表明,该方法与食品标签标示的过敏原成分结果吻合率为100%,假阳性率和假阴性率均为0%。
食品过敏原,巴西坚果,环介导等温扩增,检测方法
巴西坚果(Bertholletia excelsa)又名巴西栗,是玉蕊科巴西栗属的植物。巴西坚果外形特别像鲍鱼,所以商品名叫鲍鱼果。巴西坚果营养丰富,是常见的、广泛食用的树生坚果[1-2]。巴西坚果引起的过敏症状包括咽痒、唇肿、发声困难、呼吸困难、哮喘、黄斑疹等[3],因此巴西坚果属于食品过敏原标识管理的重要种类。国际食品法典委员会制定的国际标准CODEX STAN 1-1985《预包装食品标签通则》明确规定了包括巴西坚果在内的多种树生坚果及其产品必须在预包装食品标签上予以声明[4]。在国际标准的基础上,世界各国纷纷颁布了各自的法规标准,对巴西坚果这种过敏原成分的标识管理进行了详细的规定。欧盟委员会指令2007/68/EC和美国《食品过敏原标识和消费者保护法案》(The Food Allergen Labeling and Consumer Protection Act,FALCPA)均明确规定巴西坚果属于必须明确标识的食品过敏原[5-6]。我国在各级食品标准中也做出了类似的规定,例如《GB 7718-2011预包装食品标签通则》、《GB/T 23779-2009预包装食品中的致敏原成分》等均对此有明确的规定[7-8]。
食品过敏原标识管理法规和标准的有效实施依赖于食品过敏原检测技术。但是,目前为止国内外都没有发布巴西坚果过敏原成分的标准检测方法,国外对巴西坚果的检测通常采用一种商业化过敏原蛋白质免疫层析快速检测技术,国内对巴西坚果尚未建立任何达到行业应用水平的通用方法。这种现状已经严重影响了过敏原标识管理相关法规标准的科学有效实施。因此,在预包装食品过敏原检验技术领域,目前急需制定更加普适、简便、准确、成本低廉的巴西坚果过敏原检测方法,使之适用于食品企业品质安全检验和进出口食品实验室检验。
环介导等温扩增法(Loop-mediated Isothermal Amplification,LAMP)是2000年由Notomi等发明的一种新颖的恒温核酸扩增方法,具有操作简便、对仪器设备需求低、高特异性和高灵敏度、扩增高效快速、结果判读简便等特点[9]。目前,LAMP技术已经在食品安全、公共卫生安全监测和应急检测、临床医学诊断、生物安全、生物识别等专业技术领域获得了广泛的应用[10-12]。本文以巴西坚果的2S蛋白基因序列为检测目标基因,建立可采用终点显色法和实时荧光法监测食品中巴西坚果过敏原成分的LAMP检测方法。
1 材料与方法
1.1 材料与仪器
巴西坚果(Brazil nut,Bertholletia excelsa)、澳洲坚果(Macadamia nut,Macadamia ternifolia)、开心果(Pistachio,Pistacia vera)、核桃(Walnut,Juglans regia)、碧根果(Pecan,Carya illinoensis(Wangh.)koch)、腰果(Cashew,Anacardium occidentalie)、松籽(Korean Pine nut,Pinus koraiensis)、榛子(Hazelnut,Corylus avellana)、美国大杏仁(Almond,Amygdalus communis)、葵花籽(Sunflower seed,Helianthus annuus)、板栗(Chestnut,Castanea mollissima)、苦杏仁(Bitter apricot seed,Semen Armeniacae Amarum)、南瓜籽(Pumpkin seed,Cucurbita moschata)、莲 子(Lotus seed,Semen Nelumbinis)、大米(Rice,Oryza sativa) 均购于广州市各大超市;Promega Wizard®基因组DNA纯化试剂盒 北京盈田卓越科技有限公司;Ex Taq、dNTPs宝生物工程(大连)有限公司;甜菜碱、Bst DNA聚合酶、10×ThermoPol缓冲液 Sigma公司;1000×SYBR GreenⅠ 厦门致善生物科技有限公司;SYTO-9 Invitrogen公司;LAMP引物 上海生工生物工程有限公司;r-biopharm®巴西坚果快速检测试纸条(BL 602) 拜发分析系统销售(北京)有限公司。
NANODROP 1000型核酸蛋白分析仪 美国NANODROP科技有限公司;ABI 7500型实时荧光定量PCR仪 美国应用生物系统公司;恒温金属浴 杭州奥盛仪器有限公司;GelDoc XR+型凝胶成像系统 美国伯乐生命医学产品有限公司。
1.2 实验方法
1.2.1 DNA模板的提取和纯化 根据GB/T 19495.3-2004规定[13],采用标准方法从供试材料中提取植物基因组DNA,用核酸蛋白分析仪测定DNA的浓度和纯度,将DNA溶液稀释至100ng/滋L,-20℃保存备用。对提取出的植物基因组DNA用植物通用引物Plant 159进行检测[14],检测结果阳性表明提取出适宜进行扩增的DNA,否则应重新进行DNA提取和纯化。
1.2.2 引物的设计与筛选 根据GenBank数据库中巴西坚果2S白蛋白(Bertholletia excelsa 2S albumin),Accession no.AB044391.1)基因序列,通过Blast在线比对软件进行分析,在巴西坚果序列的种特异性区域,利用LAMP引物在线设计软件Primer Explorer Version 4分别设计包括两条外引物F3、B3、两条内引物FIP、BIP的LAMP引物各3套,由上海生工生物工程有限公司合成。根据引物的扩增效果选取较佳的引物,随后使用Primer Explorer Version 4设计环引物。所选引物见表1和图1。

表1 巴西坚果LAMP扩增引物序列Table 1 The primers for brazil nut LAMP assay

图1 六条LAMP检测引物在巴西坚果2S白蛋白基因上所对应的区域Fig.1 The location of primers for LAMP assay in the Bertholletia excels 2S albumin gene
1.2.3 LAMP反应体系的建立 根据已有的文献[8],初步确定25滋L的LAMP反应体系:内引物FIP和BIP各1.6滋mol/L,外引物F3和B3各0.2滋mol/L,环引物LF和LB各0.8滋mol/L,1×ThermoPol缓冲液,1mol/L甜菜碱,6mmol/L MgSO4,1.6mmol/L dNTP,0.32U/μL Bst DNA聚合酶,DNA模板200ng。将LAMP反应体系配制完成后置于0.2mL离心管中,在离心管中加入1滴石蜡油以避免反应体系挥发和污染。
LAMP反应可采用两种结果判读方法,一是荧光染料显色法(Fluorescent Dyes),二是实时荧光法。
荧光染料显色法是在上述管盖内壁加入1μL 1000×SYBR GreenⅠ。盖管盖时应小心,防止显色液混合进入反应液中。然后将其置于金属浴在63℃恒温反应90min,最后80℃灭活5min结束反应。反应结束后,将离心管上下颠倒混匀或离心,使盖内壁的SYBR GreenⅠ与反应液混合,观察离心管中反应液颜色。如发生特异性扩增,溶液变为绿色,否则保持SYBR GreenⅠ橙色不变。
实时荧光法是在反应体系中加入0.2μmol/L SYTO-9,通过实时荧光PCR仪设定Holding Stage为63℃30s,1个循环;Cycling Stage为63℃15s,63℃45s,90个循环,于63℃45s处收集荧光信号,荧光通道为FAM。
1.2.4 LAMP引物的筛选 用巴西坚果DNA作为模板,用大米DNA作为阴性对照,每组对照分别设置2个平行,通过实时荧光法实时监测LAMP反应。通过观察实时荧光的扩增曲线,根据起始扩增时间、扩增曲线的重复性等指标对引物进行筛选。
1.2.5 LAMP反应体系和反应条件的优化 根据文献报道,反应温度、反应时间、镁离子浓度、甜菜碱浓度和dNTPs浓度是影响LAMP扩增效果的重要因素。由于Bst DNA聚合酶最适温度在60~65℃,本文选取60、61、62、63、64、65℃6个温度条件进行LAMP反应,通过实时荧光法监测LAMP反应,选取适宜的温度。在适宜的温度下,依次对Mg2+、甜菜碱和dNTPs浓度和反应时间进行优化,其中Mg2+选取了4、6、8、10mmol/L 4个浓度梯度,甜菜碱选取了0.6、0.8、1.0、1.2mol/L 4个浓度梯度,dNTPs选取了1.2、1.4、1.6、1.8mmol/L 4个浓度梯度。通过实时荧光法监测LAMP反应,确定最佳反应体系和反应条件。
1.2.6 特异性实验 高度特异性是过敏原检测方法必须具备的基本特性,为此利用建立的LAMP方法对巴西坚果、腰果、花生、澳洲坚果、碧根果、杏仁、开心果、葵瓜子、板栗、榛子、核桃、南杏、北杏、松子、南瓜子、西瓜子、莲子共17种常见的坚果进行LAMP扩增,同时采用显色法和实时荧光法进行检测。
1.2.7 灵敏度实验 为确定本方法的相对灵敏度,用100ng/μL的大米DNA为基质,用100ng/μL的巴西坚果DNA按照体积比制成不同梯度浓度(0%、0.05%、0.1%、0.5%、1%、5%、10%)的巴西坚果模拟样品DNA,用不同浓度梯度的模拟样品DNA进行LAMP扩增,每个浓度设置2个平行,用实时荧光法和显色法同时进行灵敏度测试。
1.2.8 稳定性实验 为评估本方法的稳定性,对0.5%、1%、5%的巴西坚果模拟样品DNA进行LAMP扩增,每个浓度分别采用实时荧光法和显色法重复20次,同时以0%的巴西坚果模拟样品DNA作为阴性对照,用以测试本方法的稳定性。
1.2.9 适用性实验 对进口商品和市售商品共计7份预包装食品进行检测,通过验证本方法的检测结果与商品标签上的过敏原信息是否相符来评价本方法检测实际食品样品中巴西坚果过敏原成分的能力。同时采用商业化快速检测试纸条进行检测,将两种方法进行对比。
2 结果与分析
2.1 LAMP引物筛选
本文针对巴西坚果2S白蛋白基因序列设计了3套LAMP检测引物,通过LAMP反应实时荧光法结果显示,第1套引物未出现对数扩增,第2套引物出现对数扩增时间约为25min,两个平行重复性较好,第3套引物出现对数扩增时间约为55min。因此,选取第2套引物进行下一步的实验,为了增加扩增效率,引入环引物一对,见表1和图1。
2.2 LAMP反应体系和反应条件的优化
根据实时荧光法监测结果显示,在25μL反应体系中,当Mg2+浓度为6mmol/L、甜菜碱浓度为1mol/L、dNTPs浓度为1.6mmol/L,在63℃反应45min,LAMP反应扩增效果最好。最佳反应体系和条件下第2套引物的LAMP实时荧光法检测结果见图2。

图2 巴西坚果LAMP检测方法最佳反应体系结果图(实时荧光法)Fig.2 The results of optimum reaction system for Brazil nut LAMP detection method(RT-LAMP)
2.3 特异性实验
利用建立的LAMP方法对巴西坚果及其他16种坚果进行特异性扩增。实时荧光法和显色法的实验结果分别见图3和图4,可知仅巴西坚果出现特异性扩增,且SYBR Green I显色为绿色。在其他坚果中均未得到任何扩增产物,表明建立的LAMP方法对巴西坚果具有高度的特异性。
2.4 灵敏度实验
实时荧光法和显色法的实验结果分别见图5和图6。
结果表明:LAMP显色法和实时荧光法均可检出100%、10%、5%、1%、0.5%的巴西坚果阳性样品,不能检出0.1%和0.05%的阳性样品。LAMP实时荧光法的检测结果显示巴西坚果浓度越高,开始出现指数扩增的时间越短,Ct值越小。灵敏度实验结果表明,本标准检测方法对巴西坚果的最低检测限可达0.5%。

图3 巴西坚果LAMP检测方法特异性实验结果(实时荧光法)Fig.3 The results of specificity evaluation on Brazil nut LAMP detection method(RT-LAMP)

图4 巴西坚果LAMP检测方法特异性实验结果(荧光染料显色法)Fig.4 The results of specificity evaluation on Brazil nut LAMP detection method(Fluorescent Dyes)
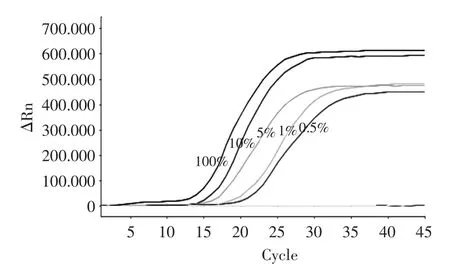
图5 巴西坚果LAMP检测方法灵敏度实验结果(实时荧光法)Fig.5 The results of sensitivity evaluation on Brazil nut LAMP detection method(RT-LAMP)

图6 巴西坚果LAMP检测方法灵敏度实验结果(显色法)Fig.6 The results of sensitivity evaluation on Brazil nut LAMP detection method(Fluorescent Dyes)
2.5 稳定性实验
稳定性实验结果显示所有样品和各次重复中均能得到准确稳定的检测结果,假阳性率和假阴性率均为0%,表明本方法具有良好的稳定性和重复性。
2.6 适用性实验
实际样品检测结果见表2。LAMP检测显色法、实时荧光法和商业化快速检测试纸条的检测结果与配料表中所标识的巴西坚果是否存在的实际情况完全一致,假阳性率和假阴性率均为0%,表明本文建立的巴西坚果LAMP检测方法可用于预包装食品中巴西坚果的检测。
3 结论
建立了食品中巴西坚果过敏原成分的LAMP检测方法,该方法适用于预包装食品中巴西坚果的特异性检测,灵敏度达到0.5%,具有良好的稳定性和特异性,在检测市售实际样品时检测结果与标签中的过敏原信息完全相符。
建立的巴西坚果LAMP检测方法是基于巴西坚果DNA片段的检测方法,与基于蛋白质的检测方法相比,优点在于DNA的稳定程度比蛋白质高,在食品加工过程中不易被破坏,因此本方法可以更加稳定的检测出食品中微量的过敏原成分,并且与商业化蛋白质快速检测试纸条的性能相当。与其他基于基因检测的方法相比,例如传统的PCR方法和实时荧光PCR方法,本方法的优点在于恒温扩增,省略了温度循环所需时间和能量,能达到快速检测的目的,但是性能完全能够达到传统PCR方法或实时荧光PCR方法的技术水平。本方法可以采用终点显色法进行结果判断,无需昂贵的仪器设备,只需金属加热块或水浴锅即可进行检测,适合基层实验室推广应用;也可以采用实时荧光法进行实时监控,更加精确的判断结果,适合于中、大型的实验室推广应用。
[1]Sun SS,Altenbach SB,Leung FW.Properties,biosynthesis and processing of a sulfur-rich protein in Brazil nut(Bertholletia excelsa H.B.K.)[J].Eur J Biochem,1987,162:477-483.
[2]Venkatachalam M,Sathe SK.Chemical composition of selected edible nut seeds[J].J Agric Food Chem,2006,54:4705-4714.
[3]Borja JM,Bartolome B,Gomez E,et al.Anaphylaxis from brazil nut[J].Allergy,1999,54:1007-1008.
[4]Codex Almentarius Commission.CODEX STAN 1-1985 General standard for the labelling of prepackaged foods[S].
[5]The commission of the European Communities.Commission Directive 2007/68/EC of 27 November 2007 amending Annex IIIa to Directive 2000/13/EC of the European Parliament and of the Council as regards certain food ingredients[S].
[6]U.S.the Food and Drug Administration.The Food Allergen Labeling and Consumer Protection Act[S].
[7]中华人民共和国卫生部.GB 7718-2011预包装食品标签通则[S].北京:中国标准出版社,2011.
[8]中华人民共和国国家质量监督检验检疫总局.GB/T 23779-2009预包装食品中的致敏原成分[S].北京:中国标准出版社,2009.
[9]TOMITA N,MORI Y,KANDA H,et al.Loop-mediated isothermal amplification(LAMP)of gene sequences and simple visual detection of products[J].Nature Protocols,2008(3):877-882.
[10]NJIRU ZK,YEBOAH-MANU D,STINEAR TP,et al.Rapid and sensitive detection of Mycobacterium ulcerans by use of a loop-mediated isothermal amplification test[J].Clin Microbiol,2012,50(5):1737-1741.
[11]BÜHLMANN A,POTHIER JF,REZZONICO F,et al.loopmediated isothermal amplification(LAMP)assay for rapid pathogen detection and on-site diagnosis of fire blight[J].J Microbiol Methods,2013,92(3):332-339.
[12]MAHONY J,CHONG S,BULIR D,et al.Development of a sensitive loop-mediated isothermal amplification assay that provides specimen-to-result diagnosis of respiratory syncytial virus infection in 30 minutes[J].Clin Microbiol,2013,51(8):696-701.
[13]中华人民共和国国家质量监督检验检疫总局.GB/T 19495.3-2004转基因产品检测核酸定性PCR检测方法[S].北京:中国标准出版社,2007.
[14]Han Jianxun,Wu Yajun,Huang Wensheng,et al.PCR and DHPLC methods used to detect juice ingredient from 7 fruits[J]. Food Control,2012,25(2):696-703.
Construction and application of loop-mediated isothermal amplification method for detection of brazil nut as a food allergen
LIU Jin1,CHEN Yuan-shu1,LING Li1,LI Zhi-yong1,ZHANG Huang2,GAO Dong-wei1,*
(1.Guangdong Inspection&Quarantine Technology Center,Guangzhou 510623,China;2.Guangzhou Diao Bio-Technology Co.,Ltd.,Guangzhou 510663,China)
According to the Bertholletia excels 2S albumin gene sequences,this article designed and screened sets of loop-mediated isothermal amplification(LAMP)primers using a design software named Primer Explorer Version 4,then established the relevant LAMP method for detection of Brazil nut as a food allergen,whose results could be measured by real-time fluorescence or using a fluorescent dyes in the end reaction.The specificity of this method was evaluated by detection of 17 nut samples include macadamia nut,pistachio,pecan,and so on.The sensitivity was tested using DNA gradient dilutions,and the stability was assessed with detection of 0.5%,1%,1.5%gradient dilutions of Brazil nut DNA for 20 times.It was indicated that this method had satisfied specificity,sensitivity and stability in the identification of Brazil nut in foods with a LOD of 0.5%.In addition,the detection of 7 market food samples using this method showed the 100%consistency to the labeled information of allergen ingredients with 0%false positive and negative rates.
food allergen;brazil nut;loop-mediated isothermal amplification(LAMP);detection method
TS255.6
A
1002-0306(2014)14-0076-05
10.13386/j.issn1002-0306.2014.14.007
2013-11-19 *通讯联系人
刘津(1983-),女,硕士研究生,工程师,研究方向:食品分子生物学检测(包括转基因、过敏原、动物源性成分检测等)。
出入境检验检疫行业标准制定计划项目(2012B141)。
