离子强度和离子类型对土霉素在草甸土中被吸附的影响
2014-02-28王东升张婷晁宇
王东升,张婷,晁宇
辽宁工程技术大学环境科学与工程学院,辽宁 阜新 123000
离子强度和离子类型对土霉素在草甸土中被吸附的影响
王东升,张婷,晁宇
辽宁工程技术大学环境科学与工程学院,辽宁 阜新 123000
土霉素是四环素类抗生素中使用较为广泛的一种,探索土霉素在土壤中的吸附解吸规律对抗生素环境风险评价与污染控制具有重要的理论与现实意义。通过改变土壤水溶液中离子强度及类型研究其对土霉素在草甸土中吸附的影响,以期为评价该种抗生素对草甸土土壤环境风险提供科学依据。土霉素测定方法选择高效液相色谱法。以V(乙腈)∶V[NaH2PO4(0.01 mol·L-1)]=25∶75为流动相,在流速为1 mL·min-1,检测波长为355 nm条件下进行测定。试验以OECD Guideline 106为基础,采用批平衡法研究不同离子强度(0.01、0.03、0.05、0.08、0.10 mol·L-1CaCl2溶液)和不同阳离子(0.01 mol·L-1的NaCl、KCl、MgCl2溶液)对土霉素在草甸土中的吸附影响。结果表明:随着CaCl2浓度的增加,土霉素在草甸土中的吸附量呈降低趋势,且不同浓度的土霉素在草甸土中吸附量受离子强度的影响是不同的。土霉素浓度较低时,其在草甸土中吸附能力受离子强度影响较土霉素浓度高时小。以土壤吸附系数Kd衡量土壤吸附抗生素能力,当土壤样品中离子强度增大时,其对应Kd值呈非线性趋势减小。这说明,在某一Ca2+浓度范围内,其对吸附的影响较其他浓度范围要大。对相邻CaCl2浓度处理得出的Kd值进行t检验,在CaCl2溶液浓度在0.01与0.03 mol·L-1间得出的Kd值存在显著性差异(p≤0.05),在0.03、0.05、0.08、0.10 mol·L-1浓度间得出的Kd值均没有显著性差异(p>0.05)。这一结果说明当CaCl2溶液浓度在0.01~0.03 mol·L-1时,其对土霉素在草甸土中的吸附影响较其他浓度范围大。以Freundlich方程对NaCl、KCl、MgCl2溶液条件下土霉素在草甸土中的吸附进行拟合,土样lg Kf值为lg Kf(Mg2+)<lg Kf(Na+)<lg Kf(K+),经过方差分析,不同阳离子对lg Kf的影响均未达到显著性差异(p>0.05)。这说明,不同阳离子对土霉素在草甸土上的吸附量(lg Kf)影响的差异并不显著。
土霉素;吸附;草甸土;离子强度;离子类型
抗生素的发现在人类预防疾病和促进畜牧业发展等方面做出了十分重要的贡献(王冉等,2006)。但随着近年来抗生素的使用量逐渐增大,抗生素类药物对土壤环境的污染问题也引起了国际社会的普遍关注(Glen等,2003;陈昦等,2008;武庭瑄等,2009;刘新程等,2008;Davis等,2006)。四环素类抗生素的生产与使用量在世界上排名第2而在中国排名第1(Cheng,2005)。土霉素是四环素类抗生素中使用较为广泛的一种。畜禽等体内的抗生素大部分以药物母体或代谢物的形式随粪便或尿液排出体外(土方浩,2006;Meyer,2000)。当以畜禽粪便为肥料施入土壤时,抗生素类药物随之转移进入土壤环境。研究表明,目前全球许多地区均能检测出抗生素的存在,有些地区土壤中检出的土霉素质量分数甚至高达200 mg·kg-1(王冉等,2006)。抗生素进入土壤环境中则会随着地表径流,降水等多种途径进入到地表水体与地下水体中(Kay等,2005)。这样无疑会对人类的健康产生不利影响(Kummerer,2001)。土壤及水环境中低浓度抗生素长期暴露,对生态环境植物产生毒性影响,且这种影响随着生物放大作用,进入食物链,会对人类健康产生不良影响。土壤中的抗生素随着降水等作用的迁移,还会进入地表或地下水体,从而对水环境产生安全威胁(陈育枝等,2006;张许科和刘兴金,2002)。
目前,四环素类抗生素在土壤中的吸附-解吸行为已成为国际上的研究热点之一。其研究主要集中在此类抗生素在土壤中的吸附-解吸行为及其影响因素这些方面上。土壤中含有多种且大量的阳离子,随着人类对土壤施用粪肥,又会有大量的阳离子进入土壤,有研究表明土霉素能够与土壤中的阳离子形成2∶1的复合体(Cheng,2005),从而使
土霉素在土壤中的环境行为发生改变。
国内外对抗生素在土壤中的环境行为虽已有一些研究报道,但关于草甸土中抗生素的研究未见报道。草甸土发育于冲积母质,是受地下水或潜水影响的半水成土壤。长期或季节性积水的湿地通常与浅层地下水的关系十分密切,两者间水文联系是湿地物质迁移转化的重要驱动力,对地下水的水文过程和水质演化具有重要影响(王磊和章光新,2007)。草甸土肥力水平较高,生产潜力较大,已广为利用。草甸土物质组成和理化性质受人类生产活动影响较大,是土壤污染的高风险区,也是土壤污染物向水环境迁移的临界区。本试验通过对不同类型阳离子存在,以及不同离子强度条件下,土霉素在草甸土上吸附的影响,揭示其迁移规律。以期为抗生素对土壤及水环境影响风险评价提供科学依据。

表1 供试土壤理化性质Table 1 Physiochemical properties of the two tested soils
1 材料与方法
1.1 供试材料
土霉素标准品(纯度为97.5,购自中国药品生物鉴定所);土霉素购自大连容海生物科技有限公司;乙腈为色谱纯,购自沈阳市华东试剂厂;其他化学试剂均为分析纯;实验用水为蒸馏水。
供试土壤为草甸土。采于辽宁省锦州市,均为0~20 cm土层样品,土壤样品不含任何抗生素类药物,2种土样风干磨细过60目筛备用。供试土壤理化性质,见表1。
1.2 吸附试验方法
1.2.1 离子强度
吸附试验参照OECDguideline 106批平衡方法进行。称取土样1.0000 g(精确至0.9995~1.0005 g)于50 mL离心管中,按照水土比25:1加入25 mL不同浓度的土霉素溶液(用浓度梯度为0.01、0.03、0.05、0.08、0.10 mol·L-1CaCl2溶液配制),使土壤悬浊液中土霉素的起始质量浓度为2.5、5.0、10.0 mg·L-1。在恒温25 ℃下于200 r·min-1震荡12 h后,4000 r·min-1下离心15 min,取上清液,经0.45 μm水系滤膜过滤后,为防止土霉素在水相中降解,在滤液中加入一滴6 mol·L-1HCl使其pH将至2~3(Stephen和linda,2005),然后用HPLC测定溶液中土霉素浓度。以上处理均做3个重复,其中未含土霉素的处理作为空白,未含土壤的处理作为对照。
用吸附前后溶液中土霉素浓度之差计算得到2种土样对土霉素的吸附量,同时利用等温吸附方程拟合(张劲强等,2005;姚圆等,2010;李兆君等,2008;刘新程等,2010)。
1.2.2 不同阳离子的影响
参照1.2.1离子强度试验方法,改变其中用不同浓度梯度CaCl2溶液配制不同浓度土霉素溶液为用0.01 mol·L-1NaCl、KCl、MgCl2溶液配制,使土壤悬浊液中土霉素的起始质量浓度梯度为2.0、5.0、10.0、15.0、20.0 mg·L-1,测定土霉素在2种土样中的吸附参数(Wang等,2008)。
1.2.3 土霉素的测定
土霉素测定的高效液相色谱(HPLC)仪器条件:普析L600高效液相色谱仪,配置UV检测器,手动进样器,色谱柱为Pgrandsil-STC-C18(5 μm,4.6 mm×250 mm)。进样量为10 μL,柱温25 ℃,土霉素采用V(乙腈)∶V[NaH2PO4(0.01 mol·L-1)]=25∶75为流动相,流速为1 mL·min-1,检测波长为355 nm。该色谱条件下土霉素的保留时间为7.30 min。
2 结果与讨论
2.1 离子强度对吸附的影响
图1为2种土样对抗生素的吸附量随不同离子强度的变化趋势。其中,纵坐标代表的是吸附量,既每千克土壤能够吸附抗生素的量,横坐标则代表配制土霉素溶液时所用CaCl2溶液浓度。显然,随着CaCl2浓度的增高,2种土样对土霉素的吸附量皆成降低趋势且2种土样吸附量降低趋势基本一致。由图1可见,在2种土样中,不同浓度的土霉素在草甸土中的吸附受CaCl2离子强度的影响是不同的。当土霉素浓度低时,其在草甸土中的吸附受CaCl2离子强度的影响较土霉素浓度高时要小些。在低浓度土霉素情况下,草甸土中有较多的吸附位点,土霉素能被草甸土充分吸附,离子强度的变化对土霉素吸附的影响较小。在高浓度土霉素情况下,Ca2+离子强度发生改变时,对土霉素吸附量的影响较大。土壤胶体上的吸附点位是决定吸附量的主要因素。Ca2+离子强度增大,与土霉素竞争土壤胶体上的吸附点位是影响土霉素吸附量的主要原因。因此,在石灰性土壤中,由于Ca2+的存在,对
土霉素的吸附产生影响。进而影响其水-土界面环境行为。因为有陪补离子的存在,土霉素吸附量减少,使其进入水环境的风险加大。
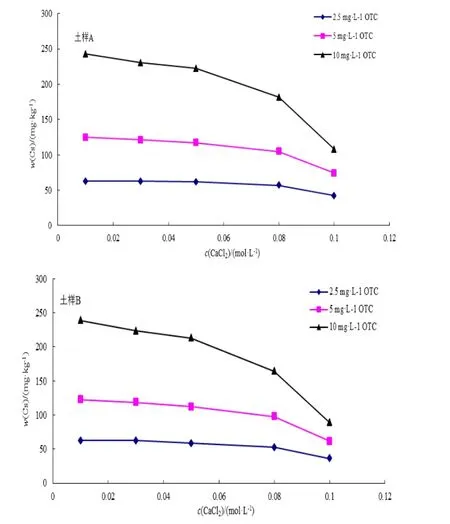
图1 不同CaCl2浓度下2种土样中土霉素吸附平衡时的吸附量Fig.1 Adsorption capacity of OTC in the two soils on different CaCl2concentration
土壤吸附系数Kd是土霉素土壤吸附量与平衡溶液中土霉素浓度之比,以Kd值作为衡量土壤吸附抗生素的标准在近年来被广泛采用。由表2可见,随着土壤样品中CaCl2浓度增大,其对应Kd值是逐渐减小的,且此种减小趋势是非线性的。这说明,草甸土吸附土霉素的能力是随着土壤中Ca2+浓度的增大而减弱的。又因Ca2+对草甸土吸附土霉素的能力的影响是一种非线性的过程,这就说明,有可能在某一Ca2+浓度范围内,其对吸附的影响较其他浓度大。对2种土样中相邻CaCl2浓度处理得出的Kd值进行t检验。结果表明,在CaCl2溶液浓度为0.01与0.03 mol·L-1间得出的Kd值均存在显著性差异(p≤0.05),而在0.03、0.05、0.08、0.10 mol·L-1间得出的Kd值均没有显著差异(p>0.05)。这说明,当土壤中CaCl2溶液浓度为0.01~0.03 mol·L-1时,其对土霉素在草甸土中的吸附影响较其他浓度范围大。Kreuzig等(2003)认为如果污染物在土壤中吸附系数Kd值小于2,就有可能淋溶并影响到地下水安全的风险(Kreuzig等,2003)。由表2可见,当Ca2+浓度在0.08、0.10 mol·L-1时,土霉素在草甸土中的Kd值几乎全部小于2,这也表明当土壤中Ca2+浓度较大时,草甸土吸附土霉素的能力减弱,土霉素易通过淋溶作用进入地下水,从而威胁地下水安全。
由于不同离子强度的作用,2种土样中土霉素吸附是非线性的过程,因此以Freundlich模型对其进行拟合。拟合所得参数见表3。
由表3可见,2种土样皆可以用Freundlich模型进行良好的拟合。Freundlich方程的拟合参数lg
Kf代表土壤对土霉素的吸附容量,2种土样lg Kf值均表现出随着CaCl2溶液浓度增加而减小的趋势。这说明随着离子强度的增强,土霉素在草甸土中的吸附量降低。Freundlich方程拟合参数1/n<1说明土壤对污染物的吸附是物理吸附,吸附比例随着污染物浓度的增加而减少。如表3所见,2种土样中1/n值均小于1,这说明草甸土对土霉素的吸附比例随着土霉素浓度的增加而减少。
2.2 不同离子对土霉素吸附作用的影响
不同离子类型的存在对土霉素在草甸土中吸附的影响存在差异。以Freundlich方程对NaCl、KCl、MgCl2溶液条件下土霉素在草甸土中的吸附进行拟合(Wessels等,1998;Schmitts和Schneider,2000)。拟合所得参数见表4。
由表4可见,不同阳离子条件下,2种土样lg Kf值均为lg Kf(Mg2+)<lg Kf(Na+)<lg Kf(K+)。经过方差分析,2种土样不同阳离子对lg Kf的影响均未达到显著性差异(p>0.05)。这说明不同阳离子对土霉素在草甸土上的吸附量(lg Kf)影响的差异并不显著。造成这一结果的原因可能是草甸土土壤胶体主要带负电,而土霉素在中性和碱性条件下主要以中性离子和碱性离子的形式存在,土霉素在草甸土中的吸附不是以阳离子交换的方式进行的而是以胶体表面范德华力对大分子土霉素的吸附的方式进行的。因而阳离子的改变对土霉素在草甸土中的吸附影响并不显著。这一结果与包艳宇等(2009)报道的阳离子类型对土壤吸附土霉素的研究结果相一致,但这一结论与张劲强等(2007)研究的不同价态阳离子对诺氟沙星在土壤中的吸附结果不同。这也说明,不同类型的抗生素在同一环境介质上的吸附机理是不同的,因此受阳离子类型影响的程度也不相同。
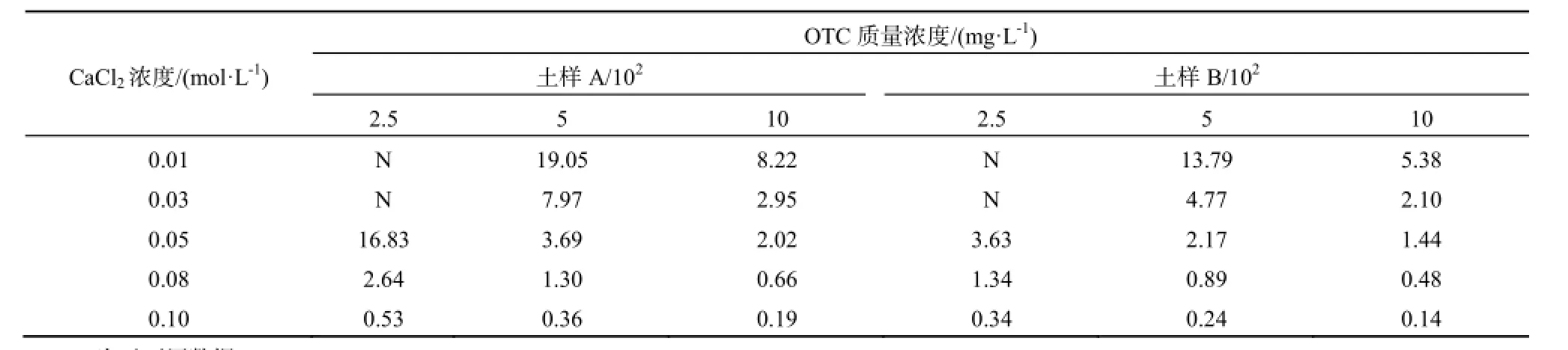
表2 不同CaCl2浓度下土霉素2种土样中的Kd值(L·kg-1)Table 2 Kdvable of OTC in the two soils on different CaCl2concentration(L·kg-1)
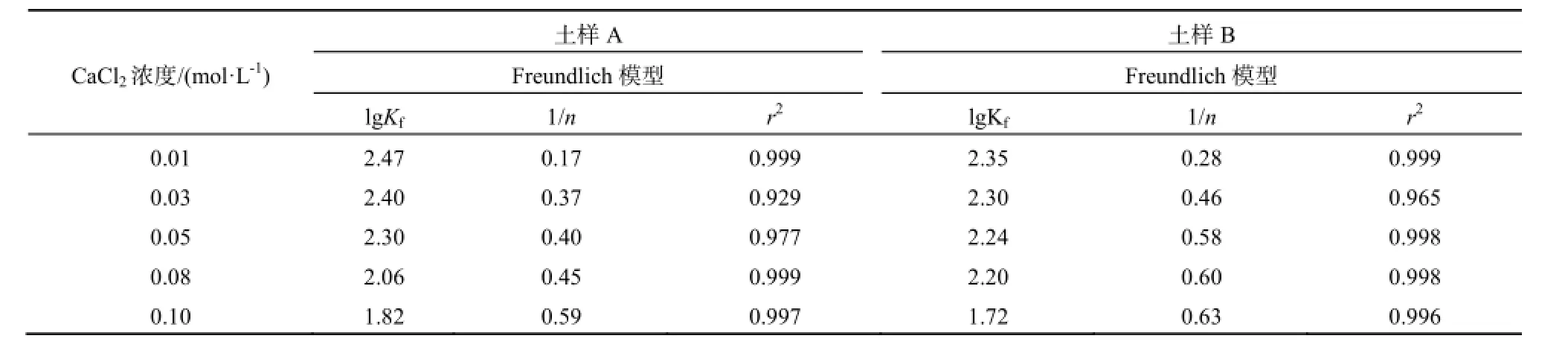
表3 不同CaCl2浓度下的吸附模型参数Table 3 Sorption parameters for the model on different CaCl2concentration
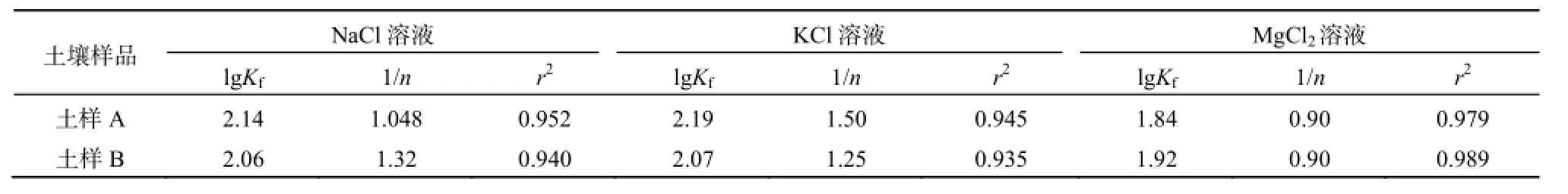
表4 不同阳离子对2中土样中土霉素吸附的影响Table 4 Sorption of OTC in two soils with the exsistence of different cations
3 结论
1)Ca2+离子强度增大,与土霉素竞争土壤胶体上的吸附点位,是影响土霉素吸附量的主要原因。土霉素在草甸土中的吸附量随着Ca2+离子强度的增大而降低且不同浓度的土霉素在草甸土中的吸附受CaCl2离子强度的影响是不同的,当土霉素浓度较低时,其在草甸土中的吸附受Ca2+离子强度的影响较土霉素浓度高时要小些。可见,在抗生素浓
度较高且Ca2+离子强度较大的条件下,草甸土吸附土霉素的能力减弱,土壤中土霉素的吸附量减少,土霉素易通过淋溶作用进入地下水,进而对地下水环境安全产生威胁。
2)土霉素在草甸土中的吸附可以用Freundlich模型进行良好的拟合。对相邻CaCl2浓度处理得出的Kd值进行t检验,结果表明只有在0.01与0.03 mol·L-1间得出的Kd值均存在显著性差异(p≤0.05),而在0.03、0.05、0.08、0.10 mol·L-1间得出的Kd值均没有显著差异(p>0.05)。这说明Ca2+离子浓度0.01~0.03 mol·L-1时,其对土霉素在草甸土中的吸附影响较其他浓度范围大。
3)不同阳离子条件下,2种土样lgKf值均为lgKf(Mg2+)<lgKf(Na+)<lgKf(K+)。对其进行方差分析均未达显著性差异,可见不同阳离子对土霉素在草甸土上的吸附量影响并不明显,这与土霉素在草甸土上的吸附以范德华力为主而非阳离子交换形式为主有关。
CHENG G. 2005. Interaction of Tetracycline with Aluminum and Iron Hydrous Oxides [J]. Environmental Science Techno1ogy, 39: 2660-2667.
DAVIS J G, TRUMAN C C, KIM S C. 2006. Antibiotic transport via runoff and soil loss[J]. Journal of Environmental Quality, 35: 2250-2260.
GLEN R B, HELGE R, DEBORAH A G, et al. 2003. Pharmaceuticals and personal care products (PPCPs) in surface and treated waters of Louisiana, USA and Ontario, Canada [J]. Science of the Total Environment, 311: 135-149.
KAY P, BLACKWELL P A, BOXALL A B A. 2005. Alysimeter experiment to investigate the leaching of veterinary antibiotics through a clay soil and comparison with field data[J]. Environmental Pollution, 134: 333-341.
KREUZIG R, KULLMER C, MATTHIES B, et al. 2003. Fate and behavior of pharmaceutical residues in soils[J]. Fresen Environ Bull, 12: 550-558.
KUMMERER K. 2001. Drugs in the environment:emission of drugs, diagnostic aids and disinfectants into wastewater by hospitals in relation to other sources- a review[J]. Chemosphere, 45: 957-969.
MEYER M T, BUMGARNER J E, VARNS J L, et al. 2000. Use of radioimmunoassay as a screen for antibiotics in confind animal feeding operations and confirmation by liquid chromatography/Mass spectrometry[J]. Science of The Total Environment, 248: 181-187.
OECD guidelines for testing of chemicals. 2000. Test guideline 106: Adsorption /desorption using a batch equilibrium method[S]. Revised draft document, Paris: OECD: 1-45.
SCHMITTS M O, SCHNEIDER S. 2000. Spectroscopic investigation of complexation between various tetracyclines and Mg2+or Ca2+[J]. Phys Chem Comm, 9: 1-14.
STEPHEN A S, LINDA S L. 2005. Sorption of Three Tetracyclines by Several Soils: Assessing the Role of pH and Cation Exchange [J]. Environmental Science Technology, 39: 7452-7459.
WANG Y J, JIA D A, SUN R J, et al. 2008. Adsorption and cosorption of tetracycline and Cu on montmorillonite[J]. Environmental Science Technology, 42: 3254-3259.
WESSELS J M, FORD W E, SZYMCZAK W, et al. 1998. The complexation of tetracycline and anhydrotetracyline with Mg2+and Ca2+: A Spectroscopic Study[J]. Phys Chem B, 102: 9323-9331.
鲍艳宇, 周启星, 张浩. 2009. 阳离子类型对土霉素在两种土壤中的吸附-解吸影响[J]. 环境科学, 30(2):551-556.
陈昦, 张劲强, 钟明, 等. 2008. 磺胺类药物在太湖地区典型水稻土上的吸附特征[J]. 中国环境科学, 28(4): 309-312.
陈育枝,张元元,袁希平, 等. 2006. 动物四环素类抗生素现状及前景[J].兽药, 11(3):16-17.
李兆君,姚志鹏,张杰,等. 2008. 兽用抗生素在土壤环境中的行为及其生态毒理效应研究进展[J]. 生态毒理学报, 3(1): 15-20.
刘新程,董元华,刘惠军. 2010. 阳离子与金霉素在土壤中竞争吸附的研究[J]. 土壤学报, 47(4):781-785.
刘新程,董元华,王辉. 2008. 江苏省集约化养殖畜禽排泄物中四环素类抗生素残留调查[J]. 农业环境科学学报, 27(3): 1177-1182.
土方浩,马文奇,窦争霞. 2006. 中国畜禽粪便产生量估算及环境效应[J].环境科学, 26(5): 614-617.
王磊,章光新. 2007. 扎龙湿地地表水与浅层地下水的水文化学联系研究[J]. 湿地科学, 5(2):166-173.
王冉,刘铁铮, 王恬. 2006. 抗生素在环境中的转归及其生态毒性[J]. 生态学报, 26(1): 265-270.
武庭瑄,周敏,万建新,等. 2009. 膨润土和高岭土对四环素吸附的影响[J].农业环境科学学报, 28(5): 914-918.
姚圆,莫测辉,李彦文. 2010. 固相萃取-高效液相色谱法分析蔬菜中四环素类抗生素[J]. 环境化学, 29(3): 537-541.
张劲强,董元华,安琼, 等. 2005. 兽药抗生素在土壤环境中的行为[J]. 土壤, 37(4):353-361.
张劲强,董元华. 2007. 阳离子强度和阳离子类型对诺氟沙星土壤吸附的影响[J]. 环境科学,2007,28(10): 2383-2388.
张许科,刘兴金. 2002. 国内外兽药发展趋势及对策[J]. 中国家禽, 24(7):1-4.
Influence of different strength and species of cation on adsorption of oxytetracycline in meadow soils
WANG Dongsheng, ZHANG Ting, CHAO Yu
College of Environmental Science and Engineering, Liaoning Engineering Technology University, Liaoning Fuxin 123000, China
Oxytetracycline (OTC), one of the tetracycline class of antibiotics, is more widely used in China. It has important significance theoretically and practically to explore the law of adsorption-desorption of OTC in soil for environmental risk
oxytetracycline; sorption; meadow; cation strength; different cations
X53
A
1674-5906(2014)05-0870-06
王东升(1963年生),男,教授,博士,研究方向为土壤中污染物的迁移转化。E-mail: lnwds@sina.com
2014-03-19
王东升,张婷,晁宇. 离子强度和离子类型对土霉素在草甸土中被吸附的影响[J]. 生态环境学报, 2014, 23(5): 870-875.
WANG Dongsheng, ZHANG Ting, CHAO Yu. Influence of different strength and species of cation on adsorption of oxytetracycline in meadow soils [J]. Ecology and Environmental Sciences, 2014, 23(5): 870-875.
assessment and pollution control of antibiotics. In this study, ionic strength and type in soil water solution were changed to reveal the influence on the adsorption of OTC in meadow soil, aiming at providing a scientific basis for evaluating the environmental risk of OTC in meadow soil. HPLC was the determination method of OTC, which acetonitrile: NaH2PO4(0.01 mol·L-1) =25∶75 (volume ratio) was as mobile phase at a flow rate of 1 mL·min-1and detection wavelength was 355 nm. On the basis of OECD Guideline 106, bath sorption methods were employed to reveal the effect of cation strength (ranging from 0.01 to 0.10 mol·L-1CaCl2) and different cation (0.01 mol·L-1solution of NaCl, KCl, MgCl2) on OTC sorption process in the meadow soil. Results indicated that the adsorption capacity of OTC in meadow soil gradually decreased with the increasing of concentrations of CaCl2, and the adsorption capacity of different concentrations of OTC in meadow soil was affected by different ionic strength. Compared with higher OTC concentrations, the influence of ionic strength was negligible to the sorption at lower OTC concentrations. The soil adsorption coefficient (Kd) was used to measure the ability of adsorption of OTC in meadow. When ionic strength in soil samples increased, its corresponding Kdwould decreased with a non-linear trend. This result showed that there definitely existed a certain concentration range of Ca2+that had the biggest effect on adsorption than other concentration range. The Kdof the adjacent concentration CaCl2were handled with T-test, showing that the value of Kdexisted a significant difference when the concentration ranges of CaCl2were from 0.01 mol·L-1to 0.03 mol·L-1(p≤0.05), while when the the concentration ranges of CaCl2were 0.03, 0.05, 0.08, 0.10 mol·L-1(p>0.05)were not. The results suggested that when the concentrations of CaCl2solution were 0.01-0.03 mol·L-1, its adsorption of oxytetracycline in the meadow has greater influence than other ranges of concentrations. Using Freundlich model fitted with the adsorption of oxytetracycline in meadow soils under NaCl, KCl, MgCl2solution conditions, the lgKfvalue order of soil samples was lgKf(Mg2+) <lgKf(Na+) <lgKf(K+). And the effect of different cations on lgKfdid not reach significant difference (p>0.05) through analysis of variance. This suggested that different cation adsorption capacity(lgKf) of oxytetracycline on the meadow soil was not significant .
