Pb、Cd及其复合污染对紫茎泽兰生长及吸收富集特征的影响
2014-02-28刘小文齐成媚欧阳灿斌唐杰伟李园颜冬冬王秋霞郭美霞曹坳程
刘小文,齐成媚,欧阳灿斌,唐杰伟,李园,颜冬冬,王秋霞,郭美霞,曹坳程*
1. 湖南科技学院生命科学与化学工程系,湖南 永州 425199;2. 植物病虫害生物学国家重点实验室,北京100193;3. 中国农业科学院植物保护研究所,北京100193;4. 农业部农业生态与资源保护总站,北京100125
Pb、Cd及其复合污染对紫茎泽兰生长及吸收富集特征的影响
刘小文1,2,3,齐成媚1,欧阳灿斌2,3,唐杰伟4,李园2,3,颜冬冬2,3,王秋霞2,3,郭美霞2,3,曹坳程2,3*
1. 湖南科技学院生命科学与化学工程系,湖南 永州 425199;2. 植物病虫害生物学国家重点实验室,北京100193;3. 中国农业科学院植物保护研究所,北京100193;4. 农业部农业生态与资源保护总站,北京100125
外来植物紫茎泽兰(Eupatorium adenophorum)入侵我国西南地区并造成了严重的生态灾难,通过研究Pb、Cd及其复合污染对紫茎泽兰生长及吸收富集特征的影响,有助于从生态学角度为紫茎泽兰的综合防控提供依据。采用模拟Pb、Cd污染土壤培养法研究了不同浓度Pb、Cd及其复合污染作用下紫茎泽兰的生长响应及重金属吸收、富集和迁移特征变化。结果表明:低浓度的Pb、Cd对紫茎泽兰的生长有促进作用,高浓度则表现出一定的抑制作用,生物量,株高,根长均明显减少。紫茎泽兰体内Pb、Cd吸收量与污染土壤具有良好的相关性,随处理浓度增加明显增大,极端浓度Pb、Cd胁迫下紫茎泽兰各器官Pb、Cd积累量与对照相比显著增加,1000 mg·kg-1处理时紫茎泽兰根、茎、叶的Pb质量分数均分别高达603.69、568.31、598.85 mg·kg-1;100 mg·kg-1Cd处理时其根、茎、叶的Pb、Cd累积量依次为165.21、93.59、152.79 mg·kg-1。说明紫茎泽兰对Pb、Cd具有较好吸收累积及转运能力,可作为重金属污染地区的一种理想的修复植物。
紫茎泽兰;Pb;Cd;生长;富集
随着金属矿山的大量开采,矿业废弃地中的污染物对生态环境造成了极大威胁,采矿废弃地和尾矿等废弃物的堆存破坏生态系统的多样性,其重金属等污染物还可通过扬尘、雨水冲刷等途径迁移扩散到周边环境,导致严重的二次污染,这不仅对人类健康带来严重危害,也导致大量农用地荒废,造成巨大的经济损失。据统计,我国受铅、镉等重金属污染的土壤面积为2000万hm2,约占总耕地面积的1/5(吴双桃,2005),每年因重金属污染导致的粮食经济损失高达200亿元(顾继光等,2003)。更危险的是,土壤重金属污染具有不可逆转性,被某些重金属污染的土壤可能要100~200年,甚至更长的时间才能够恢复(陈兴兰和杨成波,2010),而重金属本身的相对稳定性和难降解性(唐世荣和黄昌勇,1996),使得土壤污染更具有隐蔽性、不可逆性、长期性及后果严重性等特点(陈怀满,1990),因此,在我国耕地资源日益紧张的情况下,矿区重金属污染的修复显得极为必要和异常迫切。
目前国内外常用物理、化学等传统的方法控制和治理被重金属污染的土壤,虽在一定程度上取得理想的修复效果,但这些方法往往存在经济成本高、技术要求高、修复不彻底、对土壤结构破坏严重等缺点,不适于大规模推广。植物修复技术治理重金属污染土壤具有原位修复、费用低、操作简便和对环境影响小等优势(Padmavathiamma和Li, 2007),已经成为环境科学工作者研究的热点,植物修复的前提是找到对污染物有强耐性的植物或超富集植物。近年来我国科学家在超富集植物的筛选方面做了大量工作,至今已发现的主要有锌、镉、铅、砷、锰、铬、铝等,其中砷超富集植物居多(陈同斌等,
2002;韦朝阳等,2002)。研究发现,对铅有较强富集作用的主要有香根草(Vetiveria zizanioides Nash)、绿叶苋菜(Amaranthus tricolor L.)、裂叶荆芥(Schizonepeta tenuifolia)、羽叶鬼针草(Bidens maximowicziana)、紫穗槐(Amorpha fruticosa)、苍耳(Xanthium sibiricum)(聂俊华等,2004);东南景天(Sedum alfredii Hance)(何冰和杨肖娥,2002);芥菜(Brassica juncea)(柯文山等,2004);东方香蒲(Typha orientalis Presl)(李永丽等,2005)等。对镉有较强的富集作用的主要有Thlaspi Caerulescens、东南景天(Lasat等,1996;Brooks等,1977;Baker等,2000);宝山堇菜(Viola baoshanensis)(刘威等,2003);商陆(Phytolacca acinosa Roxb.)(聂发辉,2006);龙葵(Solanum nigrum L.)(魏树和等,2005);叶用红菾菜(Beta vulgaris var. cicla L.)(李玉双等,2007)等。这些植物的发现为铅镉污染土壤的植物修复提供了宝贵的植物材料,但这些植物在实际应用中都不可避免地有人工成本高、生物量小、生长缓慢等缺陷,使其在大面积推广应用中受到明显限制。深入筛选生物量大、生长速度快、对重金属累积能力强的植物,已经成为应用植物修复技术的一个关键环节。
紫茎泽兰(Eupatorium adenophorum Spreng),又名破坏草、解放草,系菊科泽兰属多年生草本植物或亚灌木。有研究表明,自然状况下的紫茎泽兰对铅、镉具有较强的富集能力(Zu等,2005;李冰和张朝晖,2008;汪文云和张朝晖,2008),我们前期调查也发现,自然条件下,紫茎泽兰在铅、镉污染土壤中均生长正常,未表现明显的中毒症状。作为外来入侵物种,紫茎泽兰在我国西南地区广泛分布、繁殖能力强、传播范围广、生物量大、抗逆性强、生长迅速,具有矿区重金属先锋植物明显特征(王霞霞等,2013;朱文达等,2013)。长期以来,人们一直关注着其危害并加以防治,随着生物多样性、农业可持续发展等理论的深入研究,人们越来越认识到紫茎泽兰在水土保持、土壤改良和农业生态系统中生物多样性的维持等方面起着重要的作用,进一步挖掘紫茎泽兰对重金属铅、镉的富集规律,探究其对重金属污染土壤的修复潜力,这对矿区土壤环境植被恢复具有重要的意义。因此,本文拟在不产生人为扩大入侵范围的同时采用土壤培养的方法研究紫茎泽兰在含铅、镉污染环境中的生长反应,研究其在铅、镉污染中对重金属的吸收、富集、转运、分布特征,为利用紫茎泽兰作为修复重金属污染土壤先锋植物提供理论依据,同时为综合利用紫茎泽兰提供可能的新途径。
1 材料与方法
1.1 盆栽试验
试验在室内大棚里进行,白天温度为(25±5)℃,夜间温度为(15±5)℃,相对湿度(55±8)%。试验土壤采自西昌学院校内试验地表层土壤,理化性质:pH值6.30(水)/7.71(CaCl2),总P为441 mg·kg-1,总N为853 mg·kg-1,总K为2313 mg·kg-1,CEC为11.23 cmol·kg-1,有机质质量分数为25.1 mg·kg-1,重金属Pb、Cd质量分数分别为20、0.2 mg·kg-1。Pb胁迫处理水平为:0(CK)、200、500、1000 mg·kg-1,Pb以Pb(CH3COO)2的形式加入;Cd胁迫处理水平为0(CK)、20、50、100 mg·kg-1,Cd以CdCl2·2.5H2O形式加入;交互处理水平为500 mg·kg-1Pb + 50 mg·kg-1Cd,土壤处理后,拌匀,稳定2周后移植紫茎泽兰幼苗。选取质量和高度一致,约8~10 cm的植株,随机分配到每个浓度处理中,每个处理栽种16盆,每盆1株。移植后,用称重法补充水分,保持土壤含水量为田间持水量的60%左右,重金属胁迫处理60 d后,收获供试植物和土壤,测定重金属含量和有关生理指标。
1.2 土壤和植物样品分析
对各处理条件下的紫茎泽兰生长进行形态观察,收获时用清水洗去根部土壤,冲洗干净,测量其茎高、根长、叶数,叶面积(叶面积采用美国手持式激光叶面积仪CI-203测定),然后把植物样品的根、茎、叶分开,分别装袋,称其鲜质量,在80 ℃的烘箱中烘至恒质量,分别测干质量。生长分析参数计算:叶植株质量比(LBR)=叶片干物质质量/植株总干物质;茎植株质量比(SBR)=茎干物质质量/植株总干物质质量;根系植株质量比(RBR)=根系干物质质量/植株总干物质;根冠植株质量比(R/S)=地下部干物质质量/地上部干物质质量,耐性指数=处理组生物量/对照组生物量。烘干的植株样品先用天平测定干质量,然后用植物粉碎机粉碎,混合均匀,装入写好标签的纸袋,备测。采集收获紫茎泽兰后的土壤样品,自然风干,磨碎过20目筛,装入写好标签的纸袋,备测。土壤和植株样品经过浓HNO3∶HF∶HClO4(2∶1∶2)消化,再用北京瑞利WFX-120A/石墨炉原子吸收分光光度计测定。
1.3 数据处理与分析
上述实验均重复3次,计算平均值,并采用SAS 8.2软件和Excel进行统计分析和作图。
转运系数=(地上部分重金属含量)/(地下部分重金属含量)
2 结果与分析
2.1 Pb、Cd及其复合污染对紫茎泽兰生长的影响
紫茎泽兰经不同浓度Pb土壤培养处理后,其
生物量和形态指标变化,分别见图1和图2。处理60 d后,各处理的紫茎泽兰净株高出现先显著增加后快速减少的变化趋势(P<0.05);叶面积在1000 mg·kg-1时显著低于对照(P<0.05),其他各处理与对照无明显差异;根长和鲜质量随处理浓度的增加也出现先升后降的趋势,其中根长在200、500 mg·kg-1处理时,分别比对照增加了14.87%、25.64%,鲜质量在200~500 mg·kg-1处理时,依次比对照增加了31.13%、19.74%;1000 mg·kg-1时根长和鲜质量均显著低于对照,此时,紫茎泽兰的生长分析参数也有所下降;除1000 mg·kg-1外,各处理的耐性指数均>1,这说明紫茎泽兰在低质量分数(≤500 mg·kg-1)处理时,Pb对紫茎泽兰的生长具有一定的促进作用,随浓度增加则表现出较强的抑制效应。
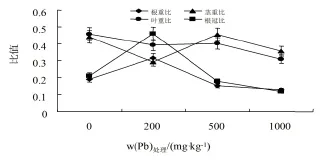
图2 Pb胁迫下紫茎泽兰的生长分析参数影响Fig. 2 Effects of Pb on the growth analysis parameters of Eupatorium Adenophorum Spreng
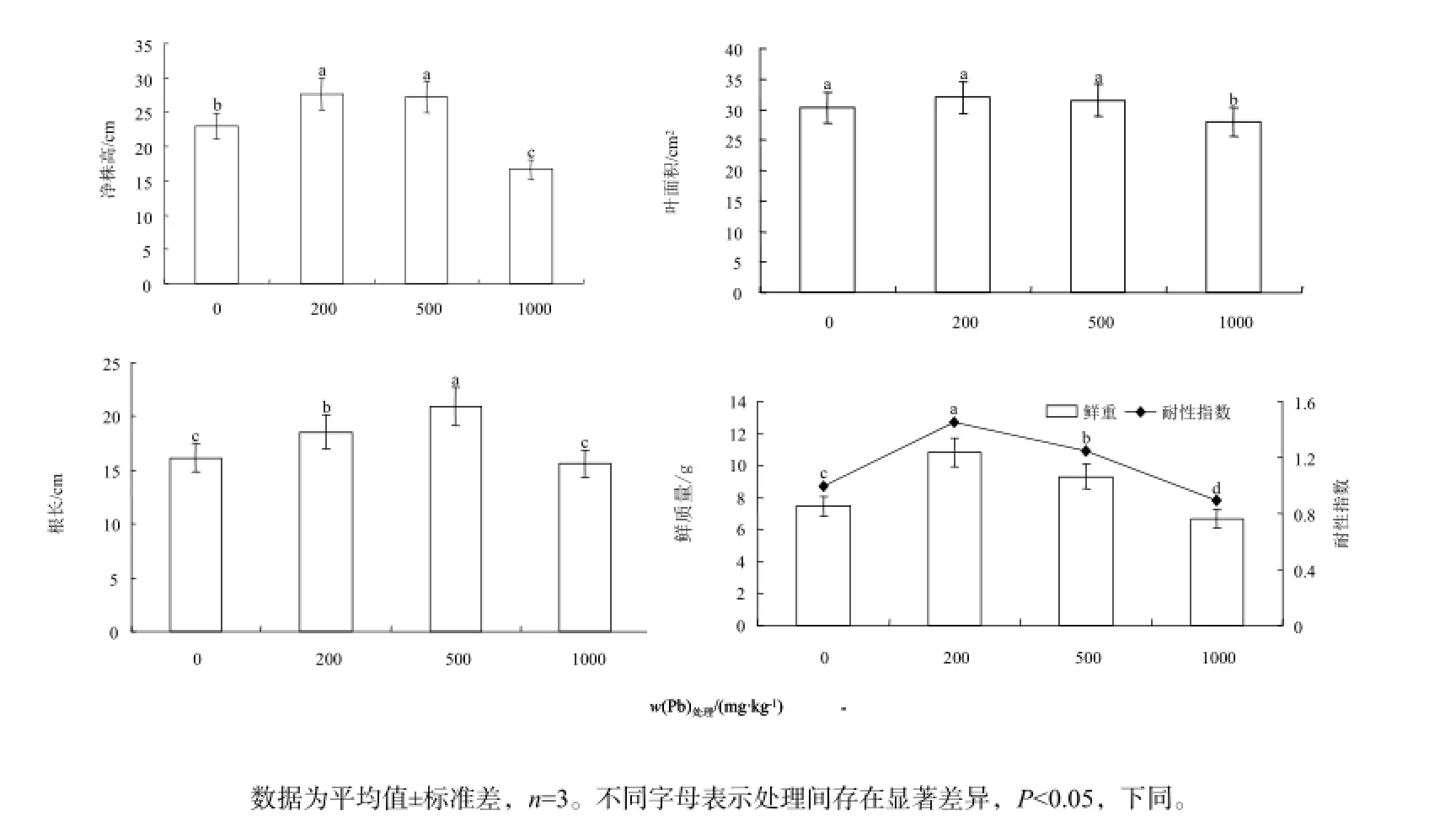
图1 Pb胁迫下紫茎泽兰生物量及形态指标的影响Fig.1 Effects of Cd on the biomass and form index of Eupatorium Adenophorum Spreng
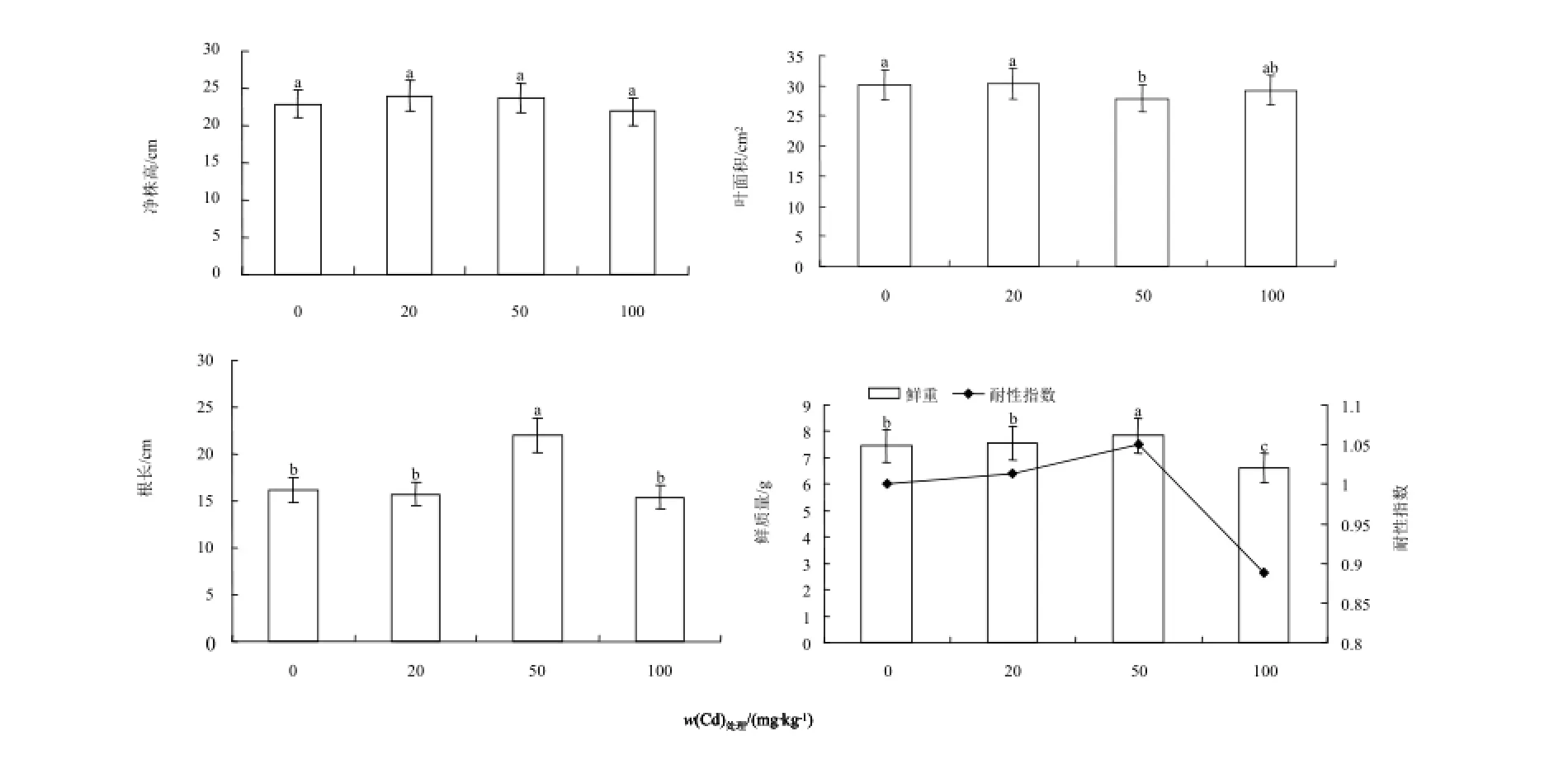
图3 Cd胁迫下紫茎泽兰生物量及形态指标的影响Fig. 3 Effects of Cd on the biomass and form index of Eupatorium Adenophorum Spreng
经Cd污染土壤处理后,紫茎泽兰的生物量和形态指标,分别见图3和图4。由图可看出,处理60 d后,各处理紫茎泽兰净株高均与对照差异不显著;50和100 mg·kg-1处理时叶面积均低于对照,20 mg·kg-1处理与对照相比无明显变化(P<0.05);根长在20~100 mg·kg-1处理时,依次为对照的97.42%、139.86%、74.33%,鲜质量则随质量分数的增加出现先升后降的变化趋势,50 mg·kg-1处理均显著高于对照(P<0.05),100 mg·kg-1处理时紫茎泽兰生长受到明显抑制,除100 mg·kg-1处理外,各处理Cd的耐性指数均>1,这说明紫茎泽兰在低质量分数对其生长影响有一定的促进作用,在高质量分数100 mg·kg-1处理时,生长明显受到抑制。随Cd质量分数增加,根系植株质量比则是先升后降,这表明高质量分数Cd对紫茎泽兰的地下部分根抑制作用更为明显。
图5和图6为Pb-Cd复合污染胁迫60 d后紫茎泽兰的生物量和形态指标变化情况。可以看出,经Pb-Cd胁迫后,紫茎泽兰的净株高显著低于单一Pb处理(P<0.05),与对照和单一Cd处理无明显差别;叶面积对照和与单一Pb处理无明显差异,但明显高于单一Cd处理;根长则均低于对照和单一Pb、Cd处理,鲜质量大于对照和单一Cd处理,与单一Pb没有显著性差异(P<0.05)。
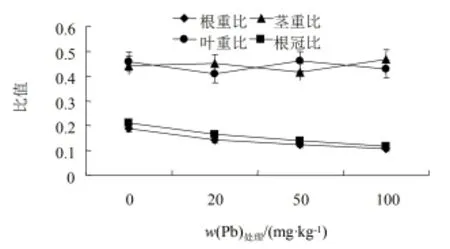
图4 Cd胁迫下紫茎泽兰生长分析参数的影响Fig. 4 Effects of Cd on the growth analysis parameters of Eupatorium Adenophorum Spreng
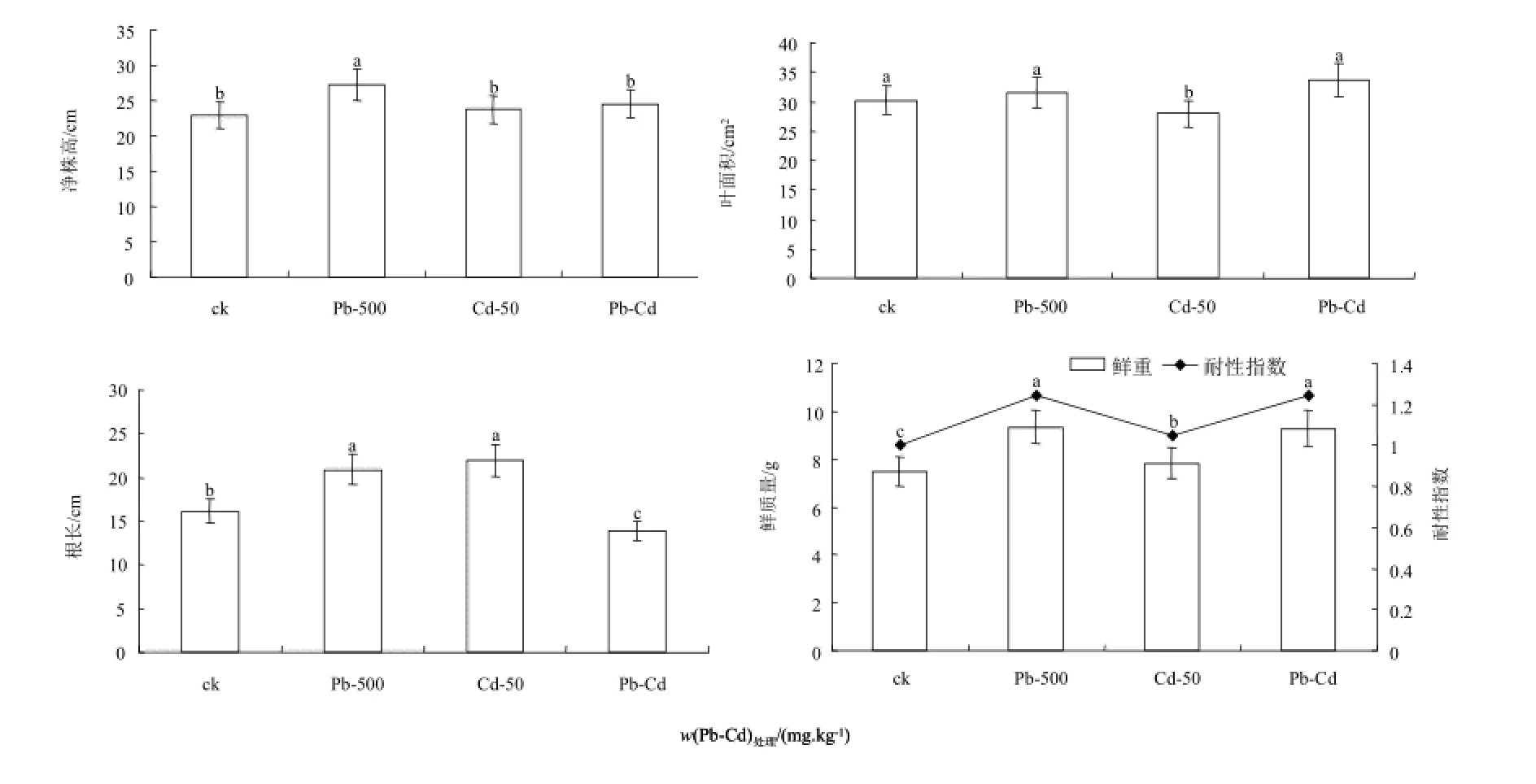
图5 Pb-Cd复合污染胁迫下紫茎泽兰生物量及形态指标的影响Fig. 5 Effects of combined pollution of Pb-Cd on the biomass and form index of Eupatorium Adenophorum Spreng
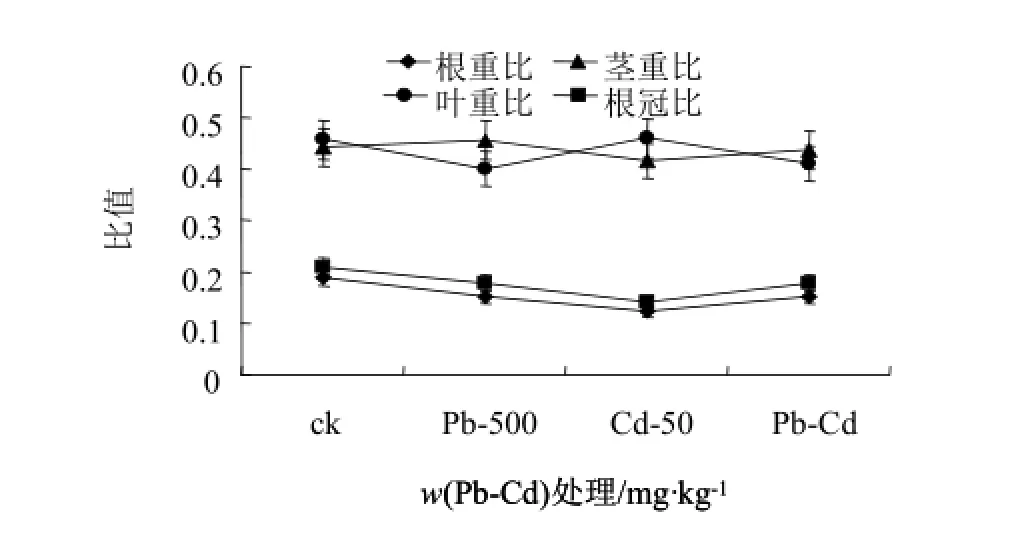
图6 Pb-Cd复合污染胁迫下紫茎泽兰生长分析指标的影响Fig.6 Effects of combined pollution of Pb-Cd on the growth analysis parameters of Eupatorium Adenophorum Spreng
2.2 紫茎泽兰对Pb的富集转运特性
图7为紫茎泽兰在不同浓度Pb胁迫处理下土壤培养60 d后的各组织Pb含量和转运情况。可以看出(图7A)),紫茎泽兰各组织中的Pb含量随基质中Pb处理浓度的增加而显著增加(P<0.05),处理质量分数≤500 mg·kg-1时,不同组织的Pb质量分数顺序为叶>根>茎,1000 mg·kg-1处理时则为根>叶>茎。根、茎、叶的Pb质量分数均在1000 mg·kg-1处理时出现峰值,依次为603.69、568.31、598.85 mg·kg-1,分别为对照的29.18、31.33、24.49倍,紫茎泽兰的Pb含量与添加的Pb含量之间表现出了良好的相关性(图7D)),地上部分、地下部
中Pb富集量与土壤中Pb相关系数分别为0.9828,0.9749,均达到极显著水平(p<0.01),表现出良好的吸收特性。转运系数,即地上部Pb含量与地下部Pb含量的比值在0.8933~1.029之间,随Pb处理浓度的升高,其转运系数有小幅增加,但各处理间无明显差异(图7B)),植物体内吸收的Pb超过60%是储存在地上部(图7C)),说明紫茎泽兰对Pb具有较强的转运能力。
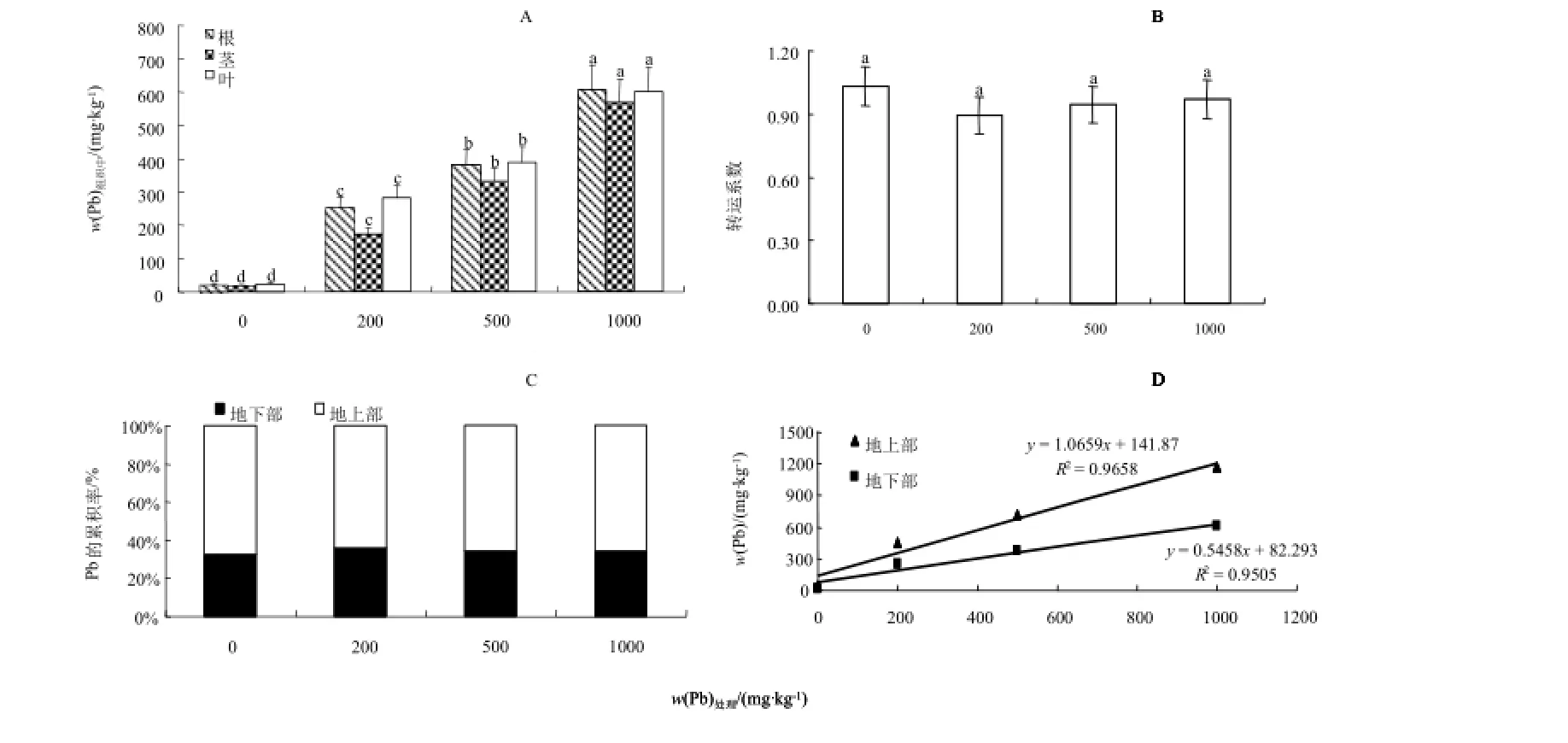
图7 紫茎泽兰植株各组织Pb累积及分布Fig.7 Distribution and accumulation of Pb in Eupatorium Adenophorum Spreng
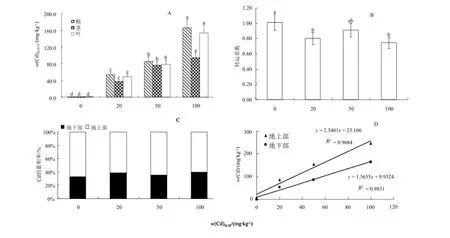
图8 紫茎泽兰植株各组织Cd累积及分布Fig. 8 Distribution and accumulation of Cd in Eupatorium Adenophorum Spreng
2.3 紫茎泽兰对Cd的富集转运特性
盆栽条件下紫茎泽兰对Cd的吸收转运特性如图8所示。随土壤中Cd质量分数的增加,地上部与地下部中Cd质量分数呈显著增加的趋势(p<0.05),不同组织的Cd质量分数顺序为根>叶>茎,根、茎、叶的Cd质量分数均在100 mg·kg-1的Cd处理时都达到最大,依次为165.21、93.59、152.79 mg·kg-1,分别为对照的120.68、77.09、98.89倍(图8A));各处理中紫茎泽兰地上部Cd富集量均明显高于地下部,紫茎泽兰的组织中Cd富集量与土壤添加的Cd含量之间表现出了良好的相关性(图8D)),地上部分、地下部中Cd富集量与土壤中Cd达极显著相关性水平(p<0.01),其相关系数r分别为0.9841,0.9915;转运系数则表现为先降后升再降的折线变化趋势,且各处理间明显低于对照但相互间无显著性差异(图8B));紫茎泽兰体内积累的Cd 59%以上是储存在地上部(图8C)),表明紫茎泽兰对Cd具有较强的吸收累积能力。
2.4 Pb-Cd交互作用下紫茎泽兰对Pb、Cd的富集转运特性
图9为Pb-Cd交互作用下紫茎泽兰对Pb、Cd的吸收情况。可以看出,Pb-Cd交互处理后,紫茎泽兰各组织Pb的累积量明显低于单一处理水平(P<0.05),根、茎、叶分别为500 mg·kg-1Pb单一处理时的33.05%、32.85%、39.83%;各组织Cd的累积量反而显著升高(P<0.05),根、茎、叶分别为50 mg·kg-1Cd单一处理时的1.421、1.489、1.390倍(图9C));转运系数在Pb-Cd交互处理与500 mg·kg-1Pb、50 mg·kg-1Cd处理间均无明显差异(图9D));说明Pb-Cd交互处理后,对Pb的吸收有拮抗效应,大大降低了紫茎泽兰对Pb的吸收,同时增加了Cd的吸收,表现出协同效应,但对其体内Pb和Cd的转运并无较大的影响。
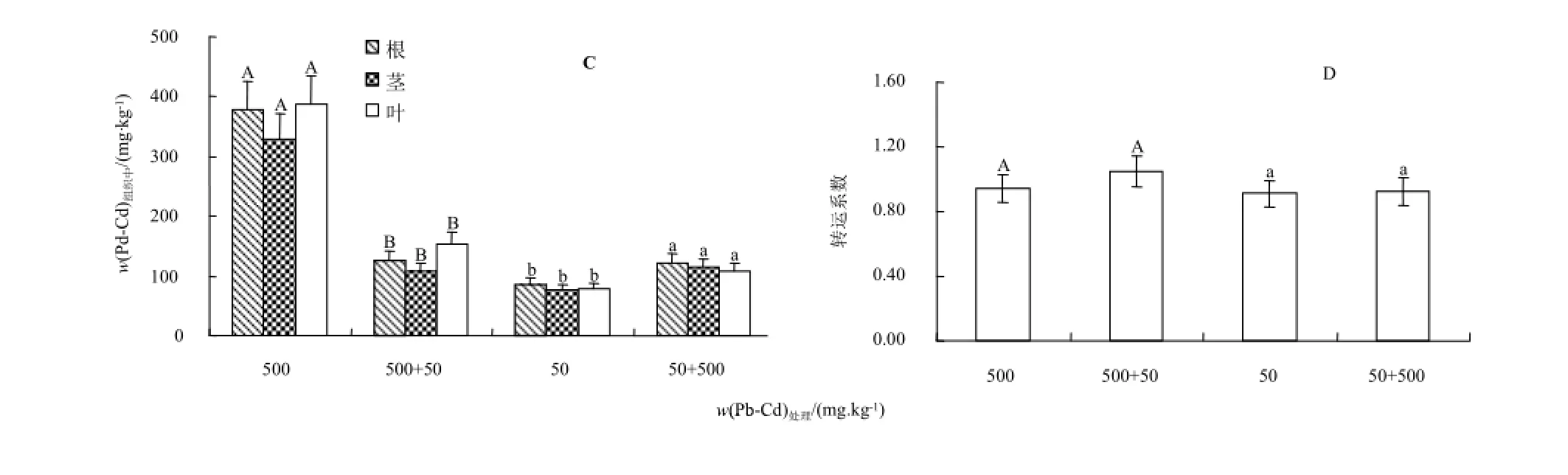
图9 紫茎泽兰在Pb和Cd交互作用下各组织Pb和Cd含量(C)和转运系数(D)Fig.9 Pb and Cd concentrations in plant tissue(C)and tranlocation factor(D)of Eupatorium Adenophorum Spreng
3 讨论
目前重金属超富集植物的界定主要采用Baker和Brooks的标准,即Pb和Cd地上部质量分数分别大于1000和100 mg·kg-1,地上部金属含量与根部金属含量之比(转运系数)大于1。本研究发现,1000 mg·kg-1处理时紫茎泽兰根、茎、叶的Pb质量分数均分别高达603.69、568.31和598.85 mg·kg-1;各处理的转运系数均在0.8933~1.029之间,紫茎泽兰体内吸收的Pb有超过60%是储存在地上部。紫茎泽兰根、茎、叶的Cd累积量均在100 mg·kg-1的Cd处理时依次为165.21、93.59、152.79 mg·kg-1,紫茎泽兰体内积累的59%以上Cd是储存在地上部。紫茎泽兰植株Pb、Cd富集量大大超过了前人研究结果(李冰和张朝晖,2008;汪文云和张朝晖,2008),其原因可能是由于土壤基质中Pb含量高所引起的。紫茎泽兰对Pb具有较高的累积量,对Cd的累积量甚至超过超累积植物的临界值,说明紫茎泽兰对Pb、Cd均有良好的吸收累积能力,尤其是对Cd具有超强的累积能力,且紫茎泽兰本身具有巨大的生物量和极强的繁殖能力的特性,可以作为Pb、Cd污染地区植物修复的一种潜在的先锋植物。Pb-Cd复合作用下,紫茎泽兰各组织中Pb含量明显低于单一Pb处理水平;表现为Cd对Pb的富集有抑制作用;Cd的累积量却显著增加了,表现为Pb对Cd的富集有促进作用,即紫茎泽兰对Pb的吸收不会阻碍Cd的吸收,但Cd的吸收会对Pb的吸收具有一定的阻碍作用。
有研究表明超积累植物东南景天对Cd、Pb耐受的临界浓度分别为500和1000 μmol·L-1,在此浓度以下,Cd、Pb对水培条件下的东南景天的生长基本无抑制作用(熊愈辉等,2004);胡鹏杰等研究表明,长柔毛委陵菜在Cd质量浓度≤20 mg·L-1的介质中能够正常生长(胡鹏杰等,2007);孙健等认为Cd、Pb、Cu、Zn、As 5种重金属复合胁迫对灯心草地上部生长有一定程度的抑制作用,在土壤环境质量二级标准上限值处灯心草地上部生物量减产9.15%,小于10%,生长在矿毒水和铅锌尾矿污染土壤中的灯心草地上部生物量分别减产28.23%和37.1%,但地下部生物量减产趋势不明显,以地上部生物量为参考指标,可初步将土壤环境质量二级标准上限值拟设定为土壤中各重金属的临界毒性效应值(孙健等,2006);杨敏文等采用土培试验研究了不同水平铅处理下苋菜生长的影响,结果表明:较高浓度铅胁迫下苋菜的生长受到明显抑制,其中根受到的抑制程度最高,铅对苋菜第3和第4片成熟叶面积扩展的抑制作用比对叶干物质的积累大,导致单位叶面积干质量增大(杨敏文和柯世省,2009);刘文霞等则证实镉在土壤中的质量比为5 mg·kg-1(低质量比)时能促进苋菜生长,高质量比(20 mg·kg-1)时抑制了苋菜生长,造成苋菜幼苗成活率显著下降,植株矮化,叶面积和生物量显著减小,镉的毒性作用对苋菜生长的影响持续时间较长(刘文霞等,2009);多立安认为Cd的质量分数达100 mg·kg-1时,早熟禾的种子萌发率、幼苗株高均有所下降,并随着胁迫浓度的增加,下降
幅度增大,Pb对两指标的影响不太明显,Pb在质量分数超过200 mg·kg-1时,对早熟禾根系及地上生物量表现出抑制效应,并随着浓度的增加抑制效应增加(多立安等,2006)。
本研究结果表明,经Pb胁迫土壤培养60 d后,紫茎泽兰净株高、叶面积和根长、鲜质量随浓度均出现先增加后下降的变化趋势,说明低浓度下处理有利于紫茎泽兰的生长,高浓度胁迫下紫茎泽兰生长受到一定程度地抑制,表明紫茎泽兰对Pb具有较强的耐性,仅在高质量分数1000 mg·kg-1生长受到影响;与前人研究的圆叶无心菜(闵焕等,2010),油菜(季丽英等,2006)结果一致;经Cd处理后,各处理紫茎泽兰净株高、叶面积、根长均受到不同程度的影响,鲜质量则随浓度的增加出现先升后降的变化趋势,在高质量分数100 mg·kg-1处理时,紫茎泽兰鲜质量受到明显抑制,且地下部分抑制作用更为明显,说明紫茎泽兰在低浓度Cd对其生长无明显抑制效应,鲜质量反而有所增加,高浓度处理时其生长受到明显抑制,与徐苏凌等研究的紫花苜蓿(徐苏凌等,2008),杨盛昌等研究桐花树(杨盛昌和吴琦,2003)结果一致。Pb-Cd复合污染胁迫后,紫茎泽兰鲜质量明显大于对照和单一Cd处理,与单一Pb没有显著性差异。
紫茎泽兰在Pb、Cd及其复合污染胁迫下,低浓度下生长并没有受到抑制,反而有一定的促进作用,表明紫茎泽兰对Pb、Cd具有较强的耐性,而且可能是通过自身形成更大的生物量,对体内重金属加以稀释,缓解重金属的毒害作用,提高其对重金属的适应能力。值得注意的是,我国西南地区矿产资源丰富,矿产资源的开发利用引起了严重的重金属污染问题(魏伦武,2007;毛英,2003),给当地生态环境构成巨大威胁,为保障生态系统的安全,必须尽快进行矿山废弃地的植被恢复,但一般情况下,植物定居和植被恢复都十分困难;紫茎泽兰具有生物量大,生长繁殖速度快等优势,更重要是其对Pb、Cd具有较强的耐受能力,利用紫茎泽兰作为先锋植物对重金属污染地区进行植被恢复,待植被稳固后选用适当的替代植物如臂形草、象草、雀稗、杂交狼尾草、台湾相思、新银合欢等速生牧草或苗木进行进一步的生态恢复,这对金属污染地区的生态恢复和治理提供一种新的思路,同时为紫茎泽兰的综合利用开辟新的途径。
4 结论
1)低浓度的Pb、Cd对紫茎泽兰的生长有促进作用,高浓度则表现出一定的抑制作用。
2)紫茎泽兰地上部分叶、茎Pb的累积量高达598.85、568.31 mg·kg-1,远远超过一般植物的累积量,且具有良好的转运能力,其地上部分对Cd累积量超过或接近超累积植物的临界值100 mg·kg-1。
3)紫茎泽兰对Pb、Cd都有很强的耐性和富集能力,可作为Pb、Cd等重金属污染地区的一种先锋植物。
BAKER A J M, MCGRATH S P, REEVES R D, et al. 2000. Metal hyperaccumulator plants:a review of the ecology and physiology of a biological resource for phytoremediation of metal-polluted soils[J].Phytoremediation of contaminated soil and water, 85-107.
BROOKS R R, LEE J, REEVES D, et al. 1977. Detection of nickeliferous rocks by analysis of herbarium specimens of indicator plants[J]. Journal of Geochemical Exploration, 7:49-57.
LASAT M M, BAKER A J M, KOCHIAN L V. 1996. Physiological characterization of root Zn2+a bsorption and translocation to shoots in Zn hyperaccumulator and nonaccumulator species of Thlaspi[J].Plant Physiology, 112(4):1715-1722.
PADMAVATHIAMMA P K, LI L Y. 2007. Phytoremediation Technology: Hyper-Accumulation Metals in Plants[J]. Water,Air & Soil Pollution,184(1):105-126.
ZU Y Q, LI Y, CHEN J J, et al. 2005.Hyperaccumulation of Pb, Zn and Cd in herbaceous grown on lead-zinc mining area in Yunnan, China[J]. Environment international, 31(5):755-762.
陈怀满. 1990. 我国土壤污染现状、发展趋势及其对策建议[J]. 土壤学进展,18(1): 53-56.
陈同斌,韦朝阳,黄泽春,等. 2002. 砷超富集植物蜈蚣草及其对砷的富集特征[J]. 科学通报,47(3):207-210.
陈兴兰,杨成波. 2010. 土壤重金属污染、生态效应及植物修复技术[J].农业环境与发展,27(3):58-62.
多立安,高玉葆,赵树兰. 2006. 早熟禾对4种重金属胁迫生长响应特征[J]. 西北植物学报,26(1):183-187.
顾继光,周启星,王新,等. 2003. 土壤重金属污染的治理途径及其研究进展[J]. 应用基础与程科学学报,11(2):143-151.
何冰,杨肖娥. 2002. 一种新的铅富集植物——富集生态型东南景天[J].植物学报: 英文版,44(11):1365-1370.
胡鹏杰,周小勇,仇荣亮,等. 2007. Zn超富集植物长柔毛委陵菜对Cd的耐性与富集特征[J]. 农业环境科学学报,26(6):2221-2224.
季丽英,肖昕,冯启言,等. 2006. 铅和镉对油菜幼苗的影响[J]. 现代农业科技,(3S):48-49.
柯文山,陈建军,黄邦全,等. 2004. 十字花科芸薹属5种植物对Pb的吸收和富集[J]. 湖北大学学报: 自然科学版,26(3):236-238.
李冰,张朝晖. 2008. 贵州烂泥沟金矿区苔藓植物及其生态修复潜力分析[J]. 热带亚热带植物学报,16(6):511-515.
李永丽,李欣,李硕,等. 2005. 东方香蒲对铅的富集特征及其EDTA效应分析[J]. 生态环境,14(4):555-558.
李玉双,孙丽娜,孙铁珩,等. 2007. 超富集植物叶用红菾菜及其对Cd的富集特征[J]. 农业环境科学学报,26(4):1386-1389.
刘威,束文圣,蓝崇钰,等. 2003. 宝山堇菜(Viola baoshanensis) —— 一种新的镉超富集植物[J]. 科学通报,48(19):2046-2049.
刘文霞,陈元琦,寇渊博,等. 2009. 镉、丁草胺单一及复合污染对苋菜生长的影响[J]. 河南科学,27(3):305-308.
毛英. 2003. 西南地区矿产资源开发的环境地质问题研究[J]. 四川地质学报,23(2):106-108.
闵焕,祖艳群,李元, 等. 2010. Pb胁迫对圆叶无心菜(Arenaria rotumdifolia Bieberstein)生长和生理特征的影响[J]. 农业环境科学学报,29(增刊): 15-19.
聂发辉. 2006. 镉超富集植物商陆及其富集效应[J]. 生态环境,15(2): 303-306.
聂俊华,刘秀梅,王庆仁,等. 2004. Pb(铅)富集植物品种的筛选[J]. 农业工程学报,20(4): 255-258.
孙健,铁柏清,钱湛,等. 2006. 复合重金属胁迫对灯心草生长及其积累特性的影响[J]. 安全与环境工程,13(3):17-22.
唐世荣,黄昌勇. 1996. 利用植物修复污染土壤研究进展[J]. 环境科学进展,4(6):10-16.
汪文云,张朝晖. 2008. 贵州水银洞卡林型金矿苔藓植物研究[J]. 黄金,29(6): 8-12.
韦朝阳,陈同斌,黄泽春,等. 2002. 大叶井口边草——一种新发现的富集砷的植物[J]. 生态学报,22(5):777-778.
魏伦武. 2007. 西南地区矿山环境地质问题与防治对策[J]. 地质灾害与环境保护,13(1):6-8.
魏树和,周启星,王新,等. 2005. 超积累植物龙葵及其对镉的富集特征[J]. 环境科学,26(3):167-171.
熊愈辉,杨肖娥,叶正钱,等. 2004. 东南景天对镉、铅的生长反应与积累特性比较[J]. 西北农林科技大学学报,32(6):101-106.
吴双桃. 2005. 镉污染土壤治理的研究进展[J]. 广东化工,32(4):40-41.
徐苏凌,方勇,邢承华,等. 2008. 酸雨和 Cd 胁迫对紫花苜蓿生长和抗氧化酶系统的影响[J]. 浙江大学学报: 农业与生命科学版,34(4): 467-472.
杨敏文,柯世省. 2009. 土壤铅污染对苋菜生长和矿质元素含量的影响[J]. 北方园艺,(1):10-13.
杨盛昌,吴琦. 2003. Cd对桐花树幼苗生长及某些生理特性的影响[J]. 海洋环境科学,22(1):38-42.
朱文达,曹坳程,颜冬冬,等. 2013. 除草剂对紫茎泽兰防治效果及开花结实的影响[J]. 生态环境学报,22(5):820-825.
Growth and absorption enrichment responses of Eupatorium Adenophorum Spreng to Lead, Cadmium and their combined stress
LIU Xiaowen1,2,3, QI Chengmei1, OUYANG Canbin2,3, TANG Jiewei4, LI Yuan2,3, YAN Dongdong2,3, WANG Qiuxia2,3, GUO Meixia2,3, CAO Aocheng2,3*
1. Life Science & Chemical Engineering Department, Hunan University of Science and Technology, Yongzhou 425199, China; 2. State Key Laboratory for Biology of Diseases and Insert Pests, Beijing 100193, China; 3. Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China; 4. Rural Energy & Environmental Angency, Ministry of Agriculture, Beijing 100125, China
E. adenophorum Spreng is one of the worst invasive alien plants into China. It brings great harm to the ecological environment in the Southwest of China. A controlled pot-experiment cultivated with E. adenophorum was arranged with different treatments of lead and cadmium concentrations in field. Growth and absorption enrichment responses of E. adenophorum Spreng to lead, cadmium and their combined stress were evaluated in order to provide integrate strategies of E. adenophorum. A pot experiment was study to observe the growth responses, accumulation and transfer characteristics of E. adenophorum in different concentrations of lead, cadmium. Results showed that there was a positive effect on the growth of E. adenophorum under low concentrations for both lead and cadmium but negative effect in high concentration, with the decreasing biomass,shorter plant height and root length. Lead and cadmium. Absorption content of E. adenophorum had a favorable correlation with contaminated soil, which increased significantly with the conbined treatment concentrations raising. lead and cadmium concentration of the roots, stems and leaves of E. adenophorum was much higher in corresponding treatments. The lead content of roots, stems and leaves of E. adenophorum were 603.69, 568.31 and 598.85 mg·kg-1, respectively, when the plants were treated with 1000 mg·kg-1lead in soil. The cadmium contents in the roots, stems and leaves were 165.21, 93.59 and 152.79 mg·kg-1, respectively, under the 100 mg·kg-1cadmium stress. E. adenophorum has good capacity of absorption, accumulation and transfer under heavy metals stress of lead and cadmium and it can, therefore, be used as ideal plant to repair composite pollution soil of heavy metals.
Eupatorium Adenophorum Spreng; lead; cadmium; growth; enrichment
X171.5
A
1674-5906(2014)05-0876-08
公益性行业(农业)科技专项(201103027);湖南省自然科学基金(13JJ6080);湖南省重点学科建设项目(2011-76);湖南省高校科技创新团队支持计划 (2012-318)
刘小文(1983年生),男,讲师,博士,研究方向为生物安全和环境毒理学。E-mail: lxw1110@126.com
2014-04-21
刘小文,齐成媚,欧阳灿斌,唐杰伟,李园,颜冬冬,王秋霞,郭美霞,曹坳程. Pb、Cd及其复合污染对紫茎泽兰生长及吸收富集特征的影响[J]. 生态环境学报, 2014, 23(5): 876-873.
LIU Xiaowen, QI Chengmei, OUYANG Canbin, TANG Jiewei, LI Yuan, YAN Dongdong, WANG Qiuxia, GUO Meixia, CAO Aocheng. Growth and absorption enrichment responses of Eupatorium Adenophorum Spreng to Lead, Cadmium and their combined stress [J]. Ecology and Environmental Sciences, 2014, 23(5): 876-873.
