高级催化氧化法去除水中邻苯二甲酸酯的研究进展
2014-02-28刘静李亚茹王杰陈凯凯
刘静,李亚茹,王杰,陈凯凯
1. 山东建筑大学市政与环境工程学院,济南 250101;2. 山东弘润天成建设咨询有限公司,济南 250101
高级催化氧化法去除水中邻苯二甲酸酯的研究进展
刘静1*,李亚茹1,王杰1,陈凯凯2
1. 山东建筑大学市政与环境工程学院,济南 250101;2. 山东弘润天成建设咨询有限公司,济南 250101
普遍认为,邻苯二甲酸酯类物质(Phthalic Acid Esters,PAEs)是内分泌干扰物质(Endocrine Disrupting Chemicals,EDCs),被广泛应用于增塑剂、化妆品中,具有致畸性,致癌性,致突变性以及拟/抗雌激素活性、拟/抗甲状腺激素活性等内分泌干扰特性。邻苯二甲酸酯类物质很容易扩散到环境中,在土壤、大气、水环境中均有检出,是环境中常见污染物,严重威胁人体健康和生态环境,已经引起国内外的广泛关注。在综述邻苯二甲酸酯类物质的物理化学性质、毒性影响、国内外天然水体、地下水和生活污水中的污染现状的基础上,讨论消除水环境中PAEs污染的强化混凝、吸附、膜处理、生物处理和高级氧化技术。高级氧化技术因其能够快速有效地去除饮用水和污水中不同种类的有机污染物而备受关注,且发展迅速。重点介绍了高级催化氧化法对水环境中PAEs的去除,包括催化湿式过氧化物氧化过程,催化臭氧氧化过程,光催化氧化过程,超声波、微波辅助催化氧化过程以及高级纳米催化氧化过程。其中,Fenton催化氧化技术在氧化过程中通过使用催化剂或协同紫外光等方式产生高度反应性羟基自由基,可无选择性地将PAEs完全降解为无毒无害的小分子物质,对PAEs的氧化去除效果最好。虽然在高级氧化过程中应用催化剂可大大提高氧化效率和降解程度,但催化氧化法耗能较大、催化剂消耗量大、受水体pH值的影响,且研究大多限于实验室阶段,未能大量投入工业应用,需要进一步发展创新。因此,开发新型高效催化剂、提高催化剂选择性、优化催化氧化反应条件、优化设计催化反应器、与其他技术耦合是水体中PAEs类环境激素污染控制技术的发展方向。
邻苯二甲酸酯;污染现状;高级催化氧化法;催化剂;耦合
邻苯二甲酸酯(PAEs)又称酞酸酯,是邻苯二甲酸酐与醇的反应产物。邻苯二甲酸酯作为一种重要的化工原料已被广泛使用近50年,可作为增塑剂应用于塑料产品的生产中,增大分子聚合物的可塑性和强度,如:医药器材、食品薄膜、雨具、橡胶,电线绝缘材料、涂料等。也可用于驱虫剂、化妆品、润滑剂和绘画作品的保护层中。应用最为广泛的PAEs是邻苯二甲酸(2-乙基己基)酯(DEHP),由于它是最有可能对人体健康造成危害的物质(Julinová,2012),所以受到严格的检测。其他应用较广泛的还有邻苯二甲酸二丁酯(DBP)、邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二异壬酯(DINP)、邻苯二甲酸二异癸酯(DIDP)、邻苯二甲酸正二辛酯(DnOP)及邻苯二甲酸丁基苄基酯(BBP)。目前,DEHP、DOP、BBP、DBP、DEP和DMP等6种PAEs已被美国国家环保局(EPA)列为优先控制的有毒污染物,中国也将DEP、DMP和DOP三种PAEs确定为优先控制污染物(胡晓宇等,2003),并且DEHP已被列入中国《生活饮用水卫生标准》(GB 5749—2006)明确控制的非常规指标物质。
国际上对环境中PAEs的研究起步比中国早,已取得较丰富的研究成果。国外有学者综述了环境中PAEs的概况及其不同的去除方法,包括物理化学方法、生物处理和高级氧化技术(Abdeldaiem等,2012)。但是中国有关PAEs的研究较少,鲜见系统阐述国内外水环境中PAEs的污染状况和详细介绍应用高级催化氧化技术去除PAEs的报道。本文对邻苯二甲酸酯类物质的物化性质、毒理性质以及在国内外天然水体、地下水和污水中的污染现状进行了分析,综述了该类物质应用高级催化氧化法去
除方式的最新研究进展,最后探讨了该领域进一步的研究重点与方向。
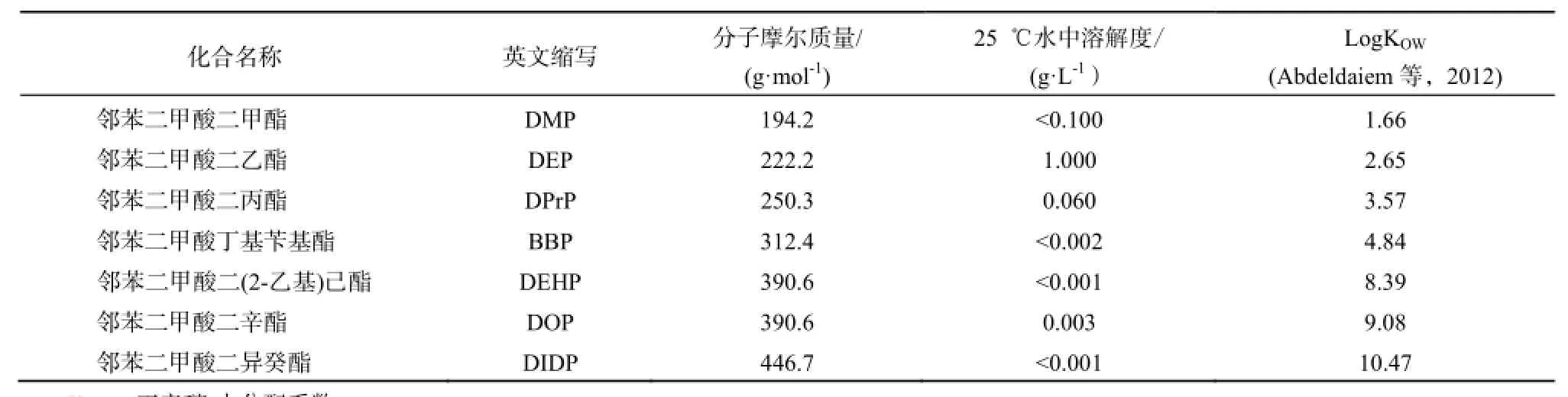
表1 常见PAEs的物理化学性质Table 1 Physico-chemical properties of common PAEs
1 PAEs的物理化学性质和毒性影响
PAEs的化学结构由一个刚性平面芳环和两个可塑的非线性脂肪侧链组成。化学结构决定了其物化性质和在环境中的行为。根据侧链的不同,从邻苯二甲酸二甲酯(DMP)到邻苯二甲酸二异十三烷基酯(DITDP)共有20多种。通常PAEs是无色、淡黄色的有机物,无味或略带气味。表1给出了常见的PAEs的物理化学性质,其中,PAEs在水中的溶解度偏小,难溶于水;而从LogKOW值可以看出,PAEs在辛醇-水体系中有很高的分配系数,表明其易溶于有机溶剂,是脂溶性物质。除DMP熔点为+5.5 ℃,DUP熔点为-9 ℃以外,其余PAEs的熔点通常低于-25 ℃,沸点范围从230 ℃到486 ℃。PAEs的低熔点和高沸点促进了它们在增塑剂、热传递流体和载体中的应用(Daiem等,2012)。
PAEs急性毒性不高,但是如果有机体长时间暴露在其中,会有致癌的可能性,并且会影响荷尔蒙分泌和生殖系统,不同的PAEs影响程度也不同(胡晓宇等,2003)。尽管PAEs可以很快地从有机体内排出,但由于它的亲脂性,则很容易贮存在脂肪组织中。PAEs也能引起胎儿死亡和畸形,睾丸和肝脏病变。多种研究表明,一些PAEs对有机体,特别是雄性,具有雌激素活性,能促使过氧化物酶体增生,并能引起实验动物的生殖障碍。某些PAEs是啮齿类动物的致癌物,其对于人类的致癌性还没有最终确定,但是最近研究发现PAEs及其代谢产物是潜在的甲状腺激素干扰物(Swan,2008)。人体暴露在PAEs中的途径有很多,且多种PAEs对人体的影响是多重的,但其对于人体的毒性机制还没有明确解释(倪明,2010)。因此全面了解水环境中PAEs的污染现状,寻找PAEs的有效降解方法是非常必要的。
2 国内外水环境中PAEs的污染现状
由于邻苯二甲酸酯类与聚烯烃类塑料分子之间以氢键或范德华力连接,容易扩散到外环境中,因此随着时间的推移,容易造成对空气(王晓丹,2012)、水和土壤(崔学慧等,2010;赵胜利,2009)的污染。研究发现,邻苯二甲酸酯不仅在污水、污泥和垃圾渗滤液中存在,而且也在地表水、地下水等水体中检出。地表水和地下水中PAEs的来源主要通过2大途径:1)直接途径——含有PAEs的工业废水的排放、固体废弃物的堆放受雨水淋洗以及PVC塑料的缓慢释放进入水体;2)间接途径——PAEs首先排入大气,然后通过干沉降或雨水淋洗而进入水体中(胡晓宇等,2003)。
目前已有研究表明,国内很多地表水如河流、湖泊和地下水等水环境中均检测到PAEs的存在。杜娴等(2012)以重庆主城长江、嘉陵江为研究区域调查研究表明,5种PAEs在两江水相、间隙水和沉积物中含量分别为53.2~10061.3、916.8~15807.9 ng·L-1和1438.9~5045.9 ng·g-1,DnBP和DEHP是水体和沉积物中的主要污染物。陆继龙等(2007)通过分析第二松花江中下游水和底泥样品,均检出总量较高的PAEs,总量范围为64.45~6100.99 μg·L-1,其中DBP和DEHP已超过中国地表水标准限值。张付海等(2008)对合肥市的2个重点饮用水水源董铺水库和巢湖以及饮用水进行分析,结果表明,该市饮用水及水源水不同程度地受到PAEs污染,DBP和DEHP在所有采样点位均有检出,DBP最高质量浓度为6.47 μg·L-1,DEHP最高含量为3.05 μg·L-1。通常,地下水中PAEs的含量要低于地表水。黄冠星等(2008)对佛山东部地下水中PAEs的分布情况分析,地下水PAEs的检出率为59.4%,6种PAEs中仅DEHP和DnBP两种有检出,无PAEs超标。蒋丽佳等(2013)对江苏某癌症高发区地下水布点检测,地下水中PAEs污染程度较严重,总质量浓度均值为10034.56~14872.91 ng·L-1,DBP和DEHP均有超标现象。从上述检测结果可以看出,国内地表水、地下水等水环境均已不同程度地受到PAEs污染,种类多,含量高,很
多已超出中国国家标准中允许的浓度,其中以DBP和DEHP最为典型。
国外许多国家研究发现城市污水、工业废水以及污泥的排放同样是PAEs进入环境的主要途径。Rosleva等(2007)检测了丹麦奥尔堡市东污水处理厂出水及干污泥中4种PAEs(DMP、DBP、BBP、DEHP)的浓度,结果表明,出水中4种PAEs的平均质量浓度在0.115~4.92 μg·L-1,干污泥中未检出DMP,其他3种PAEs的质量分数在1.19~67.18 μg·g-1。Dargnat等(2009)对法国马恩河上某污水厂出水和干污泥中6种PAEs(DMP、DEP、DBP、BBP、DOP、DEHP)进行了研究,出水中除DMP、DOP未检出外,其余4种PAEs均检出,质量浓度在0.78~5.02 μg·L-1;干污泥中6种PAEs均检出,质量分数在0.09~72.1 mg·kg-1。Peijnenburg等(2006)测定了荷兰淡水、海水、海底沉积物和鱼类中的PAEs,结果发现淡水中的DnBP和DEHP含量较高,而海水、海底沉积物和鱼类中的含量均低于检测限。众多研究结果表明,与国内相似,国外许多国家的水环境也受到较严重的PAEs污染,检出的PAEs种类较多,且DEHP含量最高。
3 水环境中PAEs的去除方法
关于去除水环境中的PAEs已有大量的研究,处理方法可概括为3种:物理/化学方法、生物处理方法和高级氧化技术(Advanced Oxidation Process,AOPs)。
物理化学方法处理难降解有机物应用较多的为混凝、吸附和膜工艺。采用无机混凝剂和聚合混凝剂的强化混凝已被用于去除水和废水中的微污染物。强化混凝具有诸多优势,尤其是费用低、设计简单和运行方便,然而,对于PAEs的去除效果不佳。吸附对于处理较大量的含PAEs的废水是有效的,但是吸附材料的再生成本较高且不利于环保。很多研究以及实际应用表明吸附处理与其他方法如生物处理、高级氧化技术等联用,可以更有效更经济地去除污染物。膜工艺去除污染物效果很好,但是成本很高。
生物处理技术由于效率高、成本低而备受人们青睐,采用生物降解方法处理废水中的PAEs正逐渐成为研究热点。通常生物处理是去除污水中有机物最经济的技术,但是某些微污染物质及其中间产物既无法被生物降解又对生物处理工艺和水生环境产生毒性,因此必须通过预处理或后处理去除。
近年来,高级氧化技术因其能够快速有效地去除饮用水和污水中不同种类的有机污染物而备受关注,且发展迅速。同时,欧盟水框架指令(WFD)第四条也是推动处理饮用水和污水发展高级氧化技术的驱动之一。大量研究表明,在高级氧化过程中应用催化剂可大大提高氧化效率和降解程度,因此应用高级催化氧化技术去除水中微量有机污染物,如PAEs,已受到人们的广泛重视。
高级催化氧化技术原理是在氧化过程中通过使用催化剂、紫外光辐射、高温高压、电、超声波或微波辐射等方式产生高度反应性微粒——自由基,其有很强的氧化能力,其中羟基自由基(·OH)是最主要的,通过自由基与有机物之间的加成、取代、电子转移断键等途径,水体中的有机物可降解成无毒无害的小分子物质。目前研究较多的有芬顿氧化过程、光催化氧化和臭氧催化氧化法,还有应用超声波/微波以及纳米催化剂促进催化氧化过程的技术。
3.1 催化湿式过氧化物氧化过程
催化湿式过氧化物氧化过程(Catalytic Wet Peroxide Oxidation)以H2O2(自由基来源)为氧化剂,选择合适的催化剂诱发过氧化氢平拆分解生成·OH(主要自由基)。
3.1.1 均相芬顿过程
芬顿过程是催化湿式过氧化物氧化技术中一种重要的方法,由Fe2+和H2O2组成。芬顿过程是均相催化过程,传统的羟基自由基理论认为Fe2+与H2O2之间的链式反应催化生成的·OH等自由基降解污染物,且生成的Fe3+在一定酸度下以Fe(OH)3胶体形态存在,具有凝聚、吸附性能,也可去除有机物。He等(2009)采用Fenton法去除垃圾渗滤液中的PAEs和BPA,晚期渗滤液中的PAEs的去除率大于40%,而早期渗滤液中PAEs的去除率只有20%。当PAEs质量浓度富集至1.5 mg·L-1时,去除率达到88%,表明PAEs的去除效率与PAEs的浓度有关。杨开林等(2006)研究表明,PAEs在H2O2单独作用下不能被氧化分解。在Fenton试剂作用下,PAEs的去除率有明显的提高,在Fe2+浓度为0.1 mol·L-1、H2O2浓度为6.7 mol·L-1、PAEs质量浓度为6 mg·L-1、温度为60 ℃、pH值为3、反应时间为20 h的条件下,DMP、DBP、DEHP的去除率分别为97.1%、89.5%、84.3%。
3.1.2 光助芬顿过程
传统的芬顿过程中增加UV辐射不仅能够增加·OH的生成量,提高反应速率,还能够使铁催化剂循环使用。Zhao等(2004)发现在紫外光辐照下,Fenton试剂的降解效果显著提高。实验表明,在pH值为3,H2O2和Fe2+的初始浓度分别为5.00×10−4和1.67×10−4mol·L-1条件下降解效果最优,在UV辐照120 min后,降解效率可达81%。Yang等(2005)
研究发现在pH值为3,H2O2和Fe2+的初始浓度分别为5.00×10−4和1.67×10−4mol·L-1条件下,在UV辐照120 min后得到最高降解率(75.8%)。Chiou等(2006)研究在UV/H2O2/Fe3+过程中,以TOC的矿化度为指标,在最优降解条件下,可达到92.4%的矿化度。
3.1.3 异相芬顿过程
异相芬顿过程是指氧化反应在固体催化剂表面进行的一类湿式氧化过程,多种含铁固体可以作为异相芬顿反应的催化剂,比如Fe2O3、Fe2Si4O10、Fe(Ⅱ)负载于沸石、Al2O3、SiO2等载体上的复合化合物。异相催化比均相催化有更多的实际应用趋势。Yuan等(2011)采用UV/Si-FeOOH/H2O2系统降解DMP,研究结果表明,当初始pH值为5,Si-FeOOH(Si/Fe=0.2)投加量为0.5 g·L-1,H2O2浓度为2.0 mmol·L-1,UV光照强度为125 W时,反应30 min后DMP的降解率能达到97%。
有研究表明,在芬顿过程中加入草酸可以大大增加降解效率。Feng等(2012)使用Fe3+/H2O2/草酸系统降解DMP,表明在可见光照射下可以产生大量·OH,随着Fe3+、H2O2原始浓度的增加,DMP降解率上升,而原始草酸浓度增加却导致DMP降解率降低。由于H2O2价格昂贵,Fenton法单独使用成本高,通常是和其它生物、混凝、吸附等处理技术联用,将其作为生化处理的预处理或深度处理,以提高处理效果和降低成本。孙大贵等(2007)研究了在Fenton试剂与活性炭的协同作用下,对PAEs具有较好的去除效果。PAEs水溶液经活性炭-Fenton法处理15 h后,PAEs的平均去除率可达到99.11%。
3.2 催化臭氧氧化过程
臭氧氧化去除有机污染物通过2条途径进行:臭氧分子氧化污染物和臭氧在碱性条件下分解生成·OH并氧化污染物。臭氧分子的氧化有选择性,通常,臭氧氧化只对含有特定官能团的有机污染物有效。催化臭氧氧化法应用最广泛的催化剂是过渡金属、活性炭及负载型金属。Huang等(2011)研究了负载Fe的介孔分子筛SBA-15(即Fe/SBA-15)臭氧氧化DMP的降解过程。结果表明在O3浓度为50 mg·h-1,DMP质量浓度为10 mg·L-1,Fe/SBA-15质量浓度为0.20 g·L-1的条件下可以显著提高DMP和总有机碳(TOC)的去除效率。Oliveira等(2011)研究了O3耦合活性炭(AC)去除水中DEP的过程,结果显示降解效率取决于AC的结构特性和化学官能团,DEP被自由基基本去除。Chen等(2011)开展了应用具有催化和吸附性能的TiO2/Al2O3催化剂组合臭氧氧化降解DMP的研究,催化剂的存在使DMP得到了高效去除,同时显著加速了矿化速率。
3.3 光催化氧化过程
光催化氧化是在光化学氧化基础上加入催化剂以促进氧化过程,催化剂(半导体)具有双重倾向,能同时吸附反应物和有效光子。光催化氧化降解水中有机污染物能耗低,操作简单,反应条件温和,可以轻易地使各种有机物矿化,减少二次污染,并且光催化剂廉价易得,因此光催化氧化技术日益受到人们的重视。但由于反应条件所限,光化学氧化降解往往不够彻底,易产生多种芳香族有机中间体,成为光化学氧化需要克服的问题。
3.3.1 二氧化钛催化氧化过程
在众多半导体材料中,TiO2的光量子产量最大、光催化效率最高,有价格低廉、无毒、稳定等特性。在光催化氧化过程中最常用的TiO2形式是锐钛矿。TiO2的应用形式有悬浮态、固相薄膜、掺杂各种化学元素以及负载于固相载体上。Xu等(2009)研究了UV/TiO2降解水体中的BBP的效果和机理,UV/TiO2处理BBP的降解速率遵从拟一级动力学,BBP及其中间产物在增加光照时间的情况下最终矿化为CO2和H2O。Chung等(2009)研究了TiO2在UV辐射下,最终将DEHP降解为CO2,分析了DEHP的降解机理,表明光催化降解DEHP是一种简单而快速的方法。Yuan等(2008)采用UV照射,在悬浮TiO2水溶液中,用O2或Fe(VI)作电子受体的方法,比较了TiO2–UV–O2和TiO2–UV–Fe(VI)两种系统对DMP的降解途径。实验表明,高价铁Fe(VI)是比O2更有效的电子受体,能有效从催化剂表面截获导电电子。
3.3.2 其他光催化剂催化氧化过程
半导体材料可以作为感光剂,是因为其中化合态金属原子的电子结构包括一个充满电子的价带和一个空的导带。很多材料都具有这种性质,可以作为光催化氧化过程中的催化剂,例如金属氧化物ZnO、CeO2,金属硫化物CdS、ZnS,Al和Fe的改性硅酸盐,CuO-SnO2等。高学鹏等(2013)采用水热法,经由葡萄糖炭化合成了碳修饰Bi2WO6(C-Bi2WO6)催化剂,考察了C-Bi2WO6光催化降解3种邻苯二甲酸酯PAEs的催化性能。结果表明,C-Bi2WO6对PAEs的降解效果优于Bi2WO6,特别是在葡萄糖与NaWO4-2H2O质量比约10∶100条件下得到的催化剂的催化性能最优。与此同时,当PAEs的pH=6时降解效果最好,而PAEs的浓度也对PAEs的光催化降解有一定的影响。Chen等(2008)研究调查通过髙硅沸石和UV辐射强化臭氧氧化降解DMP的过程,检测进口处臭氧气体浓
度、髙硅沸石投加量和UV辐射强度对反应的影响。结果表明,在UV辐射结合臭氧氧化过程中,髙硅沸石的存在加速了DMP的降解速率,同时COD和TOC的去除率都有显著提高。
3.4 超声催化氧化过程
超声辐射与其它催化技术联用,可提高超声波降解污染物的速率。超声辐射引起的剧烈湍动可强化有机污染物与固态催化剂之间的固液传质,持续清洗催化剂表面,并保持催化剂活性(江传春等,2011),显著提高降解效率。但目前对超声辐射降解PAEs的研究还较少。Xu等(2013)采用高频超声波降解DMP,通常400 kHz是得到DMP最高降解率的最优频率。Xu等(2013,2014)又研究超声与光助芬顿过程协同降解DBP的处理效果,结果表明,US/UV/Fe2+的协同效应降解DBP效果明显优于单独使用US/Fe2+、US/UV、UV/Fe2+过程,提出US/UV/Fe2+组合工艺是提高DEP可生化性的有效途径,可促进其生物降解。
3.5 微波辅助催化氧化过程
微波(MW)在水溶液中的传播可产生·OH,且催化氧化过程中催化剂可被MW加热,因此提高了反应活性。杨开林等(2006)研究了在微波辐射作用下,Fenton试剂+活性炭催化氧化体系降解水样的PAEs反应速度快,所需时间短。在PAEs溶液质量浓度为6 mg·L-1、Fe2+浓度为0.06 mol·L-1、H2O2浓度为4.1 mol·L-1、H2O2/Fe2+摩尔比为68∶1、微波功率为480 W、微波辐射时间为4 min、pH值为3的条件下,DMP、DBP、DEHP的去除率都在90%左右。Chen等(2012)研究证明在微波照射下,由活性炭负载Fe@Fe2O3纳米线可大幅度促进DMP的降解速率。微波辐射时,电子从活性炭转移到零价铁,然后与分子氧反应生成O2·−和·OH,微波辐射可以加速电子从活性炭向Fe@Fe2O3的转移速率,产生更多的自由基。
3.6 高级纳米催化氧化过程
纳米技术近年来发展迅速,关于应用纳米金属颗粒作为水和废水处理工艺中催化剂的研究日益增多。由于纳米催化剂的高反应性、巨大的比表面积及纳米颗粒的高流动性,所以使用纳米催化剂可比传统催化技术更快或更便宜地清除污染物。李岩(2006)合成了纳米尺寸的复合材料H3PW12O40/TiO2(锐钛矿型)作为光催化剂,在400 W氙灯(波长范围360~600 nm)照射下,当催化剂用量为0.3 g,光照5 h,初始质量浓度为50 mg·L-1时,DBP降解速率最快,降解率达到80%,并证明了只有在催化剂和光源协同作用时,水中DBP才可获得较快的降解。Wang等(2012)合成了掺Cl的锐钛矿型TiO2纳米微晶,掺杂后的TiO2需要更高的波长,所以用它在可见光的照射下降解BBP。在可见光照射240 min后,BBP的光解速率可达92%。Huang等(2013)通过混合金属氧化物的重组合成了有机层状双氢氧化物(LHDs)/TiO2复合物,用其光解DMP。实验结果表明,鳞片状结构的有机LHDs可以有效地吸附DMP分子。DMP在复合材料上的富集和复合物的外部羟基会产生协同效应,从而显著提高DMP的光催化降解速率。
众多研究结果表明,在高级氧化过程中加入催化剂可提高反应速率的数量级,使化学反应在最适合的热力条件下进行,降低所需反应温度和压强。高级催化氧化技术可以高效快速地去除PAEs,并且多种催化氧化技术联用可以得到更高的PAEs降解效率,其中,Fenton催化氧化技术在氧化过程中通过使用催化剂或协同紫外光等方式,可无选择性地将PAEs完全降解为无毒无害的小分子物质,对PAEs的氧化去除效果最好。但高级催化氧化技术耗能较大、氧化剂消耗量大,所以未能大量投入工业应用。
4 结论与研究展望
水环境中邻苯二甲酸酯类物质的污染日益严重,对人类的健康和生态环境造成了潜在的威胁,引起了大量学者的广泛关注。寻找有效去除该类物质的方法与技术,是今后研究人员的一个重要努力方向。目前,我们非常有必要发展清洁、可持续、低成本、高效率的绿色处理工艺,所以必将推动高级催化氧化技术在去除水和废水中PAEs的应用。高级催化氧化技术能够快速降解PAEs,并且降解程度较高,最大优势是比较灵活,但是成本较高,且大多限于实验室阶段,并未大规模应用,因此还需要进一步发展创新。
未来对于水中PAEs应用高级催化氧化法处理的研究重点应包括:1)催化剂的特定合成,即开发选择性高、耐久性强、高效能、价格低廉且易回收利用的催化剂;2)深入探讨废水催化氧化机理和动力学研究,分析催化剂使用的最优条件,对催化反应器进行最优设计,提高其氧化反应能力;3)解决能量消耗大的问题;4)单一处理技术氧化PAEs的能力非常有限,需要与其他水处理技术联用,如:多种催化氧化技术联用,或催化氧化技术与生物处理过程组合,以得到更好地矿化效果;5)加大对高级催化氧化技术的研究力度,以期在实际工程中得到广泛应用。
ABDELDAIEM M M, RIVERA U J, OCAMPO-PÉREZ R, et al. 2012. Environmental impact of phthalic acid esters and their removal from water and sediments by different technologies-A review[J]. Journal of Environmental Management, 109: 164-178.
CHEN Yihung, HSIEH Dacheng, SHANG Nengchou. 2011. Efficient mineralization of dimethyl phthalate by catalytic ozonation using TiO2/Al2O3catalyst[J]. Journal of Hazardous Materials, 192(3): 1017-1025.
CHEN Yihung, SHANG Nengchou, HSIEH Dacheng. 2008. Decomposition of dimethyl phthalate in anaqueous solution by ozonation with high silica zeolites and UV radiation[J]. Journal of Hazardous Materials, 157(2/3): 260-268.
CHEN Yiling, AI Zhihui, ZHANG Lizhi. 2012. Enhanced decomposition of dimethyl phthalate via molecular oxygen activated by Fe@Fe2O3/AC under microwave irradiation[J]. Journal of Hazardous Materials, 235-236: 92-100.
CHIOU Chyowsan, CHEN Yihung, CHANG Changtang, et al. 2006. Photochemical mineralization of di-n-butyl phthalate with H2O2/Fe3+[J]. Journal of Hazardous Materials, 135(1/3): 344-349.
CHUNG Yingchien, CHEN Chihyu. 2009. Degradation of di-(2-ethylhexyl) phthalate (DEHP) by TiO2photocatalysis[J]. Water, air, and soil pollution, 200(1/4): 191-198.
DARGNAT C, TEIL M J, CHEVREUIL M, et al. 2009. Phthalate removal throughout wastewater treatment plant case study of marne aval station (France) [J]. Science of the Total Environment, 407(4): 1235-1244.
FENG Xianghua, ZHOU Jun, DING Shimin. 2012. Photodegradation of Dimethyl Phthalate by Fe(III)/Oxalate/H2O2System[J]. Advanced Materials Research, 550: 2412-2415.
HE Pinjing, ZHENG Zhong, ZHANG Hua, et al. 2009. PAEs and BPA removal in landfill leachate with Fenton process and its relationship with leachate DOM composition[J]. Science of the Total Environment, 407(17): 4928-4933.
HUANG Ruihuan, YAN Huihua, LI Laisheng, et al. 2011. Catalytic activity
of Fe/SBA-15 for ozonation of dimethyl phthalate in aqueous solution[J]. Applied Catalysis B: Environmental, 106(1/2): 264-271.
HUANG Zhujian, WU Pingxiao, LU Yonghong. 2013. Enhancement of photocatalytic degradation of dimethyl phthalate with nano-TiO2immobilized onto hydrophobic layered double hydroxides: A mechanism study[J]. Journal of Hazardous Materials, 246-247: 70-78.
JULINOVÁ M, SLAVÍK R. 2012. Removal of phthalates from aqueous solution by different adsorbents: A short review[J]. Journal of Environmental Management, 94 (1): 13-24.
OLIVEIRA D T F, CHEDEVILLE O, Fauduet H, et al. 2011. Use of ozone/activated carbon coupling to remove diethyl phthalate from water: Influence of activated carbon textural and chemical properties[J]. Desalination, 276(1/3): 359-365.
PEIJNENBURG W J G M, STRUIJS J. 2006. Occurrence of phthalate esters in the environment of the Netherlands[J]. Ecotoxicology and Environmental Safety, 63(2): 204-215.
ROSLEV P, VORKAMP K, AARUP J, et al. 2007. Degradation of phthalate esters in an activated sludge wastewater treatment plant[J]. Water Research, 41(5): 969-976.
SWAN S H. 2008. Environmental phthalate exposure in relation to reproductive outcomes and other health endpoints in humans[J]. Environmental Research, 108(2): 177-184.
WANG Xikui, WANG Chen, JIANG Wenqiang, et al. 2012. Sonochemical synthesis and characterization of Cl-doped TiO2and its application in the photodegradation of phthalate ester under visible light irradiation[J]. Chemical Engineering Journal, 189-190: 288-294.
XU L J, CHU W, GRAHAM N. 2013. A systematic study of the degradation of dimethyl phthalate using a high-frequency ultrasonic process[J]. Ultrasonics Sonochemistry, 20 (3): 892-899.
XU L J, CHU W, GRAHAM N. 2014. Degradation of di-n-butyl phthalate by a homogeneous sono-photo-Fenton process with in situ generated hydrogen peroxide[J]. Chemical Engineering Journal, 240: 541-547.
XU Xiangrong, LI Shenxin, LI Xiaoyan, et al. 2009. Degradation of n-butyl benzyl phthalate using TiO2/UV[J]. Journal of Hazardous Materials, 164(2/3): 527-532.
YANG Guipeng, ZHAO Xuekun, SUN Xiaojing, et al. 2005. Oxidative degradation of diethyl phthalate by photochemically-enhanced Fenton reaction[J]. Journal of Hazardous Materials B, 126(1/3): 112-118.
YUAN Baoling, LI Xiangzhong, GRAHAM N. 2008. Reaction pathways of dimethyl phthalate degradation in TiO2-UV-O2and TiO2-UV-Fe(VI) systems[J]. Chemosphere, 72(2): 197-204.
YUAN Baoling, LI Xiaoting, LI Kunlin, et al. 2011. Degradation of dimethyl phthalate(DMP) in aqueous solution by UV/Si-FeOOH/H2O2[J]. Colloids and Surfaces A: Physicochem. Eng. Aspects, 379(1/3): 157-162.
ZHAO Xuekun, YANG Guipeng, WANG Yujue, et al. 2004. Photochemical degradation of dimethyl phthalate by Fenton reagent[J]. Journal of Photochemistry and Photobiology A: Chemistry, 161(2/3): 215-220.
崔学慧, 李炳华, 陈鸿汉, 等. 2010. 中国土壤与沉积物中邻苯二甲酸酯污染水平及其吸附研究进展[J]. 生态环境学报, 19(2): 472-479.
杜娴. 2012. 重庆主城两江水体与沉积物中邻苯二甲酸酯和多环芳烃污染水平及特征[D]. 重庆大学.
高学鹏, 欧阳海平. 2013. 碳修饰钨酸铋光催化降解水体中的邻苯二甲酸酯[J]. 化学研究, 24(4): 412-415.
胡晓宇, 张克荣, 孙俊红, 等. 2003. 中国环境中邻苯二甲酸酯类化合物污染的研究[J]. 中国卫生检验杂志, 13(1): 9-14.
黄冠星, 孙继朝, 陈玺, 等. 2008. 佛山东部地下水酞酸酯分布特征及其成因探讨[J]. 中山大学学报: 自然科学版, 47(6): 70-75.
江传春, 肖蓉蓉, 杨平. 2011. 高级氧化技术在水处理中的研究进展[J].水处理技术, 37(7): 12-16, 33.
蒋丽佳, 许秋瑾, 梁存珍, 等. 2013. 江苏某县地下水邻苯二甲酸酯类的检测与风险评价[J]. 中国环境监测, 29(4): 5-10.
李岩. 2006. 纳米H3PW12O40/TiO2复合材料光催化降解水中酞酸酯类化合物的研究[D]. 东北师范大学.
陆继龙, 郝立波, 王春珍, 等. 2007. 第二松花江中下游水体邻苯二甲酸酯分布特征[J]. 环境科学与技术, 30(12): 35-37, 119.
倪明. 2010. 邻苯二甲酸酯的污染现状及去除研究进展[J]. 水处理技术, 36(4): 9-13.
孙大贵, 陶长元, 刘作华, 等. 2007. 活性炭-Fenton组合法去除水中PAEs的研究[J]. 环境科学, 28(12): 2734-2739.
王晓丹, 杨杰, 严浩, 等. 2012. 兰州市西固区大气降尘中邻苯二甲酸酯分布特征及来源分析[J]. 地球与环境, 40(3): 336-341.
杨开林. 2006. 微波+Fenton试剂+活性炭处理邻苯二甲酸酯的研究[D].重庆大学.
张付海, 张敏, 朱余, 等. 2008. 合肥市饮用水和水源水中邻苯二甲酸酯的污染现状调查[J]. 环境监测管理与技术, 20(2): 22-24.
赵胜利, 杨国义, 张天彬, 等. 2009. 珠三角城市群典型城市土壤邻苯二甲酸酯污染特征[J]. 生态环境学报, 18(1): 128-133.
Removal of phthalic acid esters from water by advanced catalytic oxidation process
LIU Jing1*,LI Yaru1,WANG Jie1,CHEN Kaikai2
1. School of Municiple and Environmental Engineering, Shandong Jianzhu University, Jinan 250101, China; 2. Shandong Hong Run Tan Cheng Construction Consulting Co., Ltd, Jinan 250101, China
Generally, phthalic acid esters(PAEs) are considered to be endocrine disrupting chemicals (EDCs). This substance is widely used in plasticizers, cosmetics, etc. PAEs would give rise to malformation, cancerization and mutation as well as possess quasi/anti-estrogen activity and quasi/resistance-thyroid hormone activity. PAEs could spread to the environment easily and be detected in the soil, air and water. They are common pollutants in the environment, which pose serious threats to both human health and the ecological environment. As a result, PAEs have attracted widespread attention at home and abroad. This paper summarizes the physi-chemical properties and toxic effects of PAEs and analyses the pollution status in natural water, groundwater and wastewater. The work also discusses many recent methods developed to remove PAEs, such as enhanced coagulation, adsorption, membrane treatment, biological treatment, advanced oxidation process, etc. Advanced oxidation technology has attracted much attention and developed rapidly because of it’s ability to remove different kinds of organic pollutants quickly and efficiently from drinking water and sewage. This article introduces the degradation of PAEs in water mainly using advanced oxidation technology which includes the catalytic wet peroxide oxidation, the catalytic ozone oxidation, photocatalytic oxidation, ultrasonic and microwave assisted catalytic oxidation and advanced nanometer catalytic oxidation. Fenton catalytic oxidation process could produce highly reactive hydroxyl radicals by adding catalyst and UVradiation in the process of oxidation. This method could achieve the highest oxidation efficiency as well as degrade PAEs into non-toxic harmless chemicals completely and non-selectively. Although application of the catalyst in advanced oxidation process can improve the oxidation efficiency and the degradation degree greatly, this method needs a huge amount of catalyst and energy and also influenced by pH value. Additionally, the research of this removal method is mostly confined to the laboratory stage and fails to be put into large-scale industrial applications, which needs further development and innovation. As a result, development of new catalyst of high efficiency, improvement of selectivity of catalyst, optimization of reaction conditions and reactors of catalytic oxidation as well as incorporation with other technology are the development direction of PAEs pollution control technology.
phthalic acid esters; pollution status; advanced catalytic oxidation process; catalyst; incorporation
X53
A
1674-5906(2014)05-0904-07
山东省教育厅科技计划项目(J11LB18)
刘静(1969年生),女,副教授,博士,主要研究方向为环境监测与评价。E-mail:liujing99@sdu.edu.cn
*通信联系人
2014-02-21
刘静,李亚茹,王杰,陈凯凯. 高级催化氧化法去除水中邻苯二甲酸酯的研究进展[J]. 生态环境学报, 2014, 23(5): 904-910.
LIU Jing,LI Yaru,WANG Jie,CHEN Kaikai. Removal of phthalic acid esters from water by advanced catalytic oxidation process [J]. Ecology and Environmental Sciences, 2014, 23(5): 904-910.
