纳米TiO2对耕作红壤土壤微生物活性的影响
2014-02-28刘启明吴泽恩朱艺贞曹英兰焦玉佩曹馨
刘启明,吴泽恩,朱艺贞,曹英兰,焦玉佩,,曹馨
1. 集美大学食品与生物工程学院,福建 厦门 361021;2. 中国科学院城市环境研究所,福建 厦门 361021
纳米TiO2对耕作红壤土壤微生物活性的影响
刘启明1,吴泽恩1,朱艺贞1,曹英兰1,焦玉佩1,2,曹馨1
1. 集美大学食品与生物工程学院,福建 厦门 361021;2. 中国科学院城市环境研究所,福建 厦门 361021
作为最为常用的纳米材料,纳米TiO2潜在的生态环境负面效应已日渐引起重视。土壤微生物活性是土壤微生物群落生长状况的整体表现,是反映土壤污染、表征土壤质量、衡量土壤生态系统管理措施和扰动变化的敏感指标。本研究将纳米TiO2均匀混合于耕作土壤,以土壤—纳米TiO2—微生物体系为研究对象,通过对耕作红壤的现场实验,综合土壤微生物菌落数、呼吸强度和蛋白酶活性等参数,较为真实的反映了纳米TiO2对土壤微生物活性的影响。数据表明,在整个90 d的试验周期内,空白对照土样土壤微生物菌落数变化范围是3.59~3.92 CPU(107·g-1)、土壤呼吸强度变化范围是0.49~0.61(mg·g-1)、土壤蛋白酶活性变化范围是0.068~0.081(mg·g-1)。耕作红壤掺杂不同剂量(0.1、0.2、0.5、1、3 mg·g-1)纳米TiO2后,土壤微生物菌落数、呼吸强度和蛋白酶活性等参数均低于空白对照土样,说明土壤微生物活性受纳米TiO2抑制,且纳米TiO2剂量越大,抑制作用越明显。研究结果对综合评判人工纳米材料的生态环境效应可提供数据支撑。
纳米TiO2;红壤;微生物活性
纳米材料是指在三维空间中至少有一维几何尺寸在纳米尺度(1~100 nm)的材料, 因其具有独特的理化性质,如小尺寸效应、大比表面、极高的反应活性、量子效应等,纳米材料已在生产、生活各领域中均有广泛的应用。自2003年以来,关于纳米材料的潜在生物毒性、是否会对生态环境产生影响以及影响的程度如何等问题已日渐引起重视(Service, 2003;Maynard,2006;Nel等,2006)。目前较多的工作集中在纳米材料对单一生物或体内细胞的毒理学实验室内研究方面,对于综合性的生态环境效应如微生物群落结构及功能方面的野外实践研究相对较少(林道辉等,2009;Sharifi等, 2012;Lewicka和Colvin,2013; Gardea-Torresdey等, 2014; Fajardo等, 2014)。
纳米TiO2是最为常用的纳米材料之一,在环保、医疗、涂料、汽车等各行业领域均有广泛应用。近年来,随着纳米包膜肥料、纳米土壤改良剂、TiO2光合作用促进剂等在农业生产中的规模化使用,纳米TiO2进入土壤的机会和数量与日俱增,已不可避免的造成土壤生态系统的暴露(Ge等, 2011; Du等, 2011; Kim等, 2012)。土壤微生物活性是土壤微生物群落生长状况的整体表现,是反映土壤污染、表征土壤质量、衡量土壤生态系统管理措施和扰动变化的敏感指标。本研究基于耕作红壤田地的现场实验,以土壤—纳米TiO2—微生物体系为研究对象,通过分析测试土壤微生物菌落数、土壤呼吸强度、土壤蛋白酶活性等参数,综合探讨纳米TiO2对土壤微生物活性的影响。以期促进对纳米材料生态环境风险方面的科学评估。
1 材料与方法
1.1 实验场地与材料
本研究采用将纳米TiO2均匀混合于耕作土壤中的野外现场实验方式。实验场地位于福建省厦门市坂头林场附近菜地中,土壤类型为硅铝铁质红壤土,质地以砂质粘壤土为主, pH为5.1, 上层土壤(0~40 cm)有机质含量为1.53%~2.16%。供试纳米TiO2为锐钛型TiO2粉末(DK Co. LTD),纯度>99%,平均粒径20 nm, 比表面积>15 m2·g-1。
1.2 实验流程
在菜地中随机选择5个0.1 m2大小土地,将纳米TiO2掺入耕作层(0~40 cm)土壤中,纳米TiO2与土壤的质量比按0.1、0.2、0.5、1、3 mg·g-1的比例混合均匀。在与周边土地保持同样土肥、水热条件下继续耕种。以10 d为一个实验采样频次,在一
个季度(90 d)的实验周期内,对6组实验(包括空白对照组-CK组)的表层(0~20 cm)土壤中的土壤微生物菌落数、土壤呼吸强度和土壤蛋白酶活性等指标分组测定。
1.3 分析测试
土壤微生物菌落数采用稀释平板计数法,土壤呼吸强度采用碱式滴定法,土壤蛋白酶活性采用Folin试剂分光光度法,各实验均参照规范方法操作(李振高等,2008;林先贵,2012)。
实验结果用统计软件Excel 2007和SPSS 16.0进行处理分析。
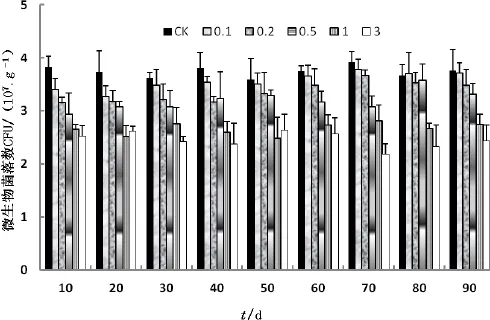
图1 不同纳米TiO2添加量/(mg·g-1)对土壤微生物菌落数的影响Fig. 1 The effect of different dosage/ (mg·g-1) of Nano -TiO2on soil microbial colonies
2 结果
2.1 纳米TiO2对土壤微生物菌落数的影响
通过测试包括空白对照组(CK)在内的6组土样在整个实验周期内的土壤微生物菌落数,图1表明,不同的纳米TiO2添加量和不同的时间段,土壤微生物菌落数变化表现出一定的差异性。CK组在整个90 d的试验周期内土壤微生物菌落数变化范围是3.59~3.92 CPU(107·g-1)。低纳米TiO2剂量(0.1、0.2 mg·g-1)土样微生物菌落数在实验前期(10、20、30 d)明显低于CK组,在实验后期(80、90 d)与CK组的差距有所缩小。如添加纳米TiO2剂量为0.1 mg·g-1的土样中的微生物菌落数变化范围是3.27~3.78 CPU(107·g-1);高纳米TiO2剂量(1、3 mg·g-1)土样微生物菌落数在整个实验周期内均明显受到抑制。如添加纳米TiO2剂量为3 g·kg-1的土样中的微生物菌落数变化范围是2.18~2.61 CPU(107·g-1)。总体而言,纳米TiO2对土壤微生物菌落数有一定的抑制作用,且纳米TiO2剂量越大,抑制作用越明显。
2.2 纳米TiO2对土壤呼吸强度的影响
通过测试包括空白对照组(CK)在内的6组土样在整个实验周期内的土壤呼吸强度(以CO2计,mg·g-1),图2表明,不同的纳米TiO2添加量和不同的时间段,土壤呼吸强度变化表现出一定的差异性。CK组在整个90 d的试验周期内土壤呼吸强度变化范围是0.49~0.61(mg·g-1)。低纳米TiO2剂量(0.1、0.2 mg·g-1)土样呼吸强度在实验前期(10、20、30 d)明显低于CK组,在实验后期(80、90 d)与CK组的差距有所缩小。如添加纳米TiO2剂量为0.1 mg·g-1的土样呼吸强度变化范围是0.43~0.54(mg·g-1);高纳米TiO2剂量(1、3 mg·g-1)土样呼吸强度在整个实验周期内均明显受到抑制。如添加纳米TiO2剂量为3 mg·g-1的土样呼吸强度变化范围是0.19~0.28(mg·g-1)。总体而言,纳米TiO2对土壤呼吸强度有一定的抑制作用,且纳米TiO2剂量越大,抑制作用越明显。
2.3 纳米TiO2对土壤蛋白酶活性的影响
通过测试包括空白对照组(CK)在内的6组土样在整个实验周期内的土壤蛋白酶活性,图3表明,不同的纳米TiO2添加量和不同的时间段,土壤蛋白酶活性变化表现出一定的差异性。CK组在整个90 d的试验周期内土壤蛋白酶活性变化范围是0.068~0.081(mg·g-1)。低纳米TiO2剂量(0.1、0.2 mg·g-1)土样蛋白酶活性在实验前期(10、20、30 d)明显低于CK组,在实验后期(80、90 d)与CK组的差距有所缩小。如添加纳米TiO2剂量为0.1 mg·g-1的土样蛋白酶活性变化范围是0.052~0.070(mg·g-1);高纳米TiO2剂量(1、3 mg·g-1)土样蛋白酶活性在整个实验周期内均明显受到抑制。如添
加纳米TiO2剂量为3 mg·g-1的土样蛋白酶活性变化范围是0.015~0.034(mg·g-1)。总体而言,纳米TiO2对土壤蛋白酶活性有一定的抑制作用,且纳米TiO2剂量越大,抑制作用越明显。

图2 不同纳米TiO2添加量(mg·g-1)对土壤呼吸强度的影响Fig. 2 The effect of different dosage (mg·g-1) of Nano -TiO2on intensity of soil respiration

图3 不同纳米TiO2添加量(mg·g-1)对土壤蛋白酶活性的影响Fig. 3 The effect of different dosage (mg·g-1) of Nano -TiO2on soil proteinase activities
3 讨论
3.1 土壤微生物活性的度量
土壤微生物是生活在土壤中的细菌、真菌、放线菌等的总称,土壤微生物菌落数的数值大小反映了土壤微生物在该土壤环境中的适宜程度;土壤呼吸强度主要反映了土壤微生物的呼吸作用,影响微生物活性的各种因素(如pH/温度/毒性物质)的变化都能从土壤呼吸强度的变化中反映出来;蛋白酶属于水解性酶类,为植物提供有效氮素营养和在促进营养元素的矿化上起重要作用,是衡量土壤肥力及土壤微生物总活性的一项重要指标。因此,综合土壤微生物菌落数、呼吸强度和蛋白酶活性等参数,基本能反映土壤微生物活性的整体状况(Hungria等, 2009;Chaer等, 2009;Manna等, 2013)。
3.2 纳米TiO2对土壤微生物活性的影响
纳米材料对生态环境的毒性效应的相关研究已有很多的工作开展,但是目前绝大部分工作是在实验室内进行的模拟实验,没能反映真实环境中的物理、化学和生物等各种因素的综合境况。本研究通过对耕作红壤的现场实验,能较为真实的反映纳米 TiO2对土壤微生物活性的影响。
纳米TiO2对土壤微生物抑制较为合理的影响机制是随着颗粒尺寸缩小,纳米TiO2表面晶格
可能出现破损,从而产生电子缺损或富余的活性位点,一定条件下可与O2相互作用形成超氧自由基(O2-)及其它ROS(Reactive Oxygen Species-活性氧簇)。ROS可增加氧化压力,导致脂质过氧化、破坏细胞膜,引起微生物毒性效应(Nel等, 2006;Lyon等, 2008)。对于能受到阳光照射的表层土壤,除了上述影响机制外,纳米TiO2的光催化特性也不容忽视。纳米TiO2在光照射下自行分解出自由移动的带负电的电子(e-)和带正电的空穴(h+),形成电子-空穴对。吸附溶解在TiO2表面的氧俘获电子形成氧自由基,而空穴则将吸附在TiO2表面的OH-和H2O氧化成氢氧自由基。生成的氧自由基和氢氧自由基均有很强的化学活性,特别是氧自由基能与多数有机物反应,使得有机物得到降解,从而抑制微生物的生长(Linsebigler等, 1995;Ge等, 2011;Allahverdiyev等, 2011)。
本研究中,耕作红壤掺杂纳米TiO2后,土壤微生物菌落数、呼吸强度和蛋白酶活性等参数均低于空白对照土样,说明土壤微生物活性受纳米TiO2抑制,且纳米TiO2剂量越大,抑制作用越明显。对于低纳米TiO2剂量(0.1、0.2 mg·g-1)土样土壤微生物菌落数、呼吸强度和蛋白酶活性等参数在实验前期(10、20、30 d)明显低于空白对照土样,在实验后期(80、90 d)与空白对照土样的差距有所缩小。可能是随着时间延长,由于浇灌,表层(0~20 cm)土壤中的部分纳米TiO2逐渐淋滤渗入中下层,其光催化性能也随之减弱,从而减少了对表层土壤微生物活性的抑制作用。而高纳米TiO2剂量(1、3 mg·g-1)土样中由于纳米TiO2剂量较高,即使部分淋滤流失后,在整个90 d的实验周期内也能一直保持对土壤微生物活性的明显抑制。
4 结论
通过对耕作红壤的现场实验,综合土壤微生物菌落数、呼吸强度和蛋白酶活性等参数,较为真实的反映了纳米TiO2对土壤微生物活性的影响。研究表明,在整个90 d的试验周期内,空白对照土样土壤微生物菌落数变化范围是3.59~3.92 CPU(107·g-1)、土壤呼吸强度变化范围是0.49~0.61(mg·g-1)、土壤蛋白酶活性变化范围是0.068~0.081(mg·g-1)。耕作红壤掺杂不同剂量(0.1、0.2、0.5、1、3 mg·g-1)纳米TiO2后,土壤微生物菌落数、呼吸强度和蛋白酶活性等参数均低于空白对照土样,说明土壤微生物活性受纳米TiO2抑制,且纳米TiO2剂量越大,抑制作用越明显。纳米TiO2对土壤微生物抑制机制包括由于纳米尺寸效应形成的超氧自由基(O2-)和其它ROS,以及由于TiO2的光催化效应生成的氧自由基和氢氧自由基的共同作用。
ALLAHVERDIYEV A M, ABAMOR E S, BAGIROVA M, et al. 2011. Antimicrobial effects of TiO2and Ag2O nanoparticles against drug-resistant bacteria and leishmania parasites [J]. Future Microbiology, 6(8): 933-940.
CHAER G, FERNANDES M, MYROLD D, et al. 2009. Comparative resistance and resilience of soil microbial communities and enzyme activities in adjacent native forest and agricultural soils [J]. Microbial ecology, 58(2): 414-424.
DU W, SUN Y, JI R, et al. 2011. TiO2and ZnO nanoparticles negatively affect wheat growth and soil enzyme activities in agricultural soil [J]. Journal of Environmental Monitoring, 13(4):822-828.
FAJARDO C, SACCA M L, COSTA G, et al. 2014. Impact of Ag and Al2O3nanoparticles on soil organisms: In vitro and soil experiments [J]. Science of the Total Environment, 473-474: 254-261.
GARDEA-TORRESDEY J L, RICO C M, WHITE J C. 2014. Trophic Transfer, Transformation, and Impact of Engineered Nanomaterials in Terrestrial Environments [J]. Environmental Science & Technology, 48 (5): 2526-2540.
GE Y, SCHIMEL J P, HOLDEN P A. 2011. Evidence for negative effects of TiO2and ZnO nanoparticles on soil bacterial communities [J]. Environmental science & technology, 45(4): 1659-1664.
HUNGRIA M, FRANCHINI J C, BRANDAO-JUNIOR O, et al. 2009. Soil microbial activity and crop sustainability in a long-term experiment with three soil-tillage and two crop-rotation systems [J]. Applied Soil Ecology, 42(3): 288-296.
KIM B, MURAYAMA M, COLMAN B P, et al. 2012. Characterization and environmental implications of nano- and larger TiO2particles in sewage sludge, and soils amended with sewage sludge [J]. Journal of Environmental Monitoring, 14(4):1128-1136.
LEWICKA Z A, COLVIN V L. 2013. Nanomaterial Toxicity, Hazards, and Safety. In Springer Handbook of Nanomaterials [M]. Springer Berlin Heidelberg, 1117-1142.
LINSEBIGLER A L, LU G, YATES J J T. 1995. Photocatalysis on TiO2 surfaces: principles, mechanisms, and selected results [J]. Chemical Reviews, 95(3): 735-758.
LYON D Y, BRUNET L, HINKAL G W, et al. 2008. Antibacterial activity of fullerene water suspensions (nC60) is not due to ROS-mediated damage [J]. Nano letters, 8(5): 1539-1543.
MANNA S, SINGH N, SINGH V P. 2013. Effect of elevated CO2on degradation of azoxystrobin and soil microbial activity in rice soil [J]. Environmental monitoring and assessment, 185(4):1-10.
MAYNARD A D. 2006. Safe handling of nanotechnology. Nature, 444: 267-269.
NEL A, XIA T, MADLER L, et al. 2006. Toxic potential of materials at the nanolevel [J]. Science, 311: 622–627.
SERVICE R F. American Chemical Society Meeting. 2003. Nanomaterials show signs of toxicity [J]. Science, 300: 243.
SHARIFI S, BEHZADI S, LAURENT S, et al. 2012. Toxicity of Nanomaterials[J]. Chem. Soc. Rev., 41: 2323-2343.
李振高,骆永明,滕应. 2008. 土壤与环境微生物研究法[M]. 北京: 科学出版社.
林道辉, 冀静, 田小利, 等. 2009. 纳米材料的环境行为与生物毒性[J].科学通报, 54: 3590-3604.
林先贵. 2012. 土壤微生物研究原理与方法[M]. 北京: 高等教育出版社.
Effect of Nano-TiO2on red soil microbial activity
LIU Qiming1, WU Zeen1, ZHU Yizhen1, CAO Yinglan1, JIAO Yupei1,2, CAO Xin1
1. College of Food and Biological Engineering, Jimei University, Xiamen 361021, China;2. Institute of Urban Environment, Chinese Academy of Sciences, Xiamen 361021, China
Nanomaterials have nanostructured components with at least one dimension less than 100 nm. Nanomaterials are already widely used in the various industries due to the special physical and chemical properties they exhibit compared to the bulk material. Increasing production and use of nanomaterials have raised concerns about their potential negative ecological and environmental impacts. Nano-TiO2is among the most highly used nanomaterials in industry. And Nano-TiO2is introduced into the soil as a result of a number of human activities, including intentional and unintentional releases. In this study, based on field test, the effects of nano-TiO2on red soil microbial activity were systematically investigated from three aspects including soil microbial colonies, intensity of soil microbial respiration and soil proteinase activities. Experimental results showed the soil microbial colonies of Ck soil samples range from 3.59-3.92 CPU(107·g-1), the soil respiration of Ck soil samples range from 0.49-0.61(mg·g-1), the soil proteinase activities of Ck soil samples range from 0.068-0.081(mg·g-1). And the soil microbial activity of red soil was inhibited after mixed with different dosages (0.1, 0.2, 0.5, 1, 3 mg·g-1) of nano-TiO2, and higher dosages of nano-TiO2, the more inhibition obvious.
Nano-TiO2; red soil; microbial activity
X171
A
1674-5906(2014)05-0859-05
福建省自然科学基金项目(2014J01162;2013J01162);厦门南方海洋中心项目
刘启明(1973年生),男,副教授,博士,从事生态环境研究工作。E-mail: liuqm@jmu.edu.cn
2014-02-24
刘启明,吴泽恩,朱艺贞,曹英兰,焦玉佩,曹馨. 纳米TiO2对耕作红壤土壤微生物活性的影响[J]. 生态环境学报, 2014, 23(5): 859-863.
LIU Qiming, WU Zeen, ZHU Yizhen, CAO Yinglan, JIAO Yupei, CAO Xin. Effect of Nano-TiO2on red soil microbial activity [J]. Ecology and Environmental Sciences, 2014, 23(5): 859-863.
