交替假单胞菌产几丁质酶的响应面优化
2014-02-28王晓辉大连大学生命科学与技术学院辽宁大连116622中国科学院大连化学物理研究所辽宁大连116023中国科学院大学北京100049
王晓辉,岳 敏(1.大连大学生命科学与技术学院,辽宁大连116622;2.中国科学院大连化学物理研究所,辽宁大连116023;3.中国科学院大学,北京100049)
交替假单胞菌产几丁质酶的响应面优化
王晓辉1,2,3,岳 敏2,3
(1.大连大学生命科学与技术学院,辽宁大连116622;2.中国科学院大连化学物理研究所,辽宁大连116023;3.中国科学院大学,北京100049)
采用响应面法对交替假单胞菌发酵产几丁质酶的培养基进行了优化。首先利用Plackett Burman实验设计筛选出影响产酶的3个主要因素,即胶体几丁质、发酵温度和pH。在此基础上用最陡爬坡路径逼近最大响应区域,再利用Box-Behnken实验设计及响应面分析法确定最佳条件。结果表明,胶体几丁质8.95g/L,蛋白胨2g/L,转速130r/min,接种量2%,发酵温度20℃,pH6.18,发酵时间96h,几丁质酶最大理论酶活为57.95U/mL。经3次实验验证,实际平均酶活与预测酶活相近,比优化前几丁质酶酶活提高了23.77%。
交替假单胞菌,几丁质酶,发酵,响应面分析
几丁质(chitin),俗称甲壳素、甲壳质,由N-乙酰葡萄糖胺单体以β-1,4-糖苷键连接起来的直链多聚物,是自然界中含量最丰富,海洋环境中仅次于纤维素的第二大可再生资源。几丁质广泛存在于甲壳纲动物虾蟹、昆虫的甲壳,以及真菌(酵母,霉菌)、藻类、植物的细胞壁中[1]。据估测,海洋环境每年超过1011吨几丁质形成,其降解主要是通过产几丁质酶的微生物完成[2-3]。
几丁质酶(Chitinase,EC3.2.1.14)是专一降解几丁质为几丁寡糖或几丁单糖的一组酶的总称[3]。根据几丁质酶氨基酸序列的同源性,将其分为18和19两个家族。其中,18家族几丁质酶广泛存在于病毒、微生物、植物和动物中,而19家族几丁质酶主要存在于植物中。另外,在链霉菌属和一些拟诺卡氏菌属的放线菌中也发现了19家族几丁质酶[4-5],18家族和19家族几丁质酶之间没有序列相似性,说明它们由不同祖先进化而来[6]。
微生物几丁质降解系统主要由内切几丁质酶(chitinase,EC 3.2.1.14)、外切几丁质酶(chitinase,EC 3.2.1.14)和β-N-乙酰己糖胺酶(β-N-acetylhexosaminidase,EC 3.2.1.52)组成。内切几丁质酶在高聚几丁质链内随机切割生成几丁质寡糖(chitooligosaccharides,(GlcNAc)n,n>2);外切几丁质酶有两种,分别从高聚几丁质链的还原端和非还原端依次切割下(GlcNAc)2;β-N-乙酰己糖胺酶将从非还原端将几丁质寡糖切割成为GlcNAc。某些物种中还发现了几丁质结合蛋白,起到分散几丁质糖链束的作用[7-8]。几丁质酶降解几丁质产生的几丁寡糖、几丁单糖及其衍生物由于具有良好的组织兼容性和生物降解性以及调节免疫力和抗癌的保健功能等特点,在医药、食品、农业、工业等领域有着广泛的应用前景[9-10]。
交替假单胞菌(Pseudoalteromonas)是海洋环境产几丁质酶的典型微生物,据报道该属可产生7种不同类型几丁质酶,该几丁质降解系统包括4种几丁质酶,3种N-乙酰氨基葡萄糖苷酶,1种糖基转移酶,1种几丁质结合蛋白和1种几丁质结合蛋白酶,协同降解几丁质,应用潜力巨大[11-13]。但国外已报道的交替假单胞菌野生菌生产几丁质酶的产量都比较低,国内未见该菌属生产几丁质酶的相关报道。本文从海洋底泥样品中筛选到高产几丁质酶的交替假单胞菌,命名为PseudoalteromonasDL-6(CGMCC NO.8580),拟通过响应面优化策略,进一步提高其几丁质酶产量,为后期几丁质酶的分离纯化、底物特异性与寡糖生产等酶学性质及应用研究奠定基础。
1 材料与方法
1.1 材料与仪器
交替假单胞菌(Pseudoalteromonas sp.DL-6) 筛选自中国辽宁大连渤海海域近海底泥6~100m(123° 371′E,39°6972′N);活化培养基(1000mL) 胶体几丁质10.0g,胰蛋白胨5.0g,琼脂粉15.0g,原地海水配制,pH自然;2216E斜面保藏培养基(1000mL)[14]牛肉膏1.0g,蛋白胨5g,琼脂粉15g,原地海水配制,pH自然;种子培养基(1000mL) 牛肉膏1.0g,蛋白胨5g,原地海水配制,pH自然;发酵培养基(1000mL) 胶体几丁质5g,蛋白胨5g,原地海水配制,pH自然;几丁质粉 美国Sigma公司;其他试剂 均为国产分析纯。
LRH系列生活培养箱、HWS24型电热恒温水浴锅 上海一恒科学仪器有限公司;全温振荡培养箱 太仓市华美生化仪器厂;Thermo Multiskan Ascent型酶标仪 芬兰Labsystems公司。
1.2 实验方法
1.2.1 胶体几丁质的制备[14]称取10.0g几丁质粉加100mL浓盐酸,搅拌均匀,加去离子水1.0L,反复洗至中性,最后用PBS(pH7.0)缓冲液重溶,配制成1%胶体几丁质溶液,避光保存于冰箱备用。
1.2.2 粗酶液制备 于2216E斜面保藏培养基挑取1环种子到液体种子培养基,20℃,130r/min摇床培养24h后,接种1%至发酵培养基,发酵培养4d,5000r/min下离心10min,收集上清液为粗酶液测酶活。
1.2.3 酶活检测 取粗酶液0.1mL与0.9mL,1%胶体几丁质混合,20℃下保温30min后,将反应混合物加热在沸水浴中10min终止酶反应,10,000×g离心5min,取上清0.5mL,加入1mL Schales试剂[15],沸水浴10min,测定OD420nm,设3个重复,取平均值,跟据N-乙酰-D-氨基葡萄糖标准曲线计算酶活力。酶活单位定义(U):在上述条件下,1min催化产生相当于lμmol的N-乙酰-D-氨基葡萄糖的还原糖所需的酶量。
1.2.4 实验设计
1.2.4.1 Plackett-Burman设计法筛选几丁质酶酶活的显著因素 根据前期优化单因素实验结果,分析可能影响Pseudoalteromonassp.DL-6发酵产几丁质酶的众多因素包括:氮源、碳源、转速、接种量、发酵温度、pH、培养时间。用PB设计对以上7个因素进行全面考察,以软件Minitab设计N=12的7因素,2水平的Placket-Burman实验。并设计4项虚拟项(A、E、F、H)。各因素对应因子代码如表1所示。
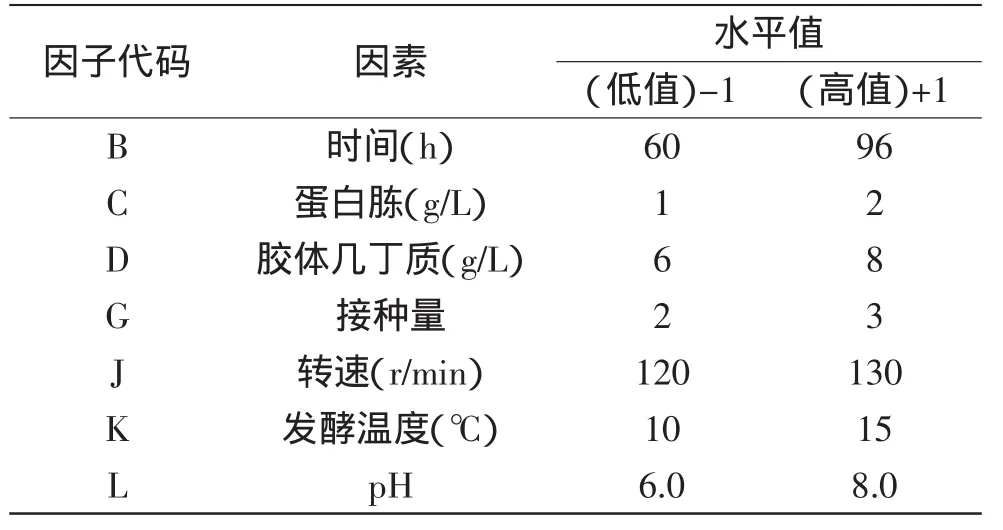
表1 Plackett-Burman实验设计各因素水平及分析Table 1 Levels of the variables and statistical analysis of Plackett-Burman design
1.2.4.2 最陡爬坡实验 根据Plackett-Burman的实验结果,做最陡爬坡实验,最陡爬坡法以实验值变化的梯度方向为爬坡方向,根据各因素效应值的大小确定变化步长,能快速、经济地逼近最佳值区域。确定Box-Behnken的中心点。
1.2.4.3 Box-Behnken实验设计 根据Plackett-Burman实验得到的三个显著因素及最陡爬坡实验的确定的中心点,设计N=15的3因素3水平实验。以胶体几丁质X1、温度X2、pH X3为自变量设计N=15组的Box-Behnken实验。如表2所示。

表2 响应面因素设计水平表Table 2 Range of different factor invested in RSM
1.3 数据分析
Plackett-Burman设计法是一种多因素、两水平的实验设计方法,适用于从众多的考察因素中快速有效地筛选出最为重要的几个因素,供进一步研究用[16]。最陡爬坡实验用以确定Box-Behnken实验的中心点,使B-B实验因素所取水平能最大程度的逼近最佳值区域。Box-Behnken设计用以确定因素对响应值的二次方程,从而计算出在选定范围内各因素的最佳值[17-19]。本文采用Minitab软件对实验数据进行分析,所做实验结果均有3组重复。
2 结果与分析
2.1 发酵培养基的P-B(Plackett-Burman)设计
由表1和Minitab软件得到PB实验设计,每组配方做三个平行样,N=12的PB实验设计及3次酶活的平均值结果如表3所示。

表3 Plackett-Burman设计结果Table 3 Plackett-Burman design matrix for evaluating factors influencing
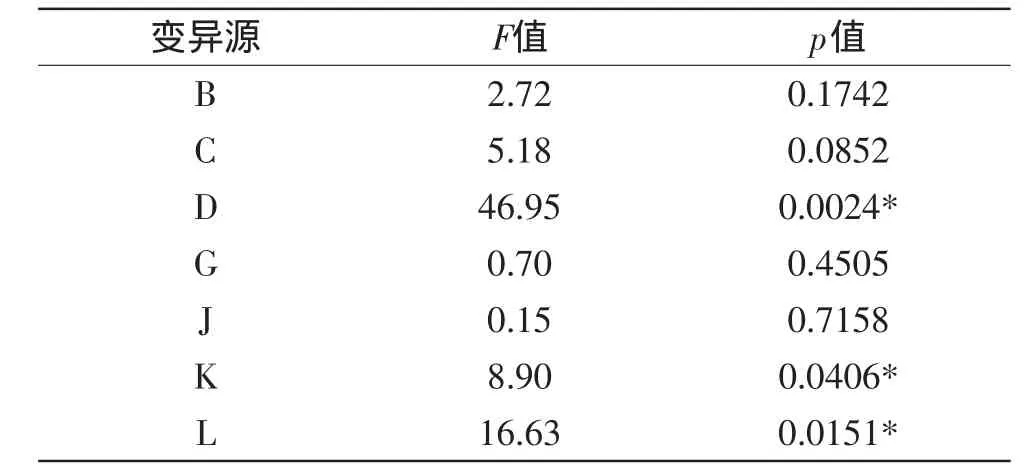
表4 P-B实验设计各因素主效应分析结果Table 4 Results of the variables and effect in P-B design
通过软件对实验数据进行分析,获得多元一次回归方程:
R1=52.04+0.33B+0.46C+1.39D-0.17G+0.079J+ 0.60K+0.83L
式中,R1为酶活的预测值;B、C、D、G、J、K、L分别为时间、蛋白胨、胶体几丁质、接种量、转速、温度、pH的编码水平。
根据实验结果,该模型显著(p=0.0160<0.05)。从表4可以看出,胶体几丁质(D),pH(L),发酵温度(K)的p值(Prob>F)小于0.05,说明这三个因素是主要响应因素,后续采用响应面分析法对这三个因素进行进一步研究。
其他因素对响应值影响均不显著,正效应的因素选取较高值(发酵时间96h、蛋白胨2g/L、转速为130r/min),负效应的因素选取较低值(接种量2%)进行后续实验。
2.2 最陡爬坡实验
根据Plackett-Burman实验得出:胶体几丁质,发酵温度和pH为影响发酵显著的三个因素,根据P-B实验结果设计最陡爬坡实验如表5所示。胶体几丁质、温度和pH均为显著正效应。得到最佳因子组为第2组:胶体几丁质8g/L,pH7.0,发酵温度15℃,以最佳因子组作B-B实验的中心点。
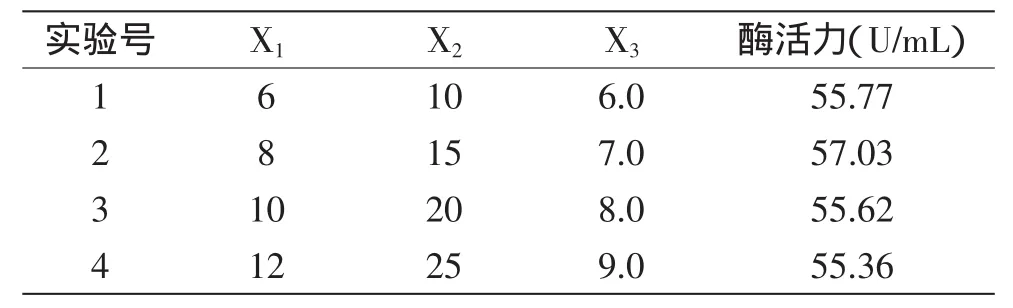
表5 最陡爬坡实验设计及实验结果Table 5 Experimental design and results of steepest ascent
2.3 响应面实验优化培养条件
2.3.1 B-B(Box-Behnken)实验设计 由Plackett-Burman实验和最陡爬坡实验确定的3个显著性因素和3个水平。以胶体几丁质X1、温度X2、pH X3为自变量设计N=15组的Box-Behnken实验。每组实验进行3次重复,结果取3次实验的平均值,结果如表6所示。
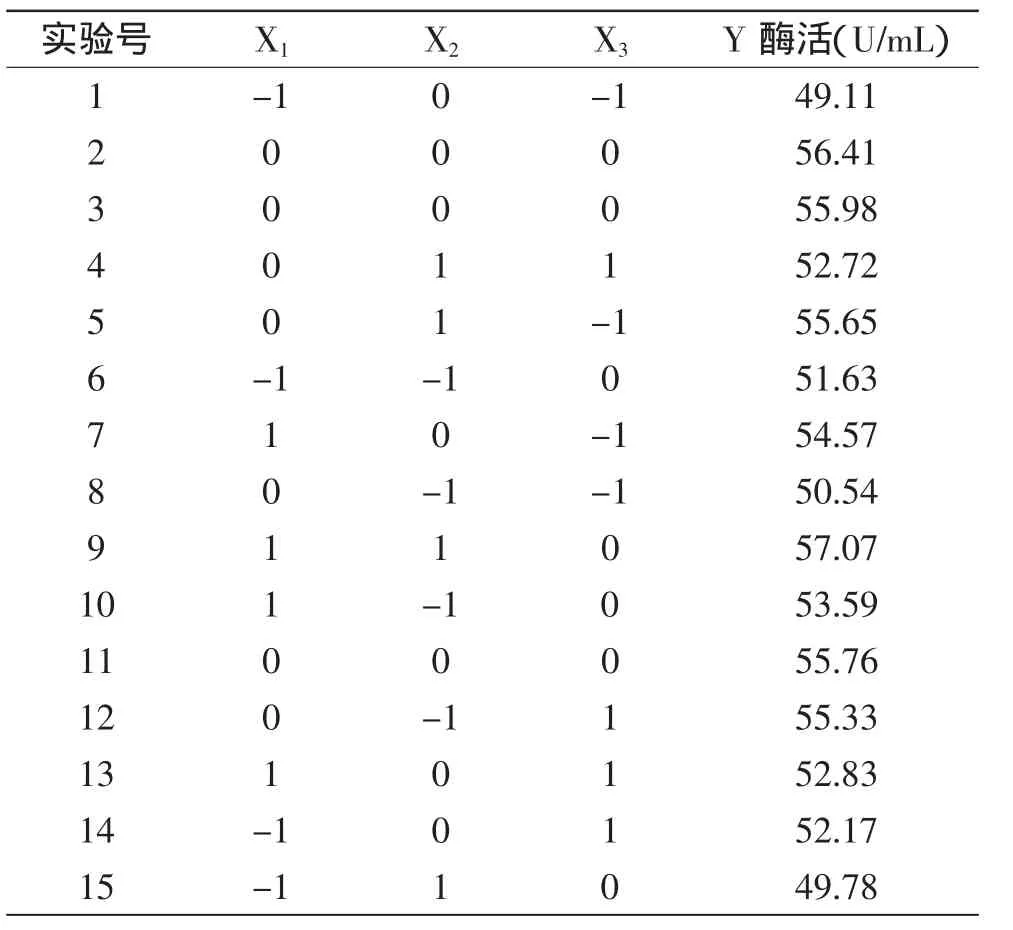
表6 Box-Behnken设计结果Table 6 Box-Behnken design with three independent variables
2.3.2 多元二次回归方程的建立及显著性检验 根据Minitab软件对实验结果分析得二次回归方程:
Y=56.05+1.921X1+0.516X2+0.398X3-2.211X12-0.821X22-1.669X32+1.333X1X2-1.200X1X3-1.930X2X3。
对方程进行回归系数显著性检测和方差分析,见表7。
根据响应面方差分析结果,模型失拟项p=0.2009,影响不显著,模型显著(p=0.0007),说明模型选择比较合适。回归系数R2=98.25%大于90%,说明模型相关度很好。因此认为可用来代替真实实验点对实验结果进行分析和预测。由表7回归系数的显著性检验可知,因素X1、X2对产酶的线性效应均显著,X3对产酶的线性效应不显著。
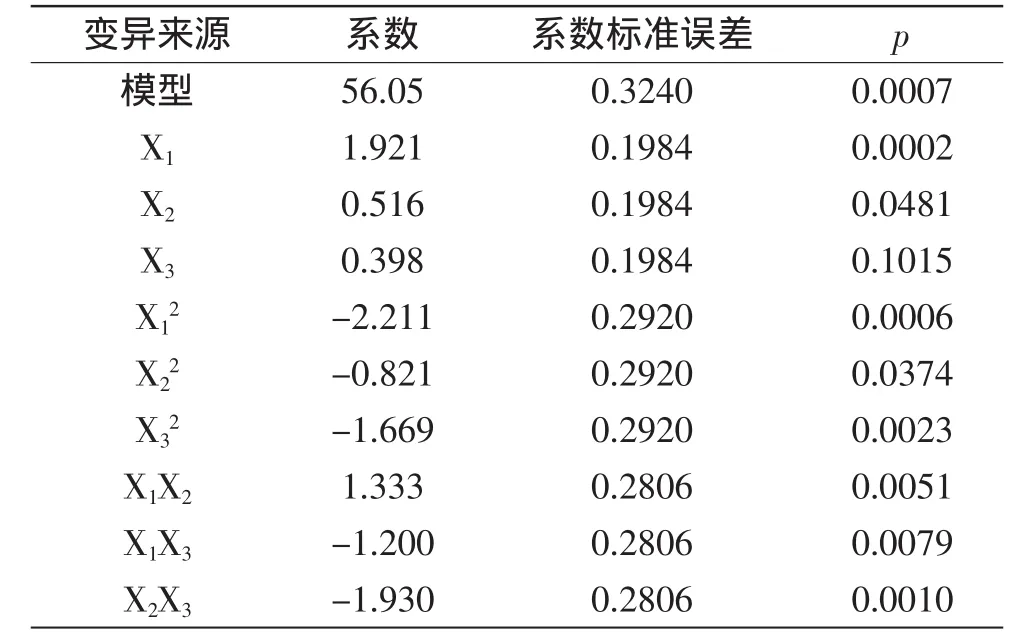
表7 回归方差系数表Table 7 Coefficient of regression equation
2.3.3 响应面分析及最优培养基成分和培养条件的确定 在获得回归非线性模型之后,为了求得各因子最佳值,根据所得到的回归模拟方程分别对各变量求一阶偏导数,并令其为零,得到一个三元一次方程组,求解此方程组可得到模型的极值,即当胶体几丁质8.95g/L、发酵温度20℃、pH6.18时,96h理论最大几丁质酶酶活为57.925U/mL。
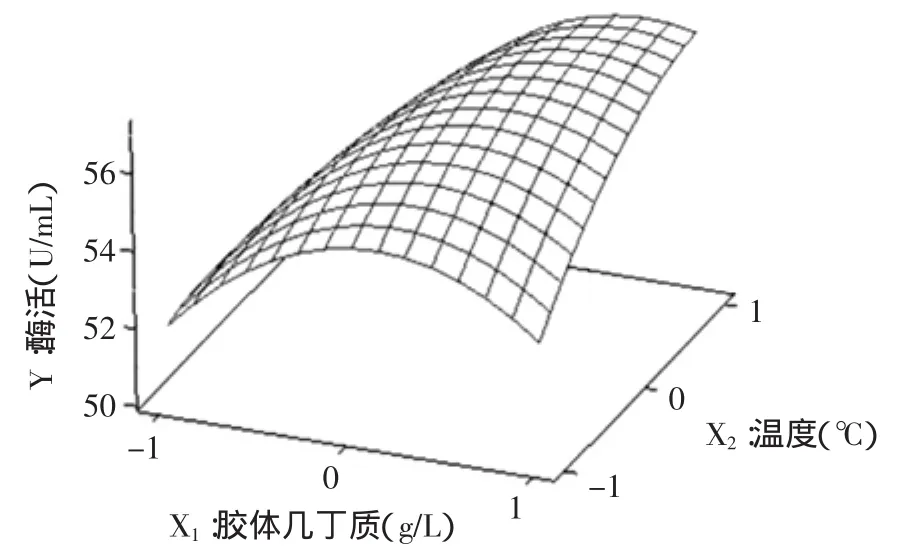
图1 温度与胶体几丁质交互影响酶活的响应曲面图Fig.1 Response surface plot of the effects of temperature and chitin colloidal chitin on the enzyme activity
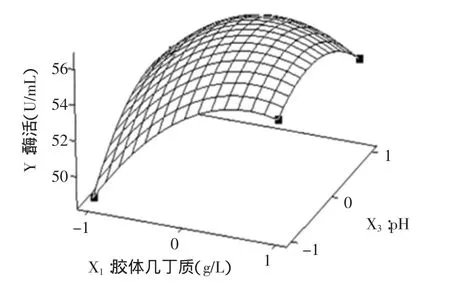
图2 pH与胶体几丁质交互影响酶活的响应曲面图Fig.2 Response surface plot of the effects of pH and colloidal chitin on the enzyme activity
根据二次多项式模型利用Minitab软件绘出响应面分析图,见图1~图3。每个响应面分别代表着两个独立变量之间的相互作用,此时第三个变量的编码值为零。由响应面图可以看出:胶体几丁质、发酵温度、pH三个因素之间存在着明显的交互作用,在实验水平范围内,随着胶体几丁质、发酵温度、pH的量增加,几丁质酶酶活呈先增加后降低的趋势。当胶体几丁质、发酵温度、pH分别为8.95g/L,20℃,6.18时达到最佳,几丁质酶酶活的理论值为57.925U/mL。
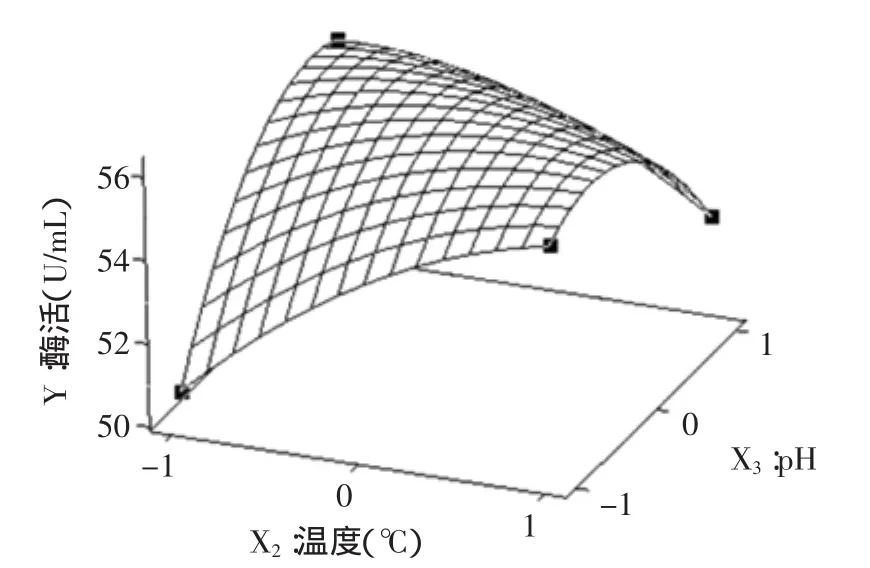
图3 pH和温度交互影响酶活的响应曲面图Fig.3 Response surface plot of the effects of pH and temperature on the enzyme activity
为了验证模型的准确性,同时考虑到实际操作的可能性,将最佳发酵条件的参数进行取整,即胶体几丁质9.0g/L、蛋白胨2g/L、转速为130r/min、接种量2%、发酵温度20℃、pH6.0、发酵时间96h,进行3次摇瓶发酵实验,所得几丁质酶的平均酶活为57.95U/mL。优化前各参数分别为:胶体几丁质10.0g/L、蛋白胨5g/L、转速为160r/min、接种量2%、发酵温度15℃、pH自然、发酵时间48h,酶活为46.82U/mL,相比优化前采用响应面优化后酶活为57.95U/mL,提高了23.77%。可见该模型能够较好地预测实际发酵情况。
3 结论
在交替假单胞菌产几丁质酶摇瓶发酵过程中,胶体几丁质、发酵温度和pH是重要因素。根据Box-Behnken设计原理,经过响应面优化的培养条件为胶体几丁质8.95g/L,发酵温度20℃,pH6.18。根据响应面结果最大酶活并结合实验的实际情况,确定最优发酵条件为:胶体几丁质9.0g/L、蛋白胨2g/L、转速为130r/min、接种量2%、发酵温度20℃、pH6.0、发酵时间96h。在该优化发酵条件下,酶活力达57.95U/mL,较初始发酵条件(酶活46.82U/mL)提高了23.77%。
[1]Souza CP,Almeida BC,Colwell RR,et al.The importance of chitin in the marine environment[J].Mar Biotechnol,2011,13(5):823-830.
[2]AL Svitil,S Chadhain,JA Moore,et al.Chitin Degradation Proteins Produced by the Marine Bacterium Vibrio harveyi GrowingonDifferentFormsofChitin[J].Applied and Environmental Microbiology,1997,63(2):408-413.
[3]王海东,陈飚,伦镜盛,等.产几丁质酶菌株SWCH-6的筛选、鉴定及其产酶条件的优化研究[J].微生物学通报,2008,35(5):705-711.
[4]Bhattacharya D,A Nagpure,RK Gupta.Bacterial Chitinases:Properties and Potential[J].Critical Reviews in Biotechnology,2007,27(1):21-28.
[5]T Ohno,S Armand,T Hata,et al.A modular family 19 chitinase found in the prokaryotic organism Streptomyces griseus HUT 6037[J].Journal of Bacteriology,1996,178(17):5065-5070.
[6]肖湘,周樱,王凤平,等.高效几丁质降解茵CBl01的分离鉴定及其几丁质酶系的研究[J].海洋学报,2003,25(1):138-142.
[7]McCreath KJ,Gooday GW.A rapid and sensitive microassay for determination of chitinolytic activity[J].J Microbiol Methods,1992(14):229-237.
[8]Horn SJ,Sikorski P,Cederkvist JB,et al.Costs and benefits of processivity in enzymatic degradation of recalcitrant polysaccharides[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(48):18089-18094.
[9]Vincent GH Eijsink,Gustav Vaaje-Kolstad,Kjell M Vårum,et al.Towards new enzymes for biofuels:lessons from chitinase research[J].Trends Biotechnol,2008,26(5):228-235.
[10]Tsujibo H,Orikoshi H,Shiotani K,et al.Characterization of chitinase C from a marine bacterium,Alteromonas sp.strain O-7,and its corresponding gene and domain structure[J].Appl Environ Microbiol,1998,64(2):472-478.
[11]Hideyuki Orikoshi,Nao Baba,Shigenari Nakayama,et al. Molecular analysis of the gene encoding a novel cold-adapted chitinase(ChiB)from a marine bacterium,Alteromonas sp.strain O-7[J].J Bacteriol,2003,185(4):1153-1160.
[12]HideyukiOrikoshi,ShigenariNakayama, Katsushiro Miyamoto,et al.Roles of four chitinases(chia,chib,chic,and chid)in the chitin degradation system of marine bacterium Alteromonas sp.strain O-7[J].Appl Environ Microbiol,2005,71(4):1811-1185.
[13]Xie B B,Shu YL,Qin QL.Genome Sequences of Type Strains of Seven Species of the Marine Bacterium Pseudoalteromonas[J]. Journal of Bacteriology,2012,194(10):2746-2747.
[14]SC Hsu,JK Lockwood.Powdered chitin agar as a selective medium for enumeration of actinomycetes in water and soil[J]. Appl Microbiol,1975,29(3):422-466.
[15]Imoto T,Yagisshita K.A simple activity measurement of lysozyme[J].Agric Biol Chem,1971,35(7):1154-1156.
[16]Miller A,Sittter RR.Using the folded-over 12-run plackettburman design to consider interactions[J].Technometrics,2001(3):44-54.
[17]Ambat P,Ayyanna C.Optimizing medium constituents and fermentation conditionsforcitric production from palmyra jaggery using response surface methods[J].World Journal of Microbiology and Biotechnology,2001(17):331-335.
[18]Ratnam BVV,Narasimha RM,Dmodar RM,et al.Optimization of fermentation conditions for the production of ethanol fromsago starch using response surface methodology[J].World Journal of Microbiology and Biotechnology,2003,19(5):523-526.
[19]孟彦羽,岳敏,张建平,等.海南土地杆菌Pedobacter hainanensis 13-Q发酵生产κ-卡拉胶酶的条件优化[J].中国酿造,2013(7):20-23.
Optimization of fermentation conditions for chitinase production by the Pseudoalteromonas sp.DL-6 using the response surface methodology
WANG Xiao-hui1,2,3,YUE Min2,3
(1.School of Life Science and Biotechnology,Dalian University,Dalian 116622,China;2.Dalian Institute of Chemical Physics,Chinese Academy of Sciences,Dalian 116023,China;3.University of Chinese Academy of Sciences,Beijing 100049,China)
Response surface methodology was used to optimize the fermentation conditions of chitinase by Pseudoalteromonas sp.DL-6.Firstly,the important factors influencing chitinase production were identified by the method of Plackett-Burman as colloidal chitin,fermentation temperature,and pH.The path of steepest ascent was applied to approach the optimal region of the three significant factors.Box-Behnken design and response surface analysis were used to further investigate the optimal central levels and relationships of these factors.By using the quadratic regression model equation and analyzing the response surface of chitinase production,the optimal fermentation conditions were determined as followed:colloidal chitin 8.95g/L,peptone 2g/L,shaking speed 130r/min,inoculums dose 2%,fermentation temperature 20℃,and pH 6.18,respectively. Under these conditons,the maximumtheoretic activity of chitinase was 57.95U/mL.After three verifications,the maximum theoretic value was consistent with mean value of verification test and the chitinase production was increased by 23.77%comparing to that before optimization.
Pseudoalteromonas;chitinase;fermentation;response surface analysis
TS201.3
B
1002-0306(2014)12-0312-05
10.13386/j.issn1002-0306.2014.12.060
2014-02-20
王晓辉(1981-),女,在职博士,讲师,研究方向:微生物与酶工程。
国家高技术研究发展计划(863计划)项目(2007AA021306)。
