amiRNA技术及其在食用作物遗传改良中的应用
2014-02-28刘迪秋陈朝银昆明理工大学生命科学与技术学院云南昆明650500
杨 延,刘迪秋,葛 锋,陈朝银(昆明理工大学生命科学与技术学院,云南昆明650500)
amiRNA技术及其在食用作物遗传改良中的应用
杨延,刘迪秋,葛锋*,陈朝银
(昆明理工大学生命科学与技术学院,云南昆明650500)
内源miRNAs(microRNAs)是负调控真核生物基因表达的关键因子。amiRNAs(artificial microRNAs)是模拟内源miRNA的生成途径人工合成的miRNA,它能高效抑制靶基因的表达。运用amiRNA技术调控基因表达在调控精确性、效率、遗传稳定性及生物安全性等多方面具有显著优势。本文就amiRNA技术的原理、优势以及该技术在食用作物品质改良及营养改善、雄性不育系培育、抗病毒和抗逆作物培育中的应用进行了综述。
amiRNA,食用作物,基因沉默,遗传改良,应用
miRNA是一类由内源非蛋白质编码基因转录加工形成的长约21nt的小分子RNA,主要通过与靶mRNA碱基互配指导靶mRNA的降解或抑制其翻译,从而对基因表达进行转录后负调控[1]。近年来,随着对内源miRNA的合成及沉默机制研究的不断深入,催生了以amiRNA为基础的基因沉默技术。amiRNA可模拟内源miRNA的作用机制人为沉默目的基因,对比传统的基因沉默技术,amiRNA在调控精确性、调控效率、遗传稳定性及生物安全性等多方面具有显著优势。运用amiRNA技术调节食用作物中控制重要性状基因的表达,可有效提高作物的营养价值,降低作物中有害成分的含量,或使作物获得特有品质性状,因此在食用作物遗传改良方面具有巨大应用潜力。本文主要对amiRNA技术及其在食用作物遗传改良中的应用进行了较为全面的综述。
1 amiRNA技术的原理
amiRNA技术是通过模拟内源miRNA的生成及作用机制而人为地沉默目的基因。植物内源miRNA的生成过程主要包括以下步骤:a.细胞核内的miRNA基因首先由RNA聚合酶II作用转录形成具有茎环二级结构的pri-miRNA[2];b.pri-miRNA经DCL1(Dicerlike1)酶剪切形成较短的pre-miRNA[3];c.pre-miRNA再经DCL1酶剪切形成长约21nt的双链miRNA:miRNA*[4];d.双链的3’端在HEN1甲基转移酶作用下发生甲基化[5];e.经甲基化修饰后的双链被运送至细胞质,最后经解旋酶催化形成成熟单链miRNA,其互补链则通常被降解[6]。成熟的miRNA与AGO蛋白结合形成RISC(RNA-induced silencing complex),大部分的植物miRNA与靶mRNA以完全互补的方式结合,并诱导RISC对mRNA的特定位点进行切割使其降解,最终实现对基因表达进行转录后负调控[1]。amiRNA技术以内源pre-miRNA为骨架,通过将pre-miRNA序列中的miRNA:miRNA*替换成人工设计的amiRNA:amiRNA*,形成pre-amiRNA,同时保持其茎环二级结构及能量特征基本不变,然后在生物体内按照内源miRNA的合成途径形成人工miRNA[7-8]。
pre-amiRNA结构可通过分别带有amiRNA、miRNA前体环及amiRNA*序列的a、b、c片段经重叠PCR延伸获得。a、b、c片段可分别由A-IV、II-III、I-B3对引物扩增获得(图1)。扩增a、b、c片段的前3轮PCR及最后一轮重叠PCR所需的模板及引物参见表1。
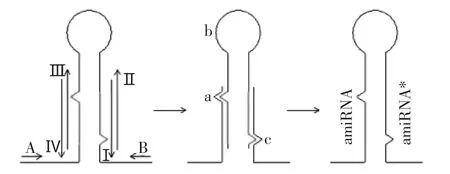
图1 重叠PCR法合成pre-amiRNA示意图Fig.1 Construction of pre-amiRNA gene by overlapping PCR
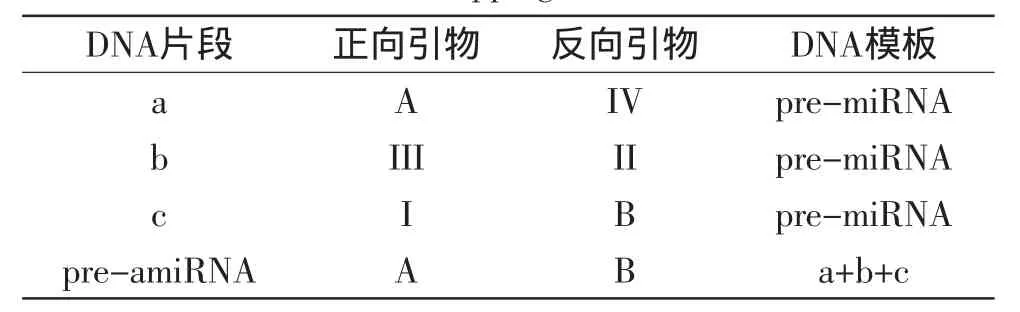
表1 重叠PCR法合成pre-amiRNA所需引物及模板Table 1 The sequences of primers and templates used in overlapping PCR
2 amiRNA技术的优势
2.1简便性
WMD3设计平台为amiRNA技术带来了极大便利,利用该平台可实现植物amiRNA序列的自动化设计[9]。此外,WMD3设计平台还提供了多个包含植物内源miRNA前体序列的载体,如pRS300、pNW55、pChamiRNA1和pChamiRNA2[10-11]。根据最终选定的amiRNA,WMD3能自动设计出I-IV4条引物。amiRNA技术利用这4条及另外一对根据载体中内源miRNA两侧的核苷酸序列而设计的A、B引物并以载体序列为模板,经4轮PCR反应即可合成pre-amiRNA。之后经一次酶切连接将pre-amiRNA组装到合适的植物表达载体上即完成amiRNA干扰载体的构建,减少了传统RNAi载体构建时目的基因序列的克隆及多次酶切连接步骤,缩短了实验周期,提高了实验的准确性。
然而多步PCR反应增加了碱基突变的概率,并且过程费力,不适用于批量操作。为了弥补此缺陷,Liang等[12]成功构建了两个人工miRNA载体:pAMIR395a和pAMIR319a,这两个载体包含了内源miRNA前体的5’和3’区域。研究者只需设计一对引物通过一次PCR反应就可获得相应的amiRNA发夹区,然后经酶切将其克隆到相应的表达载体上,最终产生所需amiRNA前体。Yan等[13]也构建了一个植物通用amiRNA载体:pUAs,同样也只需一对引物一次PCR反应就能获得相应amiRNA。
2.2高特异性及高干扰效率
传统的RNAi技术往往会引起脱靶效应,造成精确性较差[14],amiRNA技术弥补了传统RNAi技术的这一缺陷。莱茵依藻(Chlamydomonas reinhardtii)中的HydA1和HydA2基因编码序列同源性为69%,针对这两个基因设计的amiRNA能精确识别并干扰各自的靶标[15];BAHD1和BAHD2基因是水稻(Oryza sativa L.)中的两个同源基因,针对BADH2基因构建带有Ubi组成型表达启动子的amiRNA干扰载体,经转化后发现T1代水稻胚乳中BADH2基因的表达量下降了约80%,而BADH1基因的表达量则无显著变化[16]。这些研究表明,amiRNA的沉默效应具有较高特异性。amiRNA之所以具有较高的沉默特异性是因为amiRNA同内源miRNA一样与靶mRNA之间遵循严格碱基配对原则,错配碱基数超过3个就无法识别,并且在amiRNA序列的2~12位不能存在错配[17],因此amiRNA对靶mRNA序列具有高度特异性,可实现对基因家族或等位基因中单个特异靶标的精确干扰。此外,在运用amiRNA技术时,可针对同一靶基因设计多条amiRNA,而每一条pre-amiRNA序列最终只能产生一个成熟amiRNA,因此无论发生靶基因沉默还是脱靶效应,都能确定是由该amiRNA引起的,在设计amiRNA序列时,选择与靶mRNA序列特异性高的amiRNA序列,而避免选择可能导致脱靶效应的序列,可大大减少实验的盲目性,提高实验的精确性。
amiRNA技术在干扰效率方面也比传统RNAi技术具有优势。研究者针对拟南芥(Arabidopsis thaliana)的At2g19070基因分别构建了RNAi和amiRNA干扰载体,转化后获得的RNAi转化株中靶基因被强烈抑制的转化子只占5%~10%,而所有amiRNA转化株的靶基因抑制率都在90%以上[18-19]。另外,也有研究者分别构建了hpRNA(hairpin RNA)和amiRNA干扰载体抑制水稻SBEIIb基因的表达,结果显示ami-SBEIIb转化株中SBEIIb基因的表达量较对照组下降了5倍,而hp-SBEIIb转化株中靶基因表达量只下降了2倍[20]。这表明利用amiRNA技术只需要获得少数转化株就能有足够多的高抑制株系,将该技术运用于实际生产可大大减少工作量,降低成本。
2.3灵活性
由于amiRNA靶向的序列长度仅为21nt,对于一个长度为几百甚至上千碱基对的基因而言可提供的靶作用位点有很多,amiRNA技术可针对同一基因的不同靶位点设计多个amiRNA干扰载体,以此增强基因的沉默效率。amiRNA技术也可针对多个相关或不相关基因灵活构建多个amiRNA串联的表达载体,实现多基因同时沉默,在设计amiRNA序列时引入一定数量的错配可同时干涉多个同源基因[12]。
通过体外构建传统RNAi表达载体而在植物体内生成siRNA(small interference RNA)的策略,虽然可以有效沉默目的基因,但这些siRNA能通过植物大分子运输系统扩散到其他组织,因此可能对正常植物组织和器官造成损伤。amiRNA技术可灵活选用诱导型或组织特异型启动子,从而使amiRNA在特定时期表达或将其沉默效应局限于特定的组织中,最终实现对基因的表达进行时空调控。另外,通过更换强或弱启动子则可以调控amiRNA对靶基因的抑制程度[8]。
2.4遗传稳定性
植物遗传改良的基本要求之一就是后代必须具有良好的遗传稳定性。研究表明,多数转入受体植物的amiRNA能在子代植株中稳定遗传并表达。Khraiwesh等[21]针对小立碗藓(Physcomitrella patens)PpFtsZ2-1基因构建了amiRNA干扰载体,经转化后在转基因植株中发现PpFtsZ2-1基因的表达量显著降低,并表现出缺失突变体表型,继续将这些转基因植株继代培养一年,结果显示所有的植株仍保持缺失突变体表型。Vu等[22]利用amiRNA提高番茄(Solanum lycopersicumL.)对番茄曲叶病毒(ToLCV)的抗性,研究结果显示80%的转基因T2代对ToLCV具有抗性。Belide等[23]构建了三个分别靶向拟南芥种子中FAD2、FAE1和FATB基因的amiRNA载体,结果显示各转化株均表现出靶基因缺失的突变体表型且该表型能稳定遗传超过三代。目前推测amiRNA之所以具有较强的遗传稳定性是因为它是利用植物体自身的miRNA加工体系获得的,与内源miRNA在结构上具有高度相似性,因此能用接近于内源miRNA抑制靶基因表达的机制来稳定地沉默靶基因。amiRNA技术的这一显著特征为该技术进一步运用于改良重要经济作物的遗传性状奠定了基础。
2.5较高的生物安全性
与其他的基因沉默策略相比,amiRNA技术更具有生物安全性。普通基因沉默载体中外源插入片段的长度通常在几百个碱基以上,较长的插入片段不仅增加了载体构建的难度,同时插入片段容易与内源基因及入侵植物体内的病毒基因组发生同源重组,存在潜在的风险和威胁。amiRNA长度仅为21bp,与内源基因及病毒基因组发生重组的风险很低,生物安全性较高[24]。
3 amiRNA技术在食用作物遗传改良中的应用
3.1在食用作物品质改良及营养改善中的应用
直链淀粉含量较高的淀粉具有凝固迅速、可降解等优点,被广泛应用于饮料的快速凝固剂,生产可降解快餐盒等食品工业中,此外,直链淀粉还具有降低胆固醇及预防胆结石形成的功效[25]。然而普通水稻中直链淀粉含量较低,籼稻中的含量一般为20%~ 30%,粳稻中为15%~22%。水稻中直链淀粉的含量主要受SBEI、SBEIIa和SBEIIb三种淀粉分支酶的影响,其中SBEIIb的影响最显著[26]。研究表明amiRNA干扰载体能有效地抑制SBEIIb基因的表达(下降5倍),进而提高直链淀粉的含量(41.2%)[20]。
菜籽油是世界第三大食用油,油菜(Brassica campestrisL.)品质改良的重要内容是提高油酸以及降低芥酸含量。研究表明,与油菜同属十字花科芸苔属的拟南芥,其基因组与油菜基因组具有高度同源性,从比较基因组学出发,来源于拟南芥的基因一般可以直接用于油菜中。如针对拟南芥中合成油酸和芥酸的基因(FAD2和FAE1)分别构造amiRNA干扰载体后转化到油菜中,结果显示油菜中油酸的平均含量从15%提升到了63.3%,二十碳烯酸的含量从15.4%下降至1.9%[23]。这一结果为培育高油酸低芥酸油菜品种提供了重要参考。
棉花(Gossypium hirsutumL.)种子中的FAD2-1是催化油酸脱氢形成不饱和脂肪酸的关键酶,Zhao等[27]成功构建了FAD2-1基因的amiRNA干扰载体,为培育油酸含量高的棉花品种奠定了基础。
乳糜泻是指由于人体对麸质不耐受而引起的一种吸收不良综合症,属于人体的一种自身免疫反应。引起乳糜泻的主要抗原是小麦(Triticum aestivumL.)胚乳中的低分子量麦谷蛋白。在小麦胚乳的发育期,5-甲基胞嘧啶DNA糖基化酶(DEMETER)对低分子量麦谷蛋白编码基因进行去甲基化作用,使其被激活并转录形成低分子量麦谷蛋白。由此构建一个由胚乳特异启动子启动的amiRNA干扰载体来抑制DEMETER基因的表达能阻断低分子量麦谷蛋白的合成,改良小麦的蛋白质组分[24]。
稻米的香气主要受Badh2基因控制,该基因通过编码蛋白酶来抑制稻米香气的主要成分2-乙酰-1-吡咯啉(2-acely-1-pyrrolin,2AP)的合成,以此调控稻米香味[28]。研究者针对Badh2基因构建了两个分别带有Ubi组成型表达启动子和GluC胚乳特异型表达启动子的amiRNA干扰载体,转化明恢86和日本晴两种非香稻品种,经鉴定确认T1代GluC∶BADH2amiRNA转化株中BADH2基因的表达量并无显著下降,同时检测不到2AP,可能的原因是GluC启动子的启动活性较低,导致amiRNA的转录水平不足。相反,T1代Ubi∶BADH2amiRNA转化株中BADH2基因的表达量较对照组下降了约80%,2AP含量显著上升,获得了具有更多香气物质的转基因香稻[16]。
3.2在雄性不育系培育中的应用
雄性不育系的培育是杂交育种的前提,可利用amiRNA技术控制作物花粉发育,该方法的优势在于不仅能培育出具有遗传稳定性的雄性不育系,而且还能解决转基因作物在生长过程中因传粉而引起的基因漂移问题,同时缩短了育种时间。Toppino等[29]研究表明含有由花药特异启动子PTA29和PNTM1驱动的amiRNA干扰载体的茄子(Solanum melongenaL.)经自然授粉后其结实率都明显低于野生株。此外,T1代雄性不育性较强的转化株花药中TAF基因的表达量均低于野生株,说明此不育性能被稳定遗传,而获得的雄性不育茄子经乙醇处理后其不育性可恢复。
目前生产上使用的水稻雄性不育系普遍存在包穗现象,制约了水稻杂交制种产业的发展,当前解决这一问题的办法主要是喷洒赤霉素,不仅增加了制种生产成本,降低了种子质量,还造成环境污染。eui1基因是一个控制稻穗节间伸长的隐性基因,利用amiRNA技术,将amiRNA-eui1表达载体转化到ZS97B系中,再将其T1代与ZS97A系杂交,使amiRNA-eui1引入ZS97A系,结果表明成功转入amiRNA-eui1的teZS97A转基因系其稻穗节间伸长量明显高于对照组,解除了不育系包穗现象[30]。
3.3在抗病毒育种中的应用
目前,amiRNA技术已被成功应用于小麦、马铃薯(Solanum tuberosumL.)、葡萄(Vitis L.)、番茄、水稻等多种食用作物的抗病毒品种培育研究中(见表2)。

表2 amiRNA介导的沉默策略在食用作物抗病性研究中的应用Table 2 Applications using silencing strategy mediated by amiRNA in virus defense studies of alimentary crops
amiRNA载体可模拟内源miRNA表达簇结构,针对同一病毒基因的不同区段设计多个amiRNA并使之串联表达,能有效增强转amiRNA作物对靶病毒的抗性[31]。在实际生产中,作物常常遭遇多种病毒联合侵染,并且病毒株系多,变异快,传统的RNAi干扰技术只能使作物抵抗部分病毒株系,无法培育获得具有持久广谱病毒抗性的作物。amiRNA与靶mRNA之间允许存在一定数量的错配碱基,针对病毒基因组保守区设计amiRNA,能使转基因作物有效抵抗大多数病毒株系,并且即使病毒基因发生了突变也依然保持对该病毒的抗性,这既延长了作物的寿命,同时还能有效防止因病毒变异的积累而产生的新病毒株[34]。此外,有报道显示,siRNA介导的抗病毒策略不适用于低温作物,在低温条件下,siRNA介导的病毒抗性将会被打破,而amiRNA策略即使在低温条件仍能使作物保持对病毒具有高效抗性[36]。
3.4在抗逆食用作物培育中的应用
逆境胁迫严重威胁着世界范围内的作物产量提升,研究发现一些miRNA在作物应对逆境胁迫应答过程中发挥了重要作用。在逆境胁迫条件下,这些miRNA能够快速表达并作用于与逆境胁迫应答相关的基因,随后启动作物的抗逆信号系统,提高作物对不良环境的抵抗能力[37-39]。通过构建miRNA表达载体,并在作物中表达参与抗逆胁迫应答相关的miRNA,是增强作物对逆境胁迫抗性的有效途径[40-42]。构建普通miRNA表达载体时通常需克隆pri-miRNA编码基因,但一些pri-miRNA编码基因含有限制性内切酶位点或无法确定其准确的染色体定位而影响miRNA表达载体的构建,amiRNA技术避开了pri-miRNA前体编码基因的直接克隆步骤,弥补了普通miRNA表达载体构建存在的缺陷[43]。ABA(Abscisic acid)可促进作物叶片气孔关闭,从而降低水分蒸腾量,因此对作物起抗旱作用。CBP80(Cap-binding protein)会干扰ABA信号转导过程,使作物对干旱胁迫耐性较差。Pieczynski等[44]针对CBP80基因构建了CBP80-amiRNA表达载体,结果显示,表达了CBP80-amiRNA的转基因马铃薯对干旱具有较强的抗性。这表明运用amiRNA技术培育抗逆转基因食用作物的策略是切实可行的。
4 展望
近年来虽然有研究证明amiRNA能有效抑制植物基因的表达,但该技术在实际应用中也存在一些问题。例如,影响amiRNA沉默效率的因素除了amiRNA序列之外,还受内源miRNA前体骨架序列及其他小分子协同作用的影响;对内源miRNA前体加工为成熟miRNA这一过程缺乏具体认识,这些因素使得amiRNA的沉默效果暂时还无法实现完全地人为控制。但amiRNA技术有其特有的优势:amiRNA技术避免了传统RNAi技术的脱靶及非特异性效应等问题,同时该技术还具有方便、快捷、高通量筛查基因等优点,它的应用必将加快小麦、玉米等重要多倍体食用作物的基因,特别是控制食用作物重要经济性状的基因的功能研究进程;此外,amiRNA技术在改变代谢途径中的某一特定阶段及抵抗多种病毒入侵方面也十分有效[45]。我们课题组前期已经完成了三七皂苷生物合成途径中的关键酶基因-CAS基因的RNAi干扰,成功弱化了植物甾醇合成的副产物支流,但基因沉默的效率还有待提高,目前正在从事amiRNA技术在三七这一药、食两用作物的皂苷合成代谢调控研究。
[1]Kruszka K,Pieczynski M,Windels D,et al.Role of microRNAs and other sRNAs of plants in their changing environments[J]. Journal of Plant Physiology,2012,169(16):1664-1672.
[2]Lee Y,Kim M,Han J,et al.MicroRNA genes are transcribed by RNA polymerase II[J].The EMBO Journal,2004,23(20):4051-4060.
[3]Kurihara Y,Watanabe Y.Arabidopsis micro-RNA biogenesis through Dicer-like 1 protein functions[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(34):12753-12758.
[4]Hofmann N R.MicroRNA evolution in the genus Arabidopsis [J].The Plant Cell,2010,22(4):994.
[5]Hammond S M,Bernstein E,Beach D,et al.An RNA-directed nuclease mediates post-transcriptional gene silencing in Drosophila cells[J].Nature,2000,404:293-296.
[6]Park M Y,Wu G,Gonzalez-sulser A,et al.Nuclear processing and export of microRNAs in Arabidopsis[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(10):3691-3696.
[7]Perez-quintero A L,Lopez C.Artificial microRNAs and their applications in plant molecular biology[J].Agronomia Colombiana,2010,28(3):373-381.
[8]Schwab R,Ossowski S,Riester M,et al.Highly specific genesilencing by artificial microRNAs in Arabidopsis[J].The Plant Cell,2006,18(5):1121-1133.
[9]叶梅霞,崔东青,李昊,等.amiRNA分子设计及其离体合成策略[J].中国生物工程杂志,2010,30(9):92-97.
[10]Schwarb R,Ossowski S,Warthmann N,et al.Directed gene silencing with artificial microRNAs[J].Methods in Molecular Biology,2010,592:71-88.
[11]Molnar A,Bassett A,Thuenemann E,et al.Highly specific gene silencing by artificial microRNAs in the unicellular alga Chlamydomonas reinhardtii[J].The Plant Journal,2009,58(1):165-174.
[12]Liang G,He H,Li Y,et al.A new strategy for construction of artificial miRNA vectors in Arabidopsis[J].Planta,2012,235(6):1421-1429.
[13]Yan F,Lu Y W,Wu G T,et al.A simplified method for constructing artificial microRNAs based on the osa-MIR528 precursor[J].Journal of Biotechnology,2012,160(3-4):146-150.
[14]Fedorov Y,Anderson E M,Birmingham A,et al.Off-target effects by siRNA can induce toxic phenotype[J].RNA,2006,12(7):1188-1196.
[15]Godman J E,Molnar A,Baulcombe D C,et al.RNA silencing of hydrogenase(-like)genes and investigation of their physiological roles in the green alga Chlamydomonas reinhardtii [J].Biochemical Journal,2010,431(3):345-351.
[16]Chen M L,Wei X J,Shao G N,et al.Fragrance of the rice grain achieved via artificial microRNA-induced down-regulation of OsBADH2[J].Plant Breeding,2012,131(5):584-590.
[17]Schwarb R,Palatnik J F,Riester M,et al.Specific effects of microRNAs on the plant transcriptome[J].Developmental Cell,2005,8(4):517-527.
[18]Grienenberger E,Besseau S,Geoffroy P,et al.A BAHD acyltransferase is expressed in the tapetum of Arabidopsis anthers and is involved in the synthesis of hydroxycinnamoyl spermidines[J].The Plant Journal,2009,58(2):246-259.
[19]李振波,王琢玉,刘学群,等.甘蓝型油菜Bn19070的表达与同源基因At2g19070的amiRNAi研究[J].中国油料作物学报,2011,33(3):197-201.
[20]Butardo V M,Fitzgerald M A,Bird A R,et al.Impact of down-regulation of starch branching enzyme IIb in rice by artificial microRNA-and hairpin RNA-mediated RNA silencing [J].Journal of Experimental Botany,2011,62(14):4927-4941.
[21]Khraiwesh B,Ossowski S,Weigel D,et al.Specific gene silencing by artificial MicroRNAs in Physcomitrella patens:an alternative to targeted gene knockouts[J].Plant Physiology,2008,148(2):684-693.
[22]Vu T V,Choudhury N R,Mukherjee S K.Transgenic tomato plants expressing artificial microRNAs for silencing the pre-coat and coat proteins of a begomovirus,Tomato leaf curl New Delhi virus,show tolerance to virus infection[J].Virus Research,2013,172(1-2):35-45.
[23]Belide S,Petrie J R,Shrestha P,et al.Modification of seed oil composition in Arabidopsis by artificial microRNA-mediated gene silencing[J].Frontiers in Plant Science,2012,3:1-6.
[24]Sablok G,Perez-quintero A L,Hassan M,et al.Artificial microRNAs(amiRNAs)engineering on how microRNA-based silencing methods have affected current plant silencing research [J].Biochemical and Biophysical Research Communications,2011,406(3):315-319.
[25]张文青.抗性淀粉—功能性食物成分[J].国外医学卫生学分册,2005,32(4):232-235.
[26]James M G,Denyer K,Myers A M.Starch synthesis in the cereal endosperm[J].Current Opinion in Plant Biology,2003,6(3):215-222.
[27]Zhao L Q,Li H L,Li R,et al.Cloning of cotton Delta-12 Oleate Desaturase gene FAD2-1 and construction of its ihpRNA andamiRNAinterferevectors[J].AgriculturalScience& Technology,2012,13(11):2281-2283,2286.
[28]Chen S H,Yang Y,Shi WW,et al.Badh2,encoding betaine aldehyde dehydrogenase,inhibits the biosynthesis of 2-acetyl-1-pyrroline,a major component in rice fragrance[J].The Plant Cell,2008,20(7):1850-1861.
[29]Toppino L,Kooiker M,Lindner M,et al.Reversible male sterility in eggplant(Solanum melongena L.) by artificial microRNA-mediated silencing of general transcription factor genes[J].Plant Biotechnology Journal,2011,9(6):684-692.
[30]Chen H,Jiang S,Zhang J,et al.Improving panicle exsertion of rice cytoplasmic male sterile line by combination of artificial microRNA and artificial target mimic[J].Plant Biotechnology Journal,2013,11(3):336-343.
[31]Kung Y J,Lin S S,Huang Y L,et al.Multiple artificial microRNAs targeting conserved motifs of the replicase gene confer robust transgenic resistance to negative-sense singlestranded RNA plant virus[J].Molecular Plant Pathology,2012,13(3):303-317.
[32]Ai T,Zhang L,Gao Z,et al.Highly efficient virus resistance mediated by artificial microRNAs that target the suppressor of PVX and PVY in plants[J].Plant Biology,2011,13(2):304-316. [33]Jelly N S,Schellenbaum P,Walter B,et al.Transient expression of artificial microRNAs targeting Grapevine fanleaf virus and evidence for RNA silencing in grapevine somatic embryos[J].Transgenic Research,2012,21(6):1319-1327.
[34]Zhang X H,Li H X,Zhang J H,et al.Expression of artificial microRNAs in tomato confers efficient and stable virus resistance in a cell-autonomous manner[J].Transgenic Research,2011,20(3):569-581.
[35]高鹏.针对水稻条纹病毒的人工miRNA设计与应用[D].金华:浙江师范大学,2010.
[36]Niu Q W,Lin S S,Reyes K C,et al.Expression of artificial microRNAs in transgenic Arabidopsis thaliana confers virus resistance[J].Nature,2006,24(11):1420-1428.
[37]Hwang E W,Shin S J,Yu B K,et al.miR171 family members are involved in drought response in Solanum tuberosum [J].Journal of Plant Biology,2011,54(1):43-48.
[38]Kantar M,Lucus S J,Budak H.miRNA expression patterns of Triticum dicoccoides in response to shock drought stress[J]. Planta,2011,233(3):471-484.
[39]Paul S,Kundu A,Pal A.Identification and validation ofconserved microRNAs along with their differential expression in roots of Vigna unguiculata grown under salt stress[J].Plant Cell Tiss Organ Cult,2011,105(2):233-242.
[40]Eamens A L,Agius C,Smith N A,et al.Efficient silencing ofendogenousmicroRNAsusingartificialmicroRNAsin Arabidopsis thaliana[J].Molecular Plant,2011,4(1):157-170.
[41]Chen Y,Chen Z L,Kang J Q,et al.AtMYB14 Regulates ColdToleranceinArabidopsis[J].PlantMolecularBiology Reporter,2013,31(1):87-97.
[42]Wang F L,Liu R H,Wu G T,et al.Specific Downregulation of the Bacterial-Type PEPC Gene by Artificial MicroRNA Improves Salt Tolerance in Arabidopsis[J].Plant Molecular Biology Reporter,2012,30(5):1080-1087.
[43]王云,左进云,鞠正,等.番茄microRNA基因沉默载体的构建方法[J].北方园艺,2012(3):101-104.
[44]Pieczynski M,Marczewski W,Henning J,et al.Downregulation of CBP80 gene expression as a strategy to engineer a drought-tolerant potato[J].Plant Biotechnology Journal,2013,11(4):459-469.
[45]Burgess S J,Tredwell G,Molnar A,et al.Artificial microRNA-mediated knockdown of pyruvate formate lyase(]PFL1)provides evidence for an active 3-hydroxybutyrate production pathway in the green alga Chlamydomonas reinhardtii[J].Journal of Biotechnology,2012,162(1):57-66.
amiRNA technology and its applications in alimentary crop genetic improvement
YANG Yan,LIU Di-qiu,GE Feng*,CHEN Chao-yin
(Faculty of Life Science and Technology,Kunming University of Science and Technology,Kunming 650500,China)
Endogenous miRNAs(microRNAs)are key factors which negatively regulate gene expression in eukaryotes.amiRNAs(artificial miRNAs)are the artificial miRNAs which are synthesized by simulating the synthesis pathway of endogenous miRNAs.amiRNAs can effectively inhibit the expression of target genes. Application of amiRNA technology in the regulation of gene expression has significant advantages in accuracy,efficiency,genetic stability and biology security.In this review,the principle and advantages of amiRNA technique,and the applications in alimentary crop quality improvement,nutrition improvement,male sterile lines breeding,anti-viral and anti-adversity crop breeding were summarized.
amiRNA;alimentary crop;gene silencing;genetic improvement;application
TS201.1
A
1002-0306(2014)12-0388-06
10.13386/j.issn1002-0306.2014.12.076
2013-12-03*通讯联系人
杨延(1989-),女,硕士研究生,研究方向:药用植物生物技术。
国家自然科学基金资助(31060044,31260070)。
