罗汉果成分及药理研究进展
2014-02-28李晓军杭州艺福堂茶业有限公司研发中心浙江杭州310052
张 维,王 斌,周 丽,龚 佳,韩 坤,李晓军(杭州艺福堂茶业有限公司研发中心,浙江杭州310052)
罗汉果成分及药理研究进展
张 维,王 斌*,周 丽,龚 佳,韩 坤,李晓军
(杭州艺福堂茶业有限公司研发中心,浙江杭州310052)
罗汉果是中国特有的葫芦科藤本植物的果实,是一种传统的中药配料。现代研究表明,罗汉果中含有罗汉果苷、黄酮和油脂等具备生物活性的化合物。文章综述了近年来对罗汉果化学成分的分析鉴定,罗汉果药理研究以及罗汉果产品的应用,为罗汉果的全面开发,尤其是作为制药原料的研究提供参考。
罗汉果,罗汉果苷V,糖尿病,清除自由基
罗汉果为葫芦科多年生宿根性藤本植物罗汉果(Siraitia grosvenoriiSwingle)的果实,属于中国特有的经济和药用植物。中国有着利用植物治疗疾病的悠久历史,中医上认为罗汉果能够提神生津、清热润肺、祛火止咳、滑肠通便等效用[1],罗汉果在东南亚和西方国家有着“东方神国”和“长寿之果”的美誉[2]。罗汉果苷类、黄酮类、脂肪酸等都在罗汉果中被发现,其中罗汉果苷为罗汉果中被研究最多的化合物,罗汉果或其提取物所表现的抗疲劳、消炎、抗癌、降脂减肥[3]等生理功效均与罗汉果中化学成分及其机体内的代谢和作用方式有着密切的关系。近年来,随着化学分析技术的发展,罗汉果中一些新的化合物被鉴定出来;而罗汉果中化学成分对一些菌类生长的抑制作用与消炎和免疫力的提高有着重要关系;抗氧化作用则与抵抗疲劳,抗癌密不可分;对糖在机体代谢的调节和胰岛细胞的保护作用,则能够对糖尿病症状产生积极的效果。本文就罗汉果中的化学成分罗汉果苷、黄酮类、油脂类等化合物的研究,罗汉果提取物抗菌和消炎、抑制糖尿病和清除自由基三方面的作用机制,罗汉果在市面产品中的应用进行了综述。
1 化学成分研究
1.1 罗汉果苷类
罗汉果苷是罗汉果独有的、研究最多的化学成分,其中又以罗汉果苷V含量最高。罗汉果苷类中存在着不C=C不饱和键和羟基,是罗汉果苷化学性质的基础。罗汉果苷类有着共同的结构即四环三萜(罗汉果醇mogrol),糖基均为葡萄糖,糖基键合的方式有所不同,其结构式如图1[4]所示。
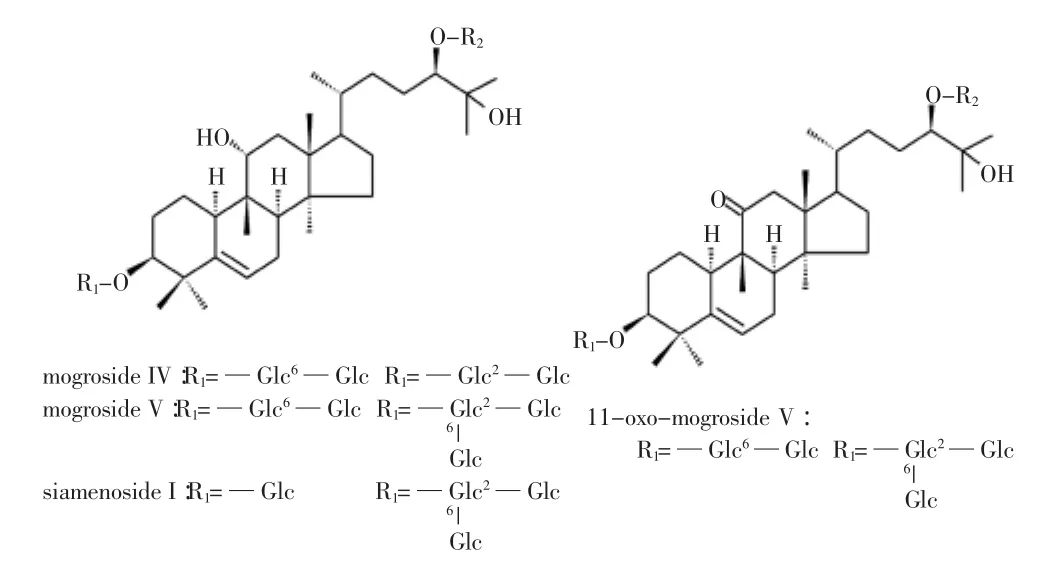
图1 几种罗汉果苷的化学结构Fig.1 Chemical structures of several mogrosides
罗汉果因为长期作为配方药,其有效成分一直未引起重视。罗汉果苷为罗汉果中的独有成分,也是对罗汉果化学成分中最先被研究和利用的成分,1974年,Lee报道了罗汉果中含有二萜天味苷的成分。1983年日本人竹本首次采用光谱和化学分析法鉴定了罗汉果醇及其甙的结构[5]。先后分离和鉴定的罗汉果苷共有12种之多,分别为罗汉果苷IV(mogroside IV)、罗汉果苷V(mogroside V)、罗汉果苷III(mogroside III)、罗汉果苷II E(mogrosid II E)、罗汉果苷III E(mogroside III E)、罗汉果苷VI(mogroside VI)、罗汉果苷A(mogroside A)、罗汉果新苷(neomogroside)、赛门苷I(siamenside I)、罗汉果二醇苯甲酯(mogroester)、光果木鳖皂苷I(grosmomoside I,III)等[6-7]。罗汉果苷V 11位上的羟基被氧化成为酮,而形成的11-氧化-罗汉果苷V也是罗汉果甜苷存在的重要形式。
随着研究的进一步深入,不断有新的罗汉果皂苷被鉴定出来,如罗汉果苷III A1经1H-NMR和13CNMR鉴定其结构为,鉴定其结构为罗汉果醇-24-O-β-D-吡喃葡萄糖基(1→2)-[β-D-吡喃葡萄糖基(1→6)]-β-D-吡喃葡萄糖苷[8-9],在未成熟的罗汉果中分离鉴定出四环三萜结构11位上羟基被氧化的各种苷元,如11-氧化-罗汉果苷II E,11-氧化-罗汉果苷II E[10]。
罗汉果苷均为葫芦烷型四环三萜类的衍生物,区别在于R1和R2两处所链接的葡萄糖基不同,因此结构上的相似性给定量分析造成了一定的干扰。罗汉果苷分析方法经历了紫外分光光度法、薄层扫描法[11]、高效液相色谱法(HPLC)[12-14]和高效液相-电喷雾质谱联用法[15]的发展,对罗汉果苷的成分分析也更加的准确和精确。高效液相色谱法由于方便、快捷和准确是检测罗汉果苷使用最多的一种检测方法,对普通的几种罗汉果苷的分析方法也较为成熟。常琪等[16]以自制罗汉果总苷为对照品,采用香草醛-高氯酸法首次测量出罗汉果中总三萜皂苷的含量为3.75%~3.85%。罗汉果苷V由于含量较多,是评价罗汉果质量的指标性成分,周兢等[17]采用HPLC法,以乙腈-水体系为流动相进行洗脱,在检测波长210nm测定不同栽培体系中罗汉果苷V和11-氧化罗汉果苷V,含量分别在0.346%~1.267%和0.103%~0.332%之间。卢风来等[18]以乙腈-水体系为流动相进行梯度洗脱,在10min内对罗汉果苷V,罗汉果苷IVA、罗汉果苷III、11-氧化-罗汉果苷III、罗汉果苷IIE和11-氧化-罗汉果苷IIE等6种苷类化合物实现了较好的分离和检测。
核磁共振技术和质谱技术的应用对于鉴定罗汉果中新的罗汉果苷类起到了重要的作用,然而新鉴定的糖苷种类依然具备三萜皂苷的基本结构,存在与罗汉果的不同的生长期[19],其含量少,易被酶所分解转化,提纯较为困难,但也为研究这些化合物的药理打下了基础,高效液相色谱法已经成为检测六种罗汉果苷成熟技术,由此发展的制备色谱已能较好的分离纯度较高的罗汉果苷类单体[7]。
1.2 黄酮类
从现有的研究资料来看,对罗汉果中由于黄酮多以苷元的形式存在,黄酮类的分析和研究尚未引起重视,多为在对罗汉果苷的研究中所发现,其基本单元或主要成分以槲皮素和山奈酚为主,槲皮素和山奈酚具备一些显著的生理功效,如抑菌作用、抗氧化和平滑血管等。斯建勇等[20]对罗汉果鲜果中的成分进行分析,首次分离出了两个黄酮苷:山奈酚-3-O-α-L-鼠李糖-7-O-[β-D-葡萄糖基-(1-2)-α-L-鼠李糖苷]和山奈酚-3,7-α-L-二鼠李糖苷,并将前者命名为罗汉果素(grosvenorine)。陈全斌等[21]将罗汉果鲜果及其甜苷水解发现了黄酮苷元—槲皮素,并以槲皮素和山奈酚为外标采用RP-HPLC测定总黄酮的含量为5~10mg/个,同时水解的甜苷中也发现了黄酮类,约占甜苷总量的1.42%。
罗汉果中黄酮类因为含量不高,新物质的鉴定差异主要体现在槲皮素或山奈酚结构上所结合糖苷不同,结构和成分的鉴定为罗汉果中黄酮类的分离和提纯打下了基础。唐春丽[22]以乙酸乙酯、正丁醇、水为固定相的高速逆流色谱(HSCCC)分离得到纯度为94.6%的黄酮苷KR,并发现其可与Cu形成稳定的络合物具有多种生理功效。以不同浓度的乙醇提取,通过酶解和大孔树脂分离提纯罗汉果黄酮的工艺研究也得到快速的发展[23]。
1.3 油脂类
植物种子中油脂类的含量一般较高,罗汉果也不例外。陈全斌等[24]采用索氏提取、超临界、超声和回流提取等方法提取罗汉果种子中的油脂类,得率在6.40%~11.46%之间,经红外光谱和GC-MS分析鉴定主要为角鲨烯(三十碳六烯,占油含量的51.52%0,[z,z]-9.12-十八碳二烯酸(23.89%),3-羟基-1,6,10,14,18,22-二十四碳六烯(9.58%)。
黎霜等[25]对罗汉果种子油的中发现了丰富的法尼醇(3,7,11-三甲基-2,6,10-十二碳三烯-1-醇,52.14%),常用作高级香水的增稠剂。
罗汉果作为一种食品,营养也相对均衡,尤其以蛋白质和氨基酸、微量元素,糖类较为丰富。其涵盖了人体必需的8种氨基酸[26];26中无机微量元素;大量单糖和多糖,还原糖中以果糖含量居高。
2 药理作用
罗汉果被报道有多种生理活性,如降血糖、降血脂、抗菌消炎、抗癌等,从机理上来说,这些功效归因于罗汉果及其提取物所具备的抗菌、抗糖尿病和清除自由基等三个方面的作用。
2.1 抑菌和消炎
罗汉果由于其独特的化学成分,对龋齿的主要致病菌和口腔细菌体,如链球菌类等都表现出了明显的抑制效果,对入侵人体的细菌也通过对淋巴系统的作用等有着消炎的效果。
穆静等[27]在蔗糖配制的基础培养基上,以添加1∶10的SG提取液为实验组,以添加甜菊糖、葡萄糖、蔗糖、果糖对照组,分别与蔗糖混合配制成基础培养基,并以此培养基培养C型变形链球菌,以比浊度衡量菌的生长速率,通过检测粘度和产酸考察微生物的代谢,结果表明实验组对于C型变形链球菌的生长和代谢比对所有照组均有显著型抑制作用,且SG不易与蔗糖复配为混合甜味剂。
然而Zhou Ying等[28]认为这些研究缺乏科学的生物测定方法和经过纯化的罗汉果提取物,其通过HPLC对SG的提取液进行分离并对不同分离组分的抑菌活性进行高通量筛选,以其对学琼脂培养的变性链球菌(S.mutans),分离片段#18-19和#34-35有着较强的抑菌活性,而罗汉果苷V未表现出较强的抑菌作用,SG中的罗汉果苷I-IV和其他组分的抑菌生物活性还有待进步的研究。
革兰氏阴性菌对机体的入侵,其细胞壁上的脂蛋白(LPS)会诱导iNOS与COX-2的合成,而两者都与炎症的产生有着密切的关系[29-30]。罗汉果苷V含量为25.9%的SG提取物能够通过阻止MAPK信号转导通路的激活而抑制因为外源LPS引起的NFκB异位,从而降低iNOS与COX-2的蛋白质水平[31]。罗汉果苷V对能够通过阻断入侵外源微生物在机体内部主动营养吸收通路,协调免疫系统的功能[32]。由于罗汉果在抑制口腔病菌和通过调节免疫系统防止发炎的表现,使其有潜力成为去除龋齿、清洁口腔和治疗因肿瘤引发的炎症的化学药物的成分。
2.2 抵抗糖尿病
糖尿病是一种常见的多发病,其死亡率仅次于肿瘤和心血管疾病,是威胁人类健康的第三大类疾病,在饮食、运动和药物治疗的三大原则中,饮食治疗是糖尿病治疗的基础措施[33]。罗汉果苷具备三萜皂苷结构,研究表明三萜皂苷具备降血糖作用[34]。另外,罗汉果能够降低血糖和血脂的生理功效亦被报道,罗汉果糖苷中的11-氧化-罗汉果干V能对LDL氧化起到很好的阻碍作用,能够降低因LDL的升高而引起的动脉粥样硬化的风险[35]。
四氧尿嘧啶对胰岛β细胞具有选择性破坏作用,使得小鼠血液中胰岛素水平下降,形成胰岛素依赖性糖尿病[36]。对采用此模型处理的小鼠予以SG提取物灌胃,结果表明一定浓度的SG提取液能使小鼠的血清胆固醇(TC)和甘油三脂(TG)显著降低,高密度脂蛋白胆固醇(HDL-C)有所升高[37]。SG提取物能够显著降低负荷过量的葡萄糖、阿波罗糖和淀粉等糖源的小鼠的血糖含量,但小鼠的胰岛素含量升高,α-葡萄糖苷酶含量则下降[38]。GK(Goto-Kakizaki)小鼠患有天生的非胰岛素依赖性糖尿病,其糖尿病并不导致肥胖和高血脂的病发,这与亚洲人群的糖尿病类型非常相似,研究表明罗汉果提取物对α-葡萄糖苷酶抑制剂伏格列波糖有着调节作用;改善肾功能,对I型糖尿病的有着一定的预防作用[34]。然而SG提取物中罗汉果苷的组成种类和比例对胰岛素的诱导水平存在着差异[36],各组分摄入后代谢和机体作用机理尚不清楚。
2.3 抗氧化
生物体内存在的带有未配对电子的自由基与许多疾病的发生有着密切的联系。罗汉果提取物能通过直接清除自由基、调节自由基清除酶的活性,诱导生物体内可以合成具备自由基清除能力物质的基因表达等方式来体现抗氧化的能力。谷光甘过氧化物酶(GSH-Px)和超氧化物歧化酶(SOD)是动物体内源性自由基清除酶系统的典型代表[39],罗汉果提取物和罗汉果苷对于维持摄入高脂小鼠的谷光甘过氧化物酶(GSH-Px)和超氧化物歧化酶(SOD)的稳定和提高其水平有着良好的效果[40]。血红素加氧酶(HO)是具备一定生理活性的血红素代谢的限速酶,HO-1是能够被血红素、紫外线、过氧化氢和一些细胞因子诱导产生的血红素加氧酶(HO)的一种,HO-1具备抗氧化,抗炎和防止细胞的凋亡方面的功效已经有广泛的研究[41-42],SG能够通过mRNA调节HO-1的合成及活性,同时抑制Mn-SOD mRNA的表达,然而SG通过参与具备抗氧化活性酶系统实现其生理功效的剂量和毒性需要更多的研究[43]。
Hironobu Yasuno等[44]一种杀虫剂的光谱增效剂胡椒基丁醚(PBO)为小鼠肝癌的诱发剂,发现SG提取物虽然不能通过自身的清除自由基的能力抑制肝癌早期的反应,却通过转录子Nrf 2-Keap-ARE激活自由基清除酶的表达,减轻小鼠因PBO的摄入引起的肝癌。
SG提取物并不具备较强的自由基清除能力,却能通过内源性自由基清除系统的酶的转录和表达,达到一定的清除效果。因此,罗汉果提取物能够对由自由基引起的早期病变,尤其是癌症,如皮肤癌[41]、肝癌[45]等起到一定的预防和修缮的效果,这些研究为罗汉果提取物抗氧化能力的机制和临床应用打下了基础。此外,过量运动导致的体内自由基增加,其攻击线粒体膜和细胞器,导致细胞代谢发生紊乱,从而造成人体疲劳[46],罗汉果能与外源性自由基清除酶发生较好的协同作用,减缓疲劳[47]。
微生物对机体的入侵,脂质过氧化、胰岛β细胞的损伤和胰岛素受体的减少,体内自由基失衡等都能引起人体各方面的疾病,然而生物体作为一个有机的整体,罗汉果提取物的摄入对生物体的影响也是综合和复杂的。罗汉果提取物可以改善胰岛素的反应时间从而能够改善II型糖尿病的症状,同时又能抑制脂质过氧化坚强肾脏的压力,从而对改善肥胖带来的负面影响有一定的功效[3],同时,胰岛素被摄入之后在体内的代谢途径和代谢产物在肝脏和血液中都未被检测到[48],因此,罗汉果在体内的代谢途径和产物还有待研究。
3 产品及应用
罗汉果和罗汉果提取物是现市场上产量最多的产品,然而此类产品加工工艺简单,产品技术类指标较为宽泛,附加值也较低。罗汉果中应用最多的成分是罗汉果苷,其具有高甜度、低卡路里的特点。罗汉果苷V、罗汉果苷VI、罗汉果苷IV甜度均在蔗糖的三百倍以上。因此,罗汉果苷被应用于新型甜味剂的开发[49-50]。罗汉果苷也被用于卷烟的烟丝和过滤嘴,有着增加烟草香气感、降低烟气的干燥感[51-52]。罗汉果在药物方面的应用主要集中于中成药或非处方药。中医中罗汉果常与百部、白前、桑白皮等一起制备药膏原料,成为具有止咳功效的中成药,而此过程中罗汉果V和生物总碱则为主要的功效成分[53-54],此类药物有糖浆、膏状、胶囊和片剂等剂型的产品,如罗汉果止咳糖浆[55]、罗汉果止咳胶囊[56-57]、罗汉果止咳片[58-59]。
此外,罗汉果与菊花、枸杞、决明子等传统中药配伍通过水浸提干燥等工艺所得提取物也可用于功能性保健饮料的制备[60]。
4 展望
罗汉果深入的研究和利用在我国起步较晚,目前对于罗汉果的研究主要集中于罗汉果苷,其他价值成分如黄酮类和油脂类等的提纯、鉴定和分析依然有待进一步的深入研究。随着近几年来,大众对于养生的重视,罗汉果作为一种药食两用的资源和传统中药用材,其开发的辅料和产品必将受到进一步的重视。然而,从罗汉果的化学成分,药理作用、产品及应用等几个方面来看,以下几个方面的研究有待突破:a.罗汉果苷成分的食品和医药用料级别的提取和分离,主要涉及罗汉果苷的稳定性和变化规律、成分的结构鉴定等;b.罗汉果提取物其功能性成分的种类以及毒理性研究;c.罗汉果提取物各成分与其功能的机理研究;d.罗汉果功能与功能成分结构之间的关系。随着科技的发展,以上几个方面的研究必将取得进一步的进展,罗汉果相关的产品将会越来越多地出现在大众的生活中,带来更大的经济效益。
[1]国家药典委员会.中华人民共和国药典一部[S].北京:中国医药科技出版社,2010.
[2]李倩.高纯罗汉果苷V的提取纯化技术研究[D].长沙:湖南农业大学,2011.
[3]BS Sun,YP Chen,YB Wang,et al.Anti-obesity effects of mogrosides extracted from the fruits of Siraitia grosvenorii(Cucurbitaceae)[J].African Journal of Pharmacy and Pharmacology,2012,6(20):1492-1501.
[4]H Kurihara,H Fukami,A Kusumoto,et al.Hypoglycemic action of Cyclocarya paliurus(Batal.)Iljinskaja in normal and diabetic mice[J].Bioscience Biotechnology and Biochemistry,2003,67(4):877-880.
[5]肖刚,王勤.罗汉果研究进展[J].上海中医药杂志,2006,198(11):71-73.
[6]Qi Tang,Xiaojun Ma,Changming Mo,et al.An efficient approach to finding Siraitia grosvenorii triterpene biosynthetic genes by RNA-seq and digital gene expression analysis[J].Bmc Genomics,2011,12.
[7]Fenglai Lu,Dianpeng Li,Chuanming Fu,et al.Studies on chemical fingerprints of Siraitia grosvenorii fruits(Luo Han Guo)by HPLC[J].Journal of Natural Medicines,2012,66(1):70-76.
[8]李春,林丽美,罗明,等.罗汉果中1个新的天然皂苷[J].中国中药杂志,2011(6):721-724.
[9]杨秀伟,张建业,钱忠明.罗汉果中新的天然皂苷[J].中草药,2008(6):810-814.
[10]Li D,Ikeda T,Nohara T,et al.Cucurbitane glycosides from unripe fruits of Siraitia grosvenori[J].Chemical&Pharmaceutical Bulletin,2007,55(7):1082-1086.
[11]梁成钦.薄层扫描法测定罗汉果糖苷(V)含量的研究[J].饮料工业,2005(4):44-46.
[12]马少妹.罗汉果甜苷的HPLC法分析[J].福建分析测试,2006(4):3-6.
[13]马少妹,袁爱群,邓光辉.罗汉果水提取物的高效液相色谱分离研究[J].分析科学学报,2007(3):340-342.
[14]Hongyang Zhang,Huihua Yang,Min Zhang,et al.Identification of flavonol and triterpene glycosides in Luo-Han-Guo extract using ultra-high performance liquid chromatography/quadrupole time-of-flight mass spectrometry[J].Journal of Food Composition and Analysis,2012,25(2):142-148.
[15]戚向阳,张俐勤,单夏锋,等.高效液相色谱-电喷雾质谱联用法分析罗汉果皂甙[J].中国农业科学,2005(10):2096-2101.
[16]常琪,陈迪华,斯建勇,等.罗汉果中总皂甙的含量测定[J].中国中药杂志,1995(9):554-555.
[17]周兢,王梦月,李晓波,等.HPLC法测定罗汉果中罗汉果苷V和11-氧化罗汉果苷V[J].中草药,2007(2):196-198.
[18]卢凤来,刘金磊,黄永林,等.高效液相色谱法同时测定罗汉果中的六种葫芦烷三萜类皂苷[J].色谱,2008(4):504-508.
[19]刘金磊,李典鹏,黄永林,等.HPLC法测定不同生长期罗汉果甙IIE,III,V的含量[J].广西植物,2007(4):665-668.
[20]斯建勇,陈迪华,常琪,等.鲜罗汉果中黄酮甙的分离及结构测定[J].药学学报,1994(2):158-160.
[21]陈全斌,杨瑞云,义祥辉,等.RP-HPLC法测定罗汉果鲜果及甜甙中总黄酮含量[J].食品科学,2003(5):133-135.
[22]唐春丽,李振宏,朱志仁,等.一种罗汉果叶黄酮Cu配合物的表征及活性研究[J].安徽医科大学学报,2012(12):1427-1431.
[23]崔彬,冯静弦,胡琪,等.响应面分析法优化罗汉果黄酮提取工艺条件的研究[J].湖南农业科学,2012(7):112-114.
[24]陈全斌,赵文涛,马俊飞,等.不同方法提取罗汉果种籽油脂的研究[J].广东化工,2012(2):33-34.
[25]黎霜,王恒山,张桂勇.罗汉果种子油化学成分研究[J].广西医学,2003(5):850-852.
[26]徐拉伸,孟丽珊,李仲瑶.罗汉果中甘露醇的分离和鉴定[J].广西植物,1990(3):254-255.
[27]穆静.罗汉果浸出液对变链菌致龋作用的实验室研究[J].中华口腔医学杂志,1998(3):55-57.
[28]周英,郭白苏,郑燕,等.罗汉果果实中抑菌活性组分的研究(英文)[J].时珍国医国药,2008(6):1544-1546.
[29]D A Geller.Hot Papers Molecular-Biology-Molecular-Cloning and Expression of Inducible Nitric-Oxide Synthase from Human Hepatocytes by Geller,DA,Lowenstein,CJ,Shapiro,RA,Nussler,AK,Disilvio,M.,Wang,SC,Nakayama,DK,Simmons,RL,Snyder,SH,Billiar,TR.[J].Scientist,1995,9(10):14-14.
[30]D A Geller,C J Lowenstein,R A Shapiro,et al.Molecular-Cloning and Expression of Inducible Nitric-Oxide Synthase from Human Hepatocytes[J].Proceedings of the National Academy of Sciences of the United States of America,1993,90(8):3491-3495.
[31]Di R,M T Huang,C T Ho.Anti-inflammatory Activities of Mogrosides from Momordica grosvenori in Murine Macrophages and a Murine Ear Edema Model[J].Journal of Agricultural and Food Chemistry,2011,59(13):7474-7481.
[32]高颖.罗汉果中的葫芦烷型糖苷及其对EB病毒活性的抑制作用[J].国外医药(植物药分册),2008(3):138-139.
[33]严钟德.糖尿病病因和发病机理[J].厂矿医药卫生,2000(1):1-2.
[34]Suzuki Y A,M Tomoda,Y Murata,et al.Antidiabetic effect of long-term supplementation with Siraitia grosvenori on the spontaneously diabetic Goto-Kakizaki rat[J].British Journal of Nutrition,2007.97(4):770-775.
[35]陈瑶,贾恩礼.罗汉果化学成分和药理作用的研究进展[J].解放军药学学报,2011(2):171-174.
[36]张俐勤,戚向阳,陈维军,等.罗汉果皂苷提取物对糖尿病小鼠血糖、血脂及抗氧化作用的影响[J].中国药理学通报,2006(2):237-240.
[37]陈维军,宋方方,刘烈刚,等.罗汉果皂甙提取物对1型糖尿病小鼠细胞免疫功能的影响[J].营养学报,2006(3):221-225.
[38]Kurihara H,Fukami H,Kusumoto A,et al.Hypoglycemic action of Cyclocarya paliurus(Batal.)Iljinskaja in normal and diabetic mice[J].Bioscience Biotechnology and Biochemistry,2003,67(4):877-880.
[39]Liu J,Wang X,Sanada M,et al.Free radical scavenging and antioxidant effect of fructus momordicae[J].Food Free Radicals,1994(1):147-150.
[40]赵燕,刘国艳,史贤明.罗汉果水提取物及其甜甙的体内抗氧化作用[J].食品研究与开发,2012(2):174-176.
[41]Otterbein LE,Bach FH,Alam J,et al.Carbon monoxide has anti-inflammatory effects involving themitogen-activated protein kinasepathway[J].Nat Med,2000(6):422-428.
[42]Brouard S,Otterbein LE,Anrather J,et al.Carbon monoxide generated by heme oxygenase 1 suppressesendothelial cell apoptosis[J].J Exp Med,2000,192:1015-1026.
[43]Fangfang Song,Xiangyang Qi,Wenjun Chen,et al.Effect of Momordica grosvenori on oxidative stress pathways in renal mitochondria of normal and alloxan-induced diabetic mice[J]. European Journal of Nutrition,2007,46(2):61-69.
[44]Yasuno Hironobu,Nishimura Jihei,Dewa Yasuaki,et al. Modifying effect of Siraitia grosvenori extract on piperonyl butoxide-promoted hepatocarcinogenesis in rats[J].Journal of Toxicological Sciences,2008,33(2):197-207.
[45]Takasaki M,Konoshima T,Murata Y,et al.Anticarcinogenic activity ofnaturalsweeteners-cucurbitane glycosidesfrom Momordicagrosvenori[J].Cancer Lett,2003,198(1):37-42.
[46]Min-Hsiung Pan,Ji-Rui Yang,Mei-Ling Tsai,et al.Antiinflammatory effect of Momordica grosvenori Swingle extract through suppressed LPS-induced upregulation of iNOS and COX-2 in murine macrophages[J].Journal of Functional Foods,2009,1(2):145-152.
[47]Nikolaidis M G,Jamuras A Z,Pasch Alis V,et al.The effect of muscle-dam aging exercise on blood and skeletal muscleoxidative stress:magnitude and time-course considerat ions[J].Sports Med,2008,38(7):579-586.
[48]姚绩伟,于传伟,丁秀诗.罗汉果药理活性成分及其在运动医学中的应用[J].泉州师范学院学报,2011(4):53-57.
[49]Murata,Y,Ogawa T,Suzuki YA,et al.Digestion and Absorption of Siraitia grosvenori Triterpenoids in the Rat[J]. Bioscience Biotechnology and Biochemistry,2010,74(3):673-676.
[50]Lee C H.Intense Sweetener from Lo Han Kuo(Momordica-Grosvenori)[J].Experientia,1975,31(5):533-534.
[51]维多利亚生物有限公司.甜味组合物和制备它们的方法:中国,CN 101522058A[P].2009.9.2.
[52]刘绍华,黄泰松,邹克兴,等.HPLC/ESI/MS法测定卷烟烟丝和烟气中的罗汉果苷Ⅴ[J].烟草科技,2008(7):38-41.
[53]刘绍华,黄泰松,邹克兴,等.罗汉果提取物在丙纶滤棒中应用的研究[J].中国烟草学报,2009(3):17-21.
[54]宋志钊,文志云,李星宇,等.复方罗汉果止咳片的提取工艺研究[J].中成药,2009(11):1772-1774.
[55]刘元,莫海涛,文志云,等.复方罗汉果止咳片质量标准研究[J].中成药,2010(2):341-343.
[56]李今玉,金松竹.罗汉果的临床应用[J].现代医药卫生,2011(21):3286-3287.
[57]郝立芳.复方罗汉果止咳冲剂中罗汉果的薄层色谱鉴别法[J].海峡药学,2007(11):59-60.
[58]广西健丰药业有限公司.无糖型复方罗汉果止咳颗粒的制备方法及质量控制方法:中国:CN102973861A[P].2013-3-20.
[59]陈瑶,范小兵,王永祥,等.罗汉果甜苷的止咳祛痰作用研究[J].中国食品添加剂,2006(1):41-43.
[60]李良,吕国红,钟晓凌,等.罗汉果植物保健饮料的研制[J].饮料工业,2010(10):30-33.
Research progress in chemical composition and pharmacology of siraitia grosvenori swingle
ZHANG Wei,WANG Bin*,ZHOU Li,GONG Jia,HAN Kun,LI Xiao-jun
(R&D Center,Hangzhou Efuton Tea Co.,Ltd.,Hangzhou 310052,China)
Siraitia grosvenori swingle(SG),a traditional Chinese meidicine ingrediendt,is unique to China and belongs to the cucurbitaceous vine species.Modern researches showed that SG contains mogrosides,flavonoids and grease which had special biologically activities.Analysis and identification of the chemical constituents,pharmacology,fine processing and applications of siraitia grosvenori swingle(SG)were summarized in this paper,which were useful reference materials for utilizing of SG,especially as a pharmaceutical material.
siraitia grosvenori swingle(SG);mogroside V;diabetes;free radical scavenging
TS201.4
A
1002-0306(2014)12-0393-05
10.13386/j.issn1002-0306.2014.12.077
2013-10-08 *通讯联系人
张维(1987-),男,硕士研究生,研究方向:茶叶生物化学。
杭州市“雏鹰计划”(20121831K0155);杭州市农业发展基金(97)。
