人结肠癌细胞中CacyBP/SIP核转位差异表达基因的验证*
2014-02-28王安萍赵盈盈翟惠虹
王安萍 赵盈盈 刘 欣 翟惠虹
钙周期素结合蛋白(CacyBP/SIP)是一种可以和钙周期素(S100A6)结合大小约30 ku的蛋白质。在结肠癌细胞中CacyBP/SIP主要定位于细胞质中,研究发现胃泌素、KCl[1]等作为刺激因子及缺氧[2]状态可使CacyBP/SIP核转位。为筛选出CacyBP/SIP核转位下游差异表达基因,本课题组在前期工作中成功构建了hCacyBP/SIP基因的胞核定位载体[3],并将载体成功包装入慢病毒,取病毒上清和阴性对照上清感染人源性结肠癌SW480细胞,完成细胞周期聚合酶链反应(PCR)芯片,共筛选出88个差异表达基因。为排除人为导致胞核中CacyBP/SIP过表达筛选出差异表达基因的假阳性,同时明确在生理条件下CacyBP/SIP发生核转位后是否有相同差异表达基因,本研究选取差异表达倍数大于2的基因周期素依赖性蛋白激酶8(cyclin dependent kinase 8,CDK8)和细胞周期蛋白依赖性激酶亚基2(cyclin depen⁃dent kinase subunit 2,CKS2),并采用实时荧光定量PCR(qRT-PCR)技术进行验证。
1 材料与方法
1.1 实验材料 人源性结直肠腺癌细胞SW480购自北京协和细胞库;RPMI-1640培养液为Hyclon公司,胎牛血清、0.25%胰酶购自Gibco公司,胞浆、胞核蛋白抽提试剂盒及BCA蛋白定量试剂盒为南京凯基公司,胃泌素购自Abcam公司,CacyBP/SIP兔抗人单抗购自CST公司,PCNA鼠抗人单克隆抗体购自Abbkine公司,β-actin鼠抗人单抗、辣根酶标记羊抗兔/鼠IgG购自北京中杉。Trizol购自Invitrogen公司,cDNA反转录试剂盒为MBI公司产品,荧光定量PCR试剂盒购自promega公司,引物序列由上海生工生物公司合成。
1.2 方法
1.2.1 细胞培养 人结直肠腺癌细胞SW480在37℃、5% CO2、10%胎牛血清的RPMI1640培养液培养,待细胞生长状态良好,更换为无血清培养液培养24 h后,对照组SW480细胞继续无血清培养液培养,实验组细胞更换胃泌素浓度为1×10-7mol/L的无血清、无双抗培养液分别培养24、48 h。
1.2.2 免疫蛋白印迹(Western blot)检测胃泌素刺激前后CacyBP/SIP在细胞内的定位和表达 弃去培养液按试剂盒说明分别提取实验组和对照组细胞胞浆、胞核蛋白,BCA法蛋白定量。10%分离胶,110 V电压电泳120 min。半干转膜,5%脱脂奶粉封闭2~4 h,孵育一抗anti-CacyBP/SIP(1∶600),4℃过夜,二抗HRP标记羊抗兔(1∶5 000),洗膜,曝光。胞浆蛋白内参β-actin(1∶400),胞核蛋白内参PCNA(1∶1 000)。
1.2.3 细胞总RNA提取、反转录 Triozl法分别提取实验组胃泌素作用48 h的SW480细胞和对照组SW480细胞总RNA,检测光密度(OD)值在1.8~2.1之间的RNA,按照反转录试剂盒说明反转录成cDNA。
1.2.4 qRT-PCR检测胃泌素刺激前后CDK8、CKS2基因表达水平 cDNA模板2 μL,上下游引物各0.4 μL(10 μmol/L),2×Go Taq®Master PCR Mix 10 μL,无酶水补充为总体积至20 μL反应体系;反应条件:预变性95℃2 min;扩增反应95℃15 s,60℃30 s,72℃30 s。检测荧光,共55个循环。平行重复实验3次。扩增反应引物序列见表1。反应结束后得到每个目的基因和管家基因β-actin的Ct值,用目的基因和管家基因Ct值差值进行统计学分析;用2-△△Ct法计算实验组和对照组基因差异表达倍数。

Table 1 The PCR primer and the Tm of genes表1 PCR扩增反上下引物序列及Tm值
1.3 统计学方法 用SSPS 17.0软件进行统计学分析,计量资料以±s表示,2组间均数比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 胃泌素刺激前后CacyBP/SIP在细胞内的定位和表达 选胃泌素作为刺激因子,诱导CacyBP/SIP发生核转位。无胃泌素刺激时CacyBP/SIP主要在细胞质中表达,胞核中仅少量表达。给予1×10-7mol/L胃泌素分别刺激24、48 h后,可同时在细胞质和细胞核中检测到CacyBP/SIP的表达,见图1。且胃泌素作用48 h的效果较24 h明显,说明胃泌素成功诱导CacyBP/SIP入核。
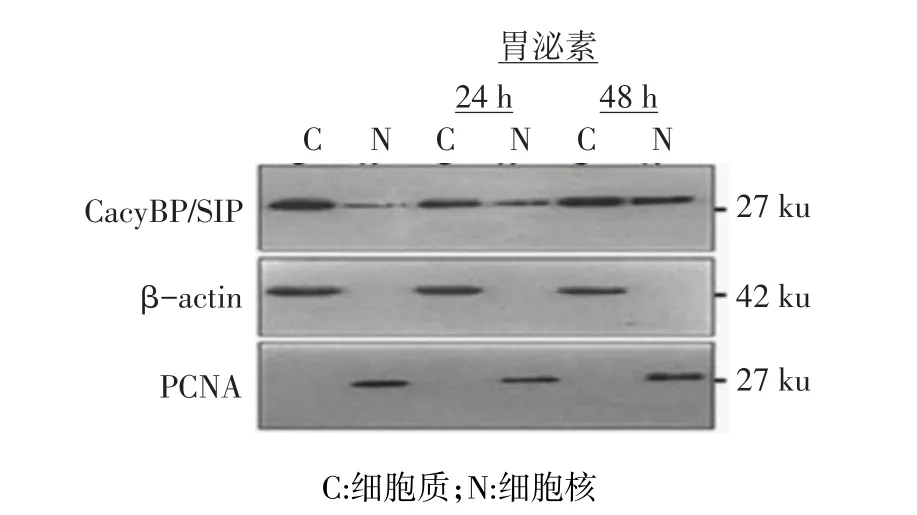
Figure 1 The expression of CacyBP/SIP in cytoplasm and nuclear detected by Western blot assay before and after stimulation图1 Western blot检测胃泌素刺激前后CacyBP/SIP在胞质及胞核中的定位
2.2 qRT-PCR结果 在CacyBP/SIP核转位前后,基因CDK8和CKS2在细胞SW480中的变化差异方向同芯片结果一致,CDK8和CKS2两目的基因均表达上调,见图2、3。且实验组和对照组中两基因表达差异有统计学意义(P<0.05),见表2。其中基因CDK8的倍数变化为2.38,基因CKS2的倍数变化为2.25。

Figure 2 The amplification curves of real-time quantitative PCR图2 qRT-PCR扩增曲线

Figure 3 The dissociation curves of real-time quantitative PCR图3 qRT-PCR溶解曲线
Table 2 Comparison of expression changes of CDK8 and CKS2 genes before and afterstimulation表2 胃泌素刺激前后基因CDK8、CKS2表达变化比较(△Ct,±s)

Table 2 Comparison of expression changes of CDK8 and CKS2 genes before and afterstimulation表2 胃泌素刺激前后基因CDK8、CKS2表达变化比较(△Ct,±s)
*P<0.05
组别实验组对照组t n33 CDK8 10.35±0.37 11.60±0.59 3.129*CKS2 4.59±0.43 5.76±0.51 3.053*
3 讨论
3.1 胃泌素诱导CacyBP/SIP核转位使得基因CDK8和CKS2发生差异表达 翟惠虹等[1]发现在结肠癌细胞中胃泌素可刺激主要表达在细胞质中的CacyBP/SIP蛋白发生核转位,这种核转位具有Ca2+浓度依赖现象,同时伴有蛋白磷酸化现象。蛋白在细胞中表达定位与其生物学功能密切相关,CacyBP/SIP在胃泌素刺激下发生核转位和磷酸化,提示其可能作为信号分子传递信息从而参与细胞功能的调节。为明确在生理条件下CacyBP/SIP核转位是否会有相同差异表达基因,本研究选择用胃泌素作为刺激因子,诱导CacyBP/SIP入核,结果显示胃泌素诱导 Ca⁃cyBP/SIP入核后基因CDK8、CKS2表达上调,这与PCR芯片结果一致,说明在胞核中CacyBP/SIP过表达情况下筛选出差异基因表达趋势同胃泌素诱导CacyBP/SIP核转位后结果一致。
3.2 CDK8和结肠癌的关系 Firestein等[4]研究发现在人类结肠癌细胞中CDK8转录水平对细胞周期和细胞生长的调控发挥重要作用,因而被提议为早期致癌基因。Firestein等[5]还发现CDK8参与由βcatenin介导的原癌基因激活。He等[6]发现在结肠癌细胞中,CDK8表达量降低后通过降低β-catenin表达及阻滞细胞G0/G1期的转换,进而抑制细胞增殖、促进细胞凋亡。这表明CDK8通过影响β-catenin的表达量进而调节结肠癌细胞生物学活动。
3.3 CKS2与结肠癌的关系 基因CKS2是CKS家族成员之一,可催化亚基结合形成复合物。过表达的CKS2在细胞应激情况下阻断DNA复制的S期内检查点,使DNA持续性复制进而调控细胞周期进程[7]。CKS2在细胞减数分裂过程中具有非常重要的作用,是生殖细胞从减数第1次分裂中期到后期的必要条件[8]。研究发现在膀胱癌[9]、食管癌[10]、胃癌[11]、胆管癌[12]等恶性肿瘤中CKS2均呈高表达,且与肿瘤的侵袭性和预后不良密切相关,进而有望成为一种新的肿瘤生物学标志物。与正常组织、癌旁组织相比较,CKS2在结肠癌中也呈现高表达[13]。
3.4 CacyBP/SIP与肿瘤的发生发展关系 在不同肿瘤细胞中CacyBP/SIP发挥不同的生物学作用,在肾癌细胞中其可能通过降低β-catenin表达量使CyclinD1蛋白表达下调,进而阻碍细胞周期的进展[14];在胰腺癌细胞中其通过促进细胞周期G1/S期的转换进而促进胰腺癌细胞增殖[15];在胃癌细胞中CacyBP/SIP可通过对β-catenin表达和T细胞因子/淋巴增强因子(Tcf/LEF)转录激活的影响进而抑制胃癌细胞的增殖[16]。以上研究表明CacyBP/SIP在肿瘤细胞中大多数是通过对细胞周期调控及β-catenin活动调节而参与肿瘤细胞生物学活动的。
综上,本研究发现胃泌素可刺激CacyBP/SIP发生核转位;同时也证明在CacyBP/SIP过表达情况下完成的细胞周期PCR芯片所筛选出来的差异表达基因同生理条件下CacyBP/SIP核转位后的差异表达基因一致,对筛选出来的差异表达基因与CacyBP/SIP的关系值得进一步研究。
[1]翟惠虹,陈雄,卢媛媛,等.结肠癌细胞中CacyBP/SIP的表达和核转位现象[J].世界华人消化杂志,2008,16(35):3953-3957.
[2] 谢福利,仇长青,赵盈盈,等.二氯化钴致人结肠癌细胞系Ca⁃cyBP/SIP核转位[J].基础医学与临床,2012,32(11):1312-1317.
[3]仇长青,赵盈盈,冯珊珊,等.人钙周期素结合蛋白基因亚细胞定位载体的构建和鉴定[J].广东医学,2011,32(22):2917-2919.
[4]Firestein R,Bass AJ,Kim SY,et al.CDK8 is a colorectal cancer on⁃cogene that regulates beat-catenin activity[J].Nature,2008,455 (7212):547-551.doi:10.1038/nature07179.
[5]Firestein R,Shima K,Nosho K,et al.CDK8 expression in 470 colorectal cancers in relation to β-catenin activation,other molecu⁃lar alterations and patient survival[J].Int J Cancer,2010,126(12): 2863-2873.doi:10.1002/ijc.24908.
[6]He SB,Yuan Y,Wang L,et al.Effects of cyclin-dependent kinase 8 specific siRNA on the proliferation and apoptosis of colon cancer cells[J].J Exp Clin Cancer Res,2011,30(1):109.doi:10.1186/ 1756-9966-30-109.
[7]Liberal V,Martinsson-Ahlzn HS,Liberal J,et al.Cyclin-depen⁃dent kinase subunit(Cks)1 or Cks2 overexpression overrides the DNA damage response barrier triggered by activated oncoproteins [J].Proc Natl Acad Sci USA,2012,109(8):2754-2759.doi: 10.1073/pnas.1102434108.
[8]王佳佳,张忠英.CKS2蛋白及其在恶性中的研究进展[J].国际检验医学杂志,2011,32(6):670-673.
[9]Chen R,Feng C,Xu Y,Cyclin-dependent kinase-associated pro⁃tein Cks2 is associated with bladder cancer progression[J].J Int Med Res,2011,39(2):533-540.doi:10.1177/147323001103900222. [10]Wang JJ,Fang ZX,Ye HM,et al.Clinical significance of overex⁃pressed cyclin-dependent kinase subunits 1 and 2 in esophageal carcinoma[J].Dis Esophagus,2013,26(7):729-736.doi:10.1111/ dote.12013.
[11]Tanaka F,Matsuzaki S,Mimori K,et al.Clinicopathological and bio⁃logical significance of CDC28 protein kinase regulatory subunit 2 overexpression in human gastric cancer[J].Int J Oncol,2011,39 (2):361-372.doi:10.3892/ijo.2011.1056.
[12]Shen DY,Zhan YH,Wang QM,et al.Oncogenic potential of cyclin kinase subunit-2 in cholangiocarcinoma[J].Liver Int,2013,33 (1):137-148.doi:10.1111/liv.12014.
[13]叶光耀,俞旻皓,钟鸣.CKS2在结直肠癌中的表达和临床意义[J].胃肠病学,2013,18(3):159-162.
[14]Sun S,Ning X,Liu J,et al.Overexpressed CacyBP/SIP leads to the supression of growth in renal cell carcinoma[J].Biochem Biophys Res Commun,2007,356(4):864-871.doi:org/10.1016/j.bbrc.2007. 03.080.
[15]Chen X,Mo P,Li X,et al.CacyBP/SIP protein promotes prolifera⁃tion and G1/S transition of human pancreatic cancer cells[J].Mol Cacrcinog,2011,50(10):804-810.doi:10.1002/mc.20737.
[16]Ning X,Sun S,Hong L,et al.Calcylin-binding protein inhibits pro⁃liferation,tumorigenicity,and invasion of gastric cancer[J].Mol Cancer Res,2007,5(12):1254-1262.doi:10.1158/1541-7786. MCR-06-0426.
