microRNA-21通过促进成纤维细胞的增殖和分化调节心肌梗死后的心脏重塑
2014-02-28张闽红肖清萍刘建文
郭 东 张闽红 肖清萍 刘建文
心肌梗死(心梗)是心脏衰竭最常见的病因之一,发病凶险,致残率和致死率均高,因此研究如何改善心梗后心脏的修复能力具有重要的临床价值。miRNA(miR)是一类非编码的小分子RNA,通过抑制靶基因的翻译过程,参与许多重要的生物学过程[1]。研究表明miR-21在急性心肌缺血的早期病理过程中起着重要的调节作用[2]。过表达miR-21可以减少肿瘤坏死因子(TNF)-α诱导的心肌细胞凋亡[3]。本研究采用小鼠心肌梗死模型,检测心梗交界区心脏组织miR-21的表达情况,同时利用miR-21的模拟物(miR-21 mimic)转染小鼠原代心脏成纤维细胞,观察过表达miR-21对心脏成纤维细胞增殖与分化的影响,为促进心梗后心脏的修复提供理论依据。
1 材料与方法
1.1 实验动物 体质量相近的C57/BL6小鼠,SPF级,雄性,体质量(23±3)g,购自南京大学模式动物研究所。
1.2 试剂和仪器 RNA反转录试剂盒和SYBR试剂(日本TAKARA公司);DMEM高糖培养基(美国Hyclone公司);胎牛血清(美国Gibco公司);脂质体Lipfectamine 2000(美国in⁃vitrogen公司);化学修饰的miR-21 mimic(上海吉玛生物科技有限公司);实时荧光定量PCR(qRT-PCR)仪(美国ABI公司);蛋白提取试剂盒(碧云天);α平滑肌肌动蛋白(α-SMA)、小鼠Smad同源物7(Smad7)以及甘油醛-3-磷酸脱氢酶(GAPDH)抗体(Santa Cruz,USA);EdU细胞增殖检测试剂盒(广州市瑞博生物科技有限公司)。
1.3 方法
1.3.1 动物分组 按照随机数字表法分为假手术组和心肌梗死组,每组20只。假手术组开胸但不结扎左冠状动脉;心肌梗死组阻断左冠状动脉前降支7 d。2组均为普通饲料饲养,自由饮水。
1.3.2 小鼠心梗模型的建立 心梗模型制作参照文献[4]进行。胸骨左缘第2~4肋开胸,以左冠脉主干为标志,在左心耳下方2 mm处进针,6-0号丝线结扎左前降支,当结扎区域变白,心电图2个以上的肢导联出现ST段上抬0.2 mV则判断为造模成功。
1.3.3 HE染色 处死小鼠,用含有肝素的生理盐水灌洗以去除心脏组织的血液。取心脏,用10%福尔马林固定组织,脱水,石蜡包埋,切成4 μm厚切片,进行HE染色,观察心肌梗死后心肌细胞存活及炎症细胞浸润情况。
1.3.4 qRT-PCR检测miR-21的含量 应用Trizol法提取各组小鼠心脏组织的RNA,用TAKARA反转录试剂盒,利用茎环结构引物特异性反转miR-21和U6。第一步引物退火,取2 μg RNA与1 μL miR-21(100 mg/L)和1 μL U6(100 mg/L)特异性茎环结构引物混合,反应条件为70℃10 min,4℃10 min。第二步合成cDNA第一链,在混合物中分别加入10× buffer、2 μL MgCl2(20.8 mol/L)、1 μL反转录酶,补水至20 μL,充分混匀,反应条件为37℃1 h,4℃10 min。生成的cD⁃ NA取1μL,与10 μL 2×SYBR混合,再加入7 μL水和1 μL上、下游引物,混匀为20 μL反应体系,反应条件为95℃5 min,95℃15 s,60℃60 s,40个循环。miR-21的表达水平用Cq值(荧光信号达到设定阈值所经的循环数)表示,内参为U6。引物序列见表1。
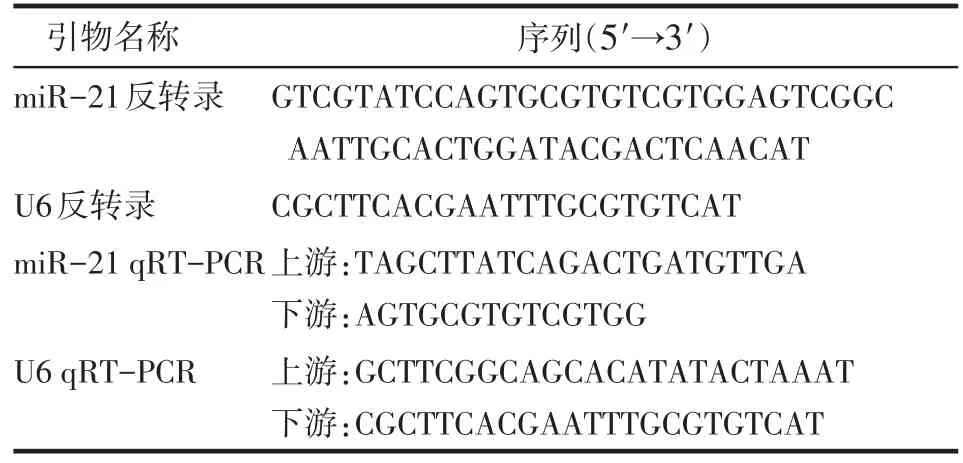
Table 1 The stem-loop and PCR primers of different genes表1 目的基因茎环引物及PCR引物序列
1.3.5 小鼠成纤维细胞的提取 无菌条件下取出心脏于6 cm培养皿中,D-hank’s液漂洗,剪碎心脏放入15 mL离心管中,加入5倍体积0.05%胰酶,37℃水浴5 min,反复吹打、静置,待自然沉降后弃去上清液。沉淀加入约5倍体积0.08%胰蛋白酶及0.1%胶原酶Ⅱ混合液,反复吹打约10 min,离心取沉淀后以10 mL含20%胎牛血清的DMEM培养液重悬,接种于6 cm培养皿中。60~90 min后更换新鲜20%胎牛血清的DMEM培养液。
1.3.6 miR-21 mimic的转染 转染前1 d,胰酶消化成纤维细胞,接种至6孔板中,使转染前细胞浓度能够达到30%~50%。实验分3组:随机对照组、空白对照组和miR-21 mimic组。各组分别在50 μL Opti-MEM加入1.25 μL PBS、阴性对照储存液和miR-21 mimic储存液(20 μmol/L),室温孵育5 min。用50 μL Opti-MEM稀释1 μL lipo2000,温和混匀并室温孵育5 min。将以上两液体温和混匀,室温孵育20 min。将混合液加入含有细胞的1 mL培养基的培养孔中,温和混匀,培养4~6 h后,将孔中含mimic-lipo2000混合液的培养基移去,更换新鲜20%胎牛血清的DMEM培养液。细胞培养24 h后,采用荧光定量PCR技术检测miR-21的含量。
1.3.7 Western blot法测定成纤维细胞α-SMA及Smad7蛋白的表达 心脏原代成纤维细胞培养1周后,按照试剂盒说明提取蛋白,并测定蛋白浓度。在10%聚丙烯酰胺凝胶上行SDS-PAGE电泳。电泳结束后用半干转电转移法将凝胶中蛋白转至硝酸纤维素膜。转膜后将膜置于5%脱脂奶粉中室温封闭1 h,然后分别加入相对应的一抗(1∶500稀释),4℃孵育过夜。第2天膜浸于一抗溶液中,室温平衡1 h后,洗膜3次,每次10 min。加入辣根过氧化物酶标记的二抗,室温孵育1 h。TBST溶液洗膜3次,每次10 min。利用辣根过氧化物酶HRP-ECL化学发光法检测蛋白条带,不做放射自显影。以GAPDH为内参。
1.3.8 EdU检测成纤维细胞的增殖 成纤维细胞以(4×103~1×104)/孔接种于96孔板中,实验分组同1.3.6,每组设3个复孔。于转染后2 d每孔加入50 μmol/L EdU试剂100 μL,于37℃5%CO2条件下孵育2 h;弃培养液,每孔加入50 μL 4%多聚甲醛,室温孵育30 min;弃固定液,每孔加入50 μL 2 g/L甘氨酸,孵育10 min;弃甘氨酸溶液,每孔加入100 μL PBS,孵育5 min;弃PBS,每孔加入100 μL 0.5%Triton,孵育10 min,PBS冲洗1次;每孔加入100 μL 1×Apollo®染色反应液,避光、室温、脱色摇床孵育30 min后,弃染色反应液;PBS冲洗1次;每孔加入10 μL 1×DAPI反应液,避光、室温孵育10 min;在荧光显微镜下进行观察及图片采集。按下列公式计算细胞增殖率(%)=EdU阳性细胞数/DAPI阳性细胞数× 100%。
1.4 统计学方法 采用SPSS 12.0统计软件进行分析。实验数据以均数±标准差(±s)表示,2组间均数比较采用t检验;多组均数间比较采用单因素方差分析,组间多重比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 HE染色结果 常规光镜下可见心肌梗死组梗死区主要是胶原纤维和成纤维细胞,几乎无存活心肌细胞;梗死交界区由心脏成纤维细胞和心肌细胞组成,且梗死区和交界区均有炎症细胞浸润,而远端区主要是存活的心肌细胞,表明小鼠心肌梗死造模成功,见图1。
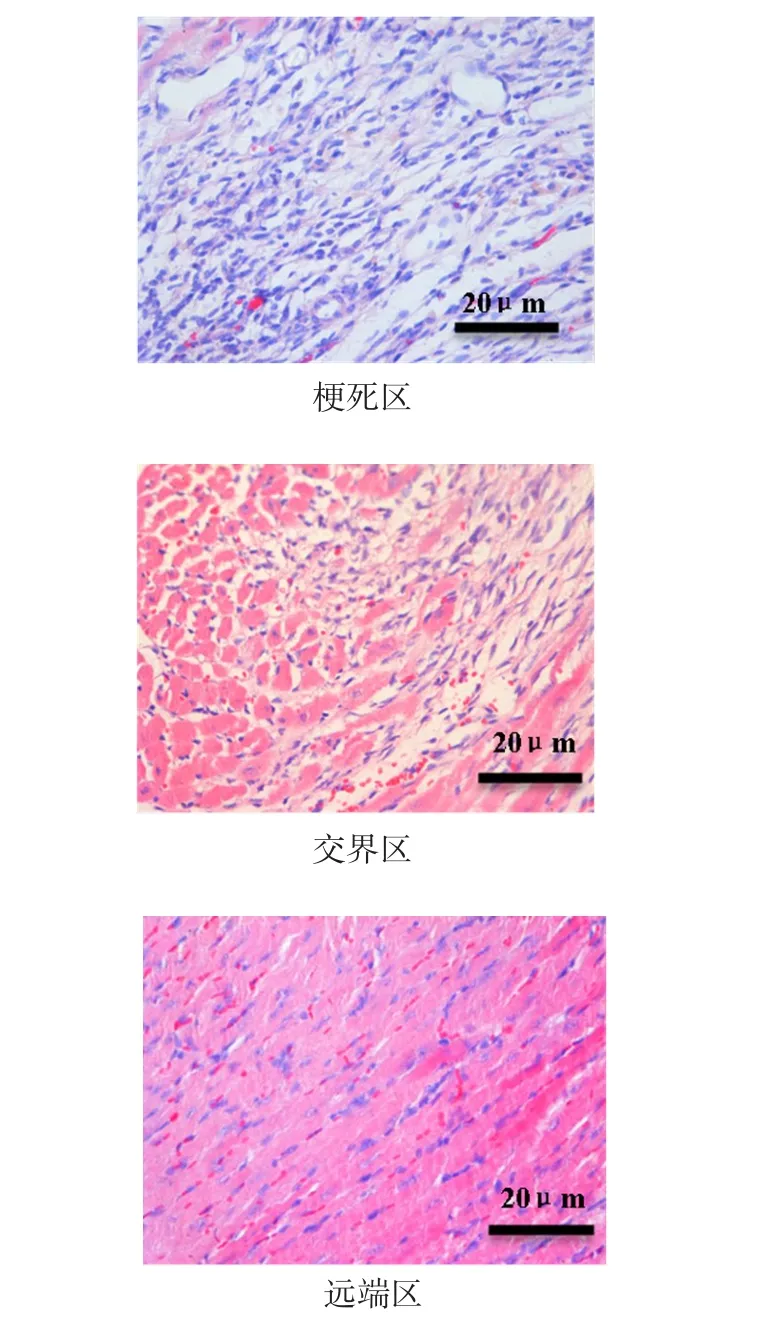
Figure1 The myocardial tissue sections of HE staining(HE,×400)图1 HE染色光镜下心肌组织切片(HE,×400)
2.2 2组心脏梗死交界区miR-21的基因表达比较 与无梗死的假手术组(1.620±0.451)×10-4相比,心肌梗死组梗死交界区的miR-21的表达量(6.043± 0.231)×10-4明显增加(t=12.102,P<0.01)。
2.3 3组成纤维细胞中miR-21的基因表达及EdU阳性率比较 miR-21 mimic组成纤维细胞中的miR-21基因表达及EdU阳性率明显高于随机对照组和空白对照组(P<0.01),而后2组差异无统计学意义,见表2。
Table 2 Comparison of gene expression and EdU positive percentage of miR-21 in fibroblast treated with different conditions表2 不同因素处理成纤维细胞后miR-21基因表达及EdU阳性率比较 (±s)
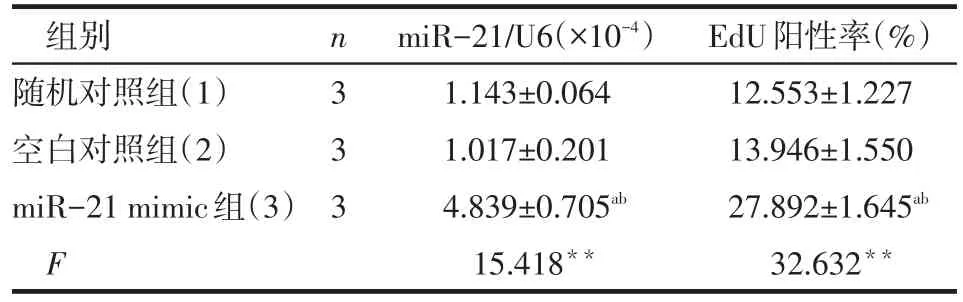
Table 2 Comparison of gene expression and EdU positive percentage of miR-21 in fibroblast treated with different conditions表2 不同因素处理成纤维细胞后miR-21基因表达及EdU阳性率比较 (±s)
**P<0.01;a与(1)比较,b与(2)比较,P<0.01
组别随机对照组(1)空白对照组(2)miR-21 mimic组(3)F n333 miR-21/U6(×10-4)1.143±0.064 1.017±0.201 4.839±0.705ab 15.418**EdU阳性率(%)12.553±1.227 13.946±1.550 27.892±1.645ab 32.632**
2.4 Smad7和α-SMA蛋白表达水平的变化 随机对照组和空白对照组的成纤维细胞Smad7表达较强,miR-21 mimic组转染成纤维细胞后Smad7的表达明显下调,条带灰度减弱。同时miR-21 mimic组α-SMA的表达显著上调,条带灰度增强。空白对照组与随机对照组Smad7及α-SMA蛋白表达量无明显差异,见图2。
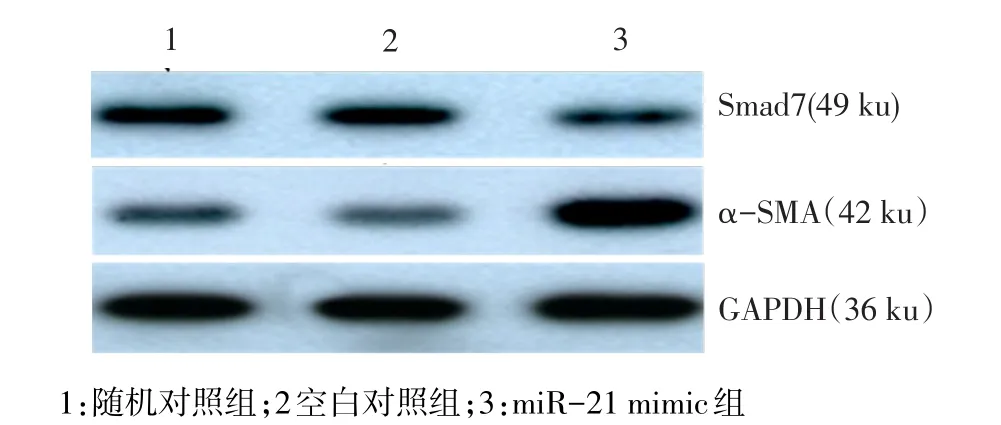
Figure 2 The expression of Smad7 and α-SMA in fibroblast after overexpression of miR-21 detected by Western blot assay图2 Western blot检测过表达miR-21后成纤维细胞Smad7和α-SMA蛋白的表达情况
3 讨论
3.1 miR-21参与心梗后心脏的损伤和修复 目前由于临床溶栓及急诊经皮冠状动脉腔内成形术的广泛应用,已明显减低了急性心肌梗死的死亡率。但心脏破裂作为急性心肌梗死的常见并发症之一几乎是致命性的,且其发生尚不可预测,严重威胁患者生命。心梗后心脏破裂的发生机制主要与心脏的重塑有关。已有文献报道多种microRNA参与心脏重塑的病理过程[4]。miR-21是由单个基因编码,在进化上高度保守的microRNA。Lagos-Quintana等[5]报道miR-21可以在心脏、小肠、脾脏等多种器官中表达。有研究证实,miR-21参与多种心血管疾病[6]。最新研究表明miR-21可通过调节转化生长因子(TGF)-β受体Ⅲ(TGFβRⅢ)的表达调控心脏纤维化[7]。Yin等[8]发现小鼠心肌梗死24 h后,心肌梗死区miR-21表达显著上调。Cheng等[9]在小鼠的心梗模型中证实上调的miR-21可明显减少心肌梗死面积。本研究中,笔者成功构建小鼠心肌梗死模型,HE染色显示梗死区心肌细胞基本消失,并且有大量炎症细胞的浸润。qRT-PCR结果发现miR-21在心肌梗死组梗死交界区表达较对照组显著上调,表明miR-21参与心梗后心脏损伤和修复过程。
3.2 miR-21通过抑制Smad7基因激活成纤维细胞的增殖与分化 成纤维细胞的增殖与分化在心肌梗死后的心脏重塑过程中扮演重要角色。研究表明TGF-β信号通路是调控成纤维细胞的增殖与分化的主要信号通路[10]。本研究证实过表达miR-21可以明显激活成纤维细胞的增殖和分化。Smad7基因是TGF-β信号转导通路的抑制蛋白,它与细胞膜上TGF-β受体竞争性结合,阻断TGF-β信号在胞浆内的传导,下游信号紊乱是TGF-β信号转导通路失活的机制之一[11]。而抑制TGF-β/Smads信号通路可以减轻糖尿病导致的肾脏纤维化[12]。在本研究中,笔者利用TargetScan 4.0预测到Smad7为miR-21的下游靶基因,结果表明在成纤维细胞中过表达miR-21可以明显抑制Smad7的表达。因此推测在心梗模型下,miR-21通过抑制Smad7的表达,进而促进TGF-β对成纤维细胞的分化,最终改善了心脏的重塑。
综上所述,在小鼠心肌梗死模型中,miR-21在梗死交界区表达明显上调,通过抑制靶基因Smad7的表达,促进成纤维细胞的增殖和分化,进而促进心梗后心脏组织的修复,此结果为有效预防心梗后心脏破裂提供了新的线索和治疗靶点。
[1]Vogel B,Keller A,Frese KS,et al.Refining diagnostic microRNA signatures by whole-miRNome kinetic analysis in acute myocardial infarction[J].Clin Chem,2013,59(2):410-418.doi:10.1373/ clinchem.2011.181370.
[2]杨琼,杨侃,李安莹,等.MicroRNA-21在缺血再灌注损伤早期大鼠心肌的表达及抗细胞凋亡作用[J].中南大学学报(医学版), 2013,38(5):483-489.
[3]唐艳,王梦洪.微小RNA-21对乳鼠心肌细胞凋亡及磷酸脂酶-张力蛋白同源物/丝氨酸/苏氨酸激酶/叉头蛋白3a信号传导通路的影响[J].中华心血管病杂志,2013,41(2):135-142.
[4]Small EM,Frost RJ,Olson EN.MicroRNAs add a new dimension to cardiovascular disease[J].Circulation,2010,121(8):1022-1032. doi:10.1161/CIRCULATIONAHA.109.889048.
[5] Lagos-Quintana M,Rauhut R,Yalcin A,et al.Identification of tis⁃sue-specific microRNAs from mouse[J].Current Biology,2002,12 (9):735-739.
[6]Wei Y,Schober A,Weber C.Pathogenic arterial remodeling:the good and bad of microRNAs[J].Am J Physiol Heart Circ Physiol, 2013,304(8):1050-1059.doi:10.1152/ajpheart.00267.2012.
[7] Liang H,Zhang C,Ban T,et al.A novel reciprocal loop between mi⁃croRNA-21 and TGFβRIII is involved in cardiac fibrosis[J].Int J Biochem Cell Biol,2012,44(12):2152-2160.doi:10.1016/j.bio⁃cel.2012.08.019.
[8]Yin C,Salloum FN,Kukreja RC.A novel of microRNA in late pre⁃conditioning:upregulation of endothelial nitric oxide synthase and heart shock protein 70[J].Circ Res,2009,104(5):572-575.doi: 10.1161/CIRCRESAHA.108.193250.
[9]Cheng Y,Zhu P,Yang J,et al.Ischaemic preconditioning regulat⁃ed miR-21 protects heart against ischaemia/reperfusion injury via anti-apoptosis through its target PDCD4[J].Cardiovasc Res,2010,87(3):431-439.doi:10.1093/cvr/cvq082.
[10]Dobaczewski M,Chen W,Frangogiannis NG.Transforming growth factor(TGF)-β signaling in cardiac remodeling[J].J Mol Cell Cardi⁃ol,2011,51(4):600-606.doi:10.1074/jbc.M111.288944.
[11]Wang T,Zhou XT,Yu Y,et al.Inhibition of corneal fibrosis by Smad7 in rats after photorefractive keratectomy[J].Chin Med J (Engl),2013,126(8):1445-1450.
[12]Xin X,Li XH,Wu JZ,et al.Pentamethylquercetin ameliorates fibro⁃sis in diabetic Goto-Kakizaki rat kidneys and mesangial cells with suppression of TGF-β/Smads signaling[J].Eur J Pharmacol,2013, 713(1-3):6-15.doi:10.1016/j.ejphar.2013.04.045.
