河南省番茄灰霉病菌对3种杀菌剂的抗药性检测
2014-02-28刘圣明高续恒张艳慧梅笑寒
刘圣明, 高续恒, 张艳慧, 李 梦, 梅笑寒
(河南科技大学林学院植物保护系,洛阳 471003)
灰霉病是由灰葡萄孢菌(Botr ytis cinerea Pers.ex Fr.)引起的一种世界性的重要病害,可为害番茄、黄瓜、茄子、西葫芦、草莓和葡萄等200多种作物,尤其在设施蔬菜上危害尤为严重[1-2]。灰霉病在番茄上发生严重时,造成番茄花、叶和果实的腐烂,影响产量和品质,严重时造成减产50%以上[3]。由于番茄种质资源中缺少高抗灰霉病的品种,生产上主要使用苯并咪唑类杀菌剂多菌灵(carbendazi m,略写为Ben)、二甲酰亚胺类杀菌剂腐霉利(procymidone,略写为Dic)和氨基甲酸酯类杀菌剂乙霉威(diethofencarb,略写为NPC)等药剂防治,但由于灰霉病菌具有繁殖快、遗传变异大和适合度高的特点,极易对杀菌剂产生抗药性[4-6]。
多菌灵等苯并咪唑类杀菌剂作用分子靶标单一,具有选择性强、高效、低毒的突出优点,自20世纪60年代末期创制以来,一直被广泛用于控制植物病害的流行和危害,是防治灰霉病应用最早的一类内吸性杀菌剂。此类药剂使用2~3年后,1971年Bollen等研究发现灰霉病菌对苯菌灵产生了抗药性[7],1987年周明国等在我国南京市郊区检测到灰霉病菌对多菌灵的抗药性菌株[8]。腐霉利等二甲酰亚胺类杀菌剂是20世纪70年代初推出的一类广谱性现代保护性杀菌剂,具有一定的局部治疗作用,是继苯并咪唑类杀菌剂之后防治灰霉病的又一类特效杀菌剂。Beever等早在1983年就检测到灰霉病菌大田抗药性菌株的存在[9]。乙霉威等氨基甲酸酯类杀菌剂是20世纪70年代中期以后发展起来的新型内吸性杀菌剂。乙霉威与苯并咪唑类杀菌剂存在负交互抗性,使用初期防治蔬菜灰霉病效果显著,但不久陆续发现了既抗多菌灵又抗乙霉威的灰霉病菌菌株[10-11]。随着多菌灵、腐霉利和乙霉威施药次数和施药量的不断增加,我国江苏、山西、辽宁和北京等地相继出现了单抗、双抗、甚至多抗的不同抗药性类型的灰霉病菌菌株[3,12-15]。
到目前为止,河南省番茄灰霉病菌对苯并咪唑类杀菌剂多菌灵、二甲酰亚胺类杀菌剂腐霉利和氨基甲酸酯类杀菌剂乙霉威的抗药性发生状况还未见报道。为了明确河南省番茄灰霉病菌对这3类杀菌剂的抗药性状况,作者从河南省不同保护地中采集、分离番茄灰霉病菌菌株,测定其对多菌灵、腐霉利和乙霉威的抗药性,为制定正确的防治灰霉病的策略及指导生产上合理用药提供依据。
1 材料与方法
1.1 菌株的采集和分离
2013年1-3月从河南省郑州市、洛阳市、开封市、新乡市和许昌市不同保护地中采集番茄灰霉病病果或病叶,采用马铃薯葡萄糖培养基(PDA)单孢分离获得灰霉病菌菌株139株(表1),用斜面培养基保存于4℃冰箱中备用。

表1 供试番茄灰霉病菌菌株及其来源Table 1 Isolates and their sources of Botr ytis cinerea in this study
1.2 供试药剂
97%多菌灵原药(江苏省镇江农药厂提供),预溶于0.1 mol/L盐酸配成10 mg/mL母液;
98%腐霉利原药(日本住友公司提供),预溶于丙酮,配制成10 mg/mL母液;
97.4%乙霉威原药(江苏省新沂农药有限公司提供),预溶于甲醇,配制成10 mg/mL母液。
1.3 供试培养基
PDA培养基:马铃薯200 g、葡萄糖20 g、琼脂15~20 g,加蒸馏水至1 000 mL。
1.4 含药培养基制备
将多菌灵、腐霉利和乙霉威母液系列稀释,按一定的比例分别加入到PDA培养基中,制成含多菌灵5μg/mL的PDA平板、含腐霉利5μg/mL的PDA平板和含乙霉威1μg/mL的PDA平板(在培养基灭菌后,温度降到45℃左右时加入药剂)。
1.5 灰霉病菌对多菌灵、腐霉利和乙霉威的抗性检测
采用最低抑制浓度法(MIC)检测番茄灰霉病菌对各药剂的抗药性。多菌灵和腐霉利鉴别浓度为5μg/mL,乙霉威的鉴别浓度为1μg/mL[14-17]。将待检测的灰霉病菌各菌株接种到PDA平皿上,23℃条件下培养3 d后,用打孔器在菌落边缘打出直径为5 mm的菌饼,然后用接种针挑取菌饼分别接种于多菌灵5μg/mL、腐霉利5μg/mL、乙霉威1μg/mL的含药平板上。23℃下培养3 d,观察生长情况,不能在该鉴别浓度上正常生长的菌株为敏感菌株,能正常生长的菌株为抗性菌株。统计各地区的敏感和抗性菌株的发生频率。
2 结果与分析
2.1 河南省番茄灰霉病菌的抗性频率及分布
2013年在河南省番茄灰霉病发生较为严重的不同保护地中采集番茄灰霉病病果或病叶,经单孢分离共获得灰霉病菌139株,其中,郑州33株,洛阳24株,开封25株,新乡26株,许昌31株。采用最低抑制浓度法(MIC)测定各菌株对多菌灵、腐霉利和乙霉威的抗药性。结果显示(表2),多菌灵敏感菌株26株,抗性菌株113株;腐霉利敏感菌株27株;抗性菌株112株;乙霉威敏感菌株9株,抗性菌株130株;对多菌灵、腐霉利和乙霉威的抗性频率分别为81.29%、80.58%和93.53%。表明河南省番茄灰霉病菌已对多菌灵、腐霉利和乙霉威产生抗药性。

表2 河南省番茄灰霉病菌对多菌灵、腐霉利和乙霉威的抗药性1)Table 2 Resistances of B.cinerea on tomato in Henan to carbendazim,procy midone and diethofencarb
从5个地区的测试结果可知(表2),许昌对多菌灵、腐霉利和乙霉威的抗性频率最高,分别为96.77%、100%和96.77%;新乡对多菌灵抗性频率最低,为69.23%;郑州对腐霉利和乙霉威的抗性频率最低,分别为60.61%和87.88%。表明各地区对多菌灵、腐霉利和乙霉威的抗药性程度不同。
2.2 河南省番茄灰霉病菌抗性类型
2013年采集的139株番茄灰霉病菌菌株,根据它们对多菌灵、腐霉利和乙霉威的抗、感性程度,可以分为BenRDicSNPCS(对多菌灵表现抗药性,对腐霉利、乙霉威表现敏感)、BenRDicRNPCS(对多菌灵、腐霉利表现抗药性,对乙霉威表现敏感)、BenRDicSNPCR(对多菌灵、乙霉威表现抗药性,对腐霉利表现敏感)、BenSDicRNPCR(对腐霉利、乙霉威表现抗药性,对多菌灵表现敏感)、BenSDicSNPCR(对乙霉威表现抗药性,对腐霉利和多菌灵表现敏感)和BenRDicRNPCR(对多菌灵、腐霉利和乙霉威均表现抗药性)6种表现型(表3)。BenRDicSNPCS类型的菌株有4株,所占比例为2.88%;BenRDicRNPCS和BenRDicSNPCR类型的菌株均有5株,各占3.60%;BenSDicRNPCR类型的菌株有7株,占5.04%;BenSDicSNPCR类型的菌株有19株,占13.67%;BenRDicRNPCR类型的菌株有99株,占71.22%。表明河南省番茄灰霉病菌对3种杀菌剂的表现型以BenRDicRNPCR类型为主,各地区在番茄灰霉病防治上,已连续多年普遍使用多菌灵、腐霉利和乙霉威,灰霉病菌已对这3种药剂产生严重的抗药性。
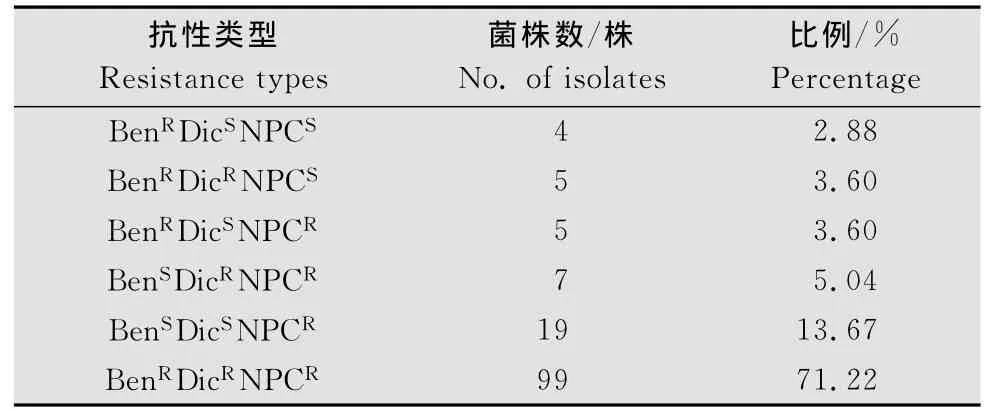
表3 河南省番茄灰霉病菌对多菌灵、腐霉利和乙霉威的抗药性表现型Table 3 Resistance types of B.cinerea on tomato in Henan to car bendazi m,procymidone and diethofencar b
3 结论与讨论
研究结果显示,河南省番茄灰霉病菌对多菌灵、腐霉利和乙霉威的抗性频率分别为81.29%、80.58%和93.53%,表明河南省番茄灰霉病菌已对苯并咪唑类杀菌剂多菌灵、二甲酰亚胺类杀菌剂腐霉利和氨基甲酸酯类杀菌剂乙霉威产生抗药性,继续单纯用多菌灵、腐霉利或乙霉威防治灰霉病已起不到应有的防治作用。苯并咪唑类杀菌剂、二甲酰亚胺类杀菌剂和氨基甲酸酯类杀菌都属于现代选择性杀菌剂,作用分子靶标单一,具有选择性强、高效、低毒的突出优点,但是灰霉病菌繁殖快、遗传变异大、适合度高,随着施药次数和施药量的不断增加,药剂选择压力不断提高,极易对杀菌剂产生抗药性[4-6]。王建新等在小麦赤霉病菌对苯并咪唑类杀菌剂多菌灵的抗药性研究中证实了药剂选择压力的提高有利于病原菌抗药性亚群体的快速发展[18]。目前,河南省各地区主要采用多菌灵、腐霉利和乙霉威防治番茄灰霉病,在灰霉病发生前期或初期开始使用,用药有效剂量40~60 g/667 m2,5~7 d用药1次,用药3~5次(数据未发表),药剂使用时间较长,施药次数较多,施药量较大,造成药剂的选择压力较大,致使灰霉病菌抗药性亚群体发生流行,对各药剂的抗性频率较高,与研究结果相符。5个地区的番茄灰霉病菌对多菌灵、腐霉利和乙霉威的抗药性表现不同,主要是由于各地用药历史和用药水平不同。
2011年乔广行等研究发现北京地区的灰霉病菌对多菌灵、腐霉利和乙霉威的表现型有BenRDicSNPCS、BenRDicSNPCR、BenSDicSNPCR和 BenRDicRNPCR4种表现型,以BenRDicRNPCR类型为主,所占比例为56.22%[3]。本研究结果显示,河南省番茄灰霉病菌对3种药剂的表现型有BenRDicSNPCS、BenRDicRNPCS、BenRDicSNPCR、BenSDicRNPCR、BenSDicSNPCR和BenRDicRNPCR6种,以BenRDicRNPCR类型为主,所占比例为71.22%,表明河南省番茄灰霉病的抗药性水平明显高于北京地区,目前不宜通过多菌灵、腐霉利和乙霉威混用来防治番茄灰霉病,否则,多抗菌株在药剂选择压力下可能迅速上升为优势群体,使得混用药剂失去防效。
为了延缓抗药性的进一步加剧,延长药剂的使用寿命,应科学选用合适的杀菌剂防治灰霉病。由于嘧霉胺、咯菌腈、氟啶胺与多菌灵、腐霉利和乙霉威无交互抗性[19-20],因此在抗性较严重的地区,可考虑选择嘧霉胺、咯菌腈和氟啶胺进行灰霉病菌对3类药剂抗性的治理,以有效防治灰霉病。同时应加强农业管理措施,做好抗性监测,避免单一杀菌剂的连续使用,加强生物生态控制技术的研究。
[1] Baptista F J,Bailey B J,Meneses J F.Effectof nocturnal ventilation on the occurrence of Botr ytis cinerea in mediterranean unheated to mato greenhouses[J].Crop Pr otection,2012,32:144-149.
[2] Williamson B,Tudzynski B,Tudzynski P,et al.Botr ytis cinerea:the cause of grey mould disease [J].Molecular Plant Pathology,2007,8:561-580.
[3] 乔广行,严红,么奕清,等.北京地区番茄灰霉病菌的多重抗药性检测[J].植物保护,2011,37(5):176-180.
[4] Malandrakis A,Mar koglou A,Ziogas B.Molecular character-ization of benzi midazole-resistant B.cinerea field isolates with reduced or enhanced sensitivity to zoxamide and diethofencarb[J].Pesticide Biochemistry and Physiology,2011,99:118-124.
[5] Jiang J H,Ding L S,Michailides T J,et al.Molecular characterization of field azoxystrobin-resistant isolates of Botrytis cinerea [J].Pesticide Biochemistry and Physiology,2009,93:72-76.
[6] Shinpei B,Fu miyasu F,Akihiko I,et al.Genotyping of benzi midazole-resistant and dicar boxi mide-resistant mutations in Botr ytis cinerea using real-ti me poly merase chain reaction assays[J].Phytopat hology,2008,98:397-404.
[7] Bollen G J,Scholten G.Acquired resistance to beno myl and so me other systemic f ungicides in a strain of Botr ytis cinerea in cyclamen[J].Netherlands Journal of Plant Pathology,1971,77:83-90.
[8] 周明国,叶钟音,刘经芬.南京市郊灰霉菌对苯并咪唑类杀菌剂田间抗性的检测[J].南京农业大学学报,1987,10(2):53-57.
[9] Beever R E,Brien H M R.A sur vey of resistance to the dicarboxi mide f ungicides in Botr ytis cinerea[J].New Zealand Journal of Agricult ural Research,1983,26:391-400.
[10]Katan T,Eald Y,Yunis H.Resistance to diet hofencar b(NPC)in benomyl-resistant field isolates of Botr ytis cinerea[J].Plant Pat hology,1989,38:86-92.
[11]Faretra F,Pollastro S.Genetics of sexual compatibility and resistance to benzi midazole and dicar boxi mide f ungicides in isolates of Botr yotinia f uckeliana (Botr ytis cinerea)from so me countries[J].Plant Pat hology,1993,42(1):42-48.
[12]潘以楼,朱桂梅,郭建.江苏草莓灰霉病菌对5种杀菌剂的抗药性[J].江苏农业学报,2013,29(2):299-304.
[13]韩巨才,刘慧平,闫秀琴,等.灰霉病菌对三种杀菌剂的抗性表现型分布及稳定性测定[J].农药学学报,2004,6(3):43-47.
[14]纪明山,程根武,张益先,等.灰霉病菌对多菌灵和乙霉威抗性研究[J].沈阳农业大学学报,1998,29(3):213-216.
[15]宋晰,肖露,林东,等.番茄灰霉病菌对腐霉利的抗药性检测及生物学性状研究[J].农药学学报,2013,15(4):398-404.
[16]张永杰,闫秀琴,韩巨才,等.山西省灰霉病菌对乙霉威的抗性监测[J].山西农业大学学报,2003,23(4):308-310.
[17]Sun H Y,Wang H C,Chen Y,et al.Multiple resistance of Botr ytis cinerea from vegetable crops to carbendazi m,diet hofencar b,procy midone,and pyri met hanil in China[J].Plant Disease,2010,94:551-556.
[18]王建新,周明国,陆悦健,等.小麦赤霉病菌抗药性群体动态及其治理药剂[J].南京农业大学学报,2002,25(1):43-47.
[19]乔广行,林秀敏,黄金宝,等.8种杀菌剂对番茄灰霉病菌多重抗药性菌株生物活性测定[J].农药,2013,52(1):57-59.
[20]陈治芳,王文桥,韩秀英,等.灰葡萄孢(Botr ytis cinerea)对氟啶胺的敏感基线及对不同杀菌剂的交互抗性[J].河北农业大学学报,2011,34(3):33-36.
