北京、山东和湖南地区烟粉虱抗药性及CYP4v2和CYP6CX1 mRNA水平表达量分析
2014-02-28王少丽吴青君徐宝云周小毛张友军
杨 鑫, 谢 文, 王少丽, 吴青君, 徐宝云, 周小毛, 张友军*
(1.湖南农业大学农药研究所,长沙 410128;2.中国农业科学院蔬菜花卉研究所,北京 100081)
烟粉虱(Bemisia tabaci Gennadius)属半翅目, 粉虱科,小粉虱属,是危害极为广泛的世界性害虫之一。烟粉虱属于刺吸式昆虫,取食寄主植物的汁液,通过直接刺吸为害、传播植物病毒、引起植物生理紊乱、分泌蜜露诱发真菌病害给作物生产造成巨大的经济损失[1-2]。烟粉虱于1889年首先发现于希腊烟草上,分布于世界100多个国家,由于地理差异和寄主广泛等原因逐渐形成多个复合种,目前报道的至少有32个隐种,不同隐种的烟粉虱在寄主范围、传毒能力、共生菌组成以及抗药性等方面都存在显著差异,在所有隐种中,B隐种和Q隐种烟粉虱入侵性最强,世界范围内分布最为广泛[3]。烟粉虱在我国最早报道于1949年[4],暴发于20世纪90年代,当时B隐种烟粉虱主要存在于广东、山东、河北、天津和北京等地,给农业、园艺及观赏作物产业造成了严重的经济损失[5-6]。2003年之前在我国发生为害的主要是B隐种烟粉虱,随后在河北、北京等地田间发现Q隐种烟粉虱,并且在2007年发现Q隐种烟粉虱逐渐取代B隐种烟粉虱成为主要为害种群[7-9]。
在害虫的防治措施中,化学防治占居重要地位,为延缓和阻止众多严重为害经济作物的害虫暴发做出了重要贡献。但是由于常年、广泛使用杀虫剂,导致很多地区害虫对一些种类的杀虫剂产生不同程度的抗药性,并且在全国监测发现Q隐种烟粉虱对于一些杀虫剂的抗性要高于B隐种烟粉虱,连年施用后抗药性也逐渐增强[10-12],所以连续的、适时的抗药性监测是烟粉虱综合防治的前提和基础。
烟粉虱的抗药性产生机制是多方面的。现在关于烟粉虱的抗药性研究主要集中在解毒酶上,Karunker和Roditakis研究发现细胞色素解毒酶P450家族的基因在B隐种和Q隐种烟粉虱的吡虫啉抗性中发挥重要的作用[13-15]。Xie[16]等通过 B隐种烟粉虱噻虫嗪抗性和敏感品系的转录组研究,发现CYP4v2基因在抗性品系中过量表达,同时Zhuang[17]等发现CYP6CX1的过量表达在烟粉虱对吡虫啉抗性中也产生一定贡献。
本研究对北京、山东和湖南三地的烟粉虱B、Q隐种类型进行了鉴定,同时测定了其对5种常用杀虫剂的抗药性,并且通过荧光定量PCR检测了CYP4v2和CYP6CX1基因在3个不同地区田间种群的mRNA水平表达情况,从而为解释田间抗药性形成机制和指导当地烟粉虱的化学防治提供科学依据。
1 材料与方法
1.1 烟粉虱试虫
2011年秋季,分别从北京海淀区中国农业科学院蔬菜花卉所实验基地(BJHD,39°57′N,116°19′E),山东济阳茄子田(SDJY,39°49′N,117°04′E)和湖南长沙农科院黄瓜大棚(CSHN,28°12′N,113°05′E)采集烟粉虱成虫。敏感种群为中国农业科学院蔬菜花卉研究所室内饲养种群(T H-S),该种群于2000年采自试验基地的甘蓝寄主上,实验室以甘蓝饲养至今,从未接触过任何杀虫药剂。田间采集的烟粉虱分别取300头活体成虫(分装于3个离心管,每管100头),液氮速冻5 min,然后保存于-80℃冰箱用于荧光定量PCR检测。
1.2 供试杀虫剂
25%噻虫嗪水分散粒剂(瑞士先正达作物保护有限公司产品)、1.8%阿维菌素乳油(北京中农大生物技术股份有限公司产品)、10%联苯菊酯乳油(苏州富美实植物保护剂有限公司产品)和48%毒死蜱乳油(美国陶氏益农公司产品)。
1.3 主要试剂
昆虫基因组DNA提取试剂盒、PCR产物回收试剂盒均购自北京百泰克生物技术有限公司;Taq酶,c DNA合成试剂盒(PrimeScript®RT reagent Kit)购自北京六合通经贸有限公司(Ta KaRa Biotech);TRIzol,荧光定量试剂盒(SYBR®Green Real-ti me PCR Master Mix)购自天根生化科技(北京)有限公司。
1.4 B、Q隐种鉴定
烟粉虱成虫B、Q隐种鉴定参照潘慧鹏[9]的方法进行。检测每个种群选取10头,单头提取DNA,依据B和Q隐种烟粉虱mt COI基因序列片段长度差异使用特异性引物进行鉴别(见表2),其中Q隐种烟粉虱的特异性片段为478 bp,而B隐种烟粉虱为303 bp。
1.5 抗药性监测
烟粉虱成虫对杀虫剂的生物测定方法采用浸叶法,具体操作参照Feng[18]。每种供试药剂配制6个浓度及1组空白对照,每个浓度4次重复,药剂配制加入0.1‰曲拉通X-100。在指形管底部铺上2%的琼脂约2 mL(管壁无水汽),将预先用打孔器打好的甘蓝叶片浸药10 s,晾干后背面朝上轻放于琼脂上。每管接入20~30头烟粉虱,用棉塞封口。指形管倒置于(25±1)℃,L∥D=14 h∥10 h的光照培养箱内,48 h后检查各处理的死亡数和存活数。
1.6 RNA提取和c DNA合成
每个样品取烟粉虱100头,采用TRIzol法提取总RNA,通过琼脂糖凝胶电泳检测RNA完整性,以及Nanodr op2000检测RNA浓度。取1.0μg RNA利用Pri meScript®RT reagent Kit合成c DNA ,方法按照产品说明书进行 (除去了基因组DNA)。
1.7 荧光定量PCR
荧光定量PCR引物参照Zhuang[17]进行(见表1),具体操作参照天根的荧光定量试剂盒说明书,稀释2倍的反转录产物作为模板,利用ABI7500进行基因mRNA水平表达量分析。荧光定量PCR反应体 系:SYBR Green Real-ti me PCR Master Mix(2×)11.25μL,PCR For war d Pri mer(10μmol/L)0.5μL,PCR Reverse Pri mer(10μmol/L)0.5μL,c DNA模板1.0μL,加入dd H2O 补足到25μL。Real-Ti me PCR反应程序为:95℃预变性3 min,接下来是40个循环,95℃变性30 s,61℃退火30 s,72℃延伸40 s(收集荧光信号);每个样品3次重复,PCR反应结束后进行相关数据分析。

表1 本研究中应用的引物1)Table 1 Pri mers used in this study
1.8 数据处理
生测结果分析采用Probit软件进行,计算各种群对不同杀虫剂的LC50值及其95%的置信区间、斜率及标准误。抗性倍数=所测种群的LC50/敏感种群的LC50。抗性分级标准参照刘凤沂等[19],抗性倍数小于3倍为敏感水平,3.1~5.0倍属于敏感性降低,5.1~10倍为低水平抗性,10.1~40倍为中等水平抗性,40.1~160倍为高水平抗性,160倍以上为极高水平抗性。
目的基因表达量以内参基因(Actin)作为标准进行相对定量,Actin基因在不同发育阶段和龄期的烟粉虱体内mRNA水平表达量稳定,可以作为内参基因。基因表达量分析以敏感种群T H-S作为对照种群,采用2-△△Ct方法计算:相对表达量=2-△△Ct=2-([E-F]-[A-B])。 其 中 A 为 对 照 种 群基因的Ct值;B为对照种群内参基因Ct值;E为待测田间种群基因的Ct值,F为待测田间种群内参基因Ct值,Ct值取3次重复相差不超过0.5Ct值的平均值。
2 结果与分析
2.1 隐种鉴定
从北京、山东和湖南烟粉虱样品中随机选取10头,提取基因组DNA后分别用B和Q鉴定引物进行PCR扩增,得到的片段长度约为478 bp,说明北京、山东和湖南地区供试烟粉虱均为Q隐种(见图1)。
2.2 抗药性监测
本研究中各样品采用成虫浸叶法进行抗药性生测,结果见表2。从表中可以看出,山东地区烟粉虱种群对阿维菌素的抗性水平比较高(14.2倍),达到中抗水平,北京地区和湖南地区种群对其都处于敏感状态。对于烟碱类杀虫剂噻虫嗪,三地种群都有不同程度的抗药性,其中长沙地区种群对噻虫嗪抗性水平最高,达到49.08倍,属于高抗水平。山东济阳和北京海淀对噻虫嗪的抗性水平相当,都处于中抗水平。由于所用的敏感种群对于毒死蜱不敏感,所以监测的3个田间种群毒死蜱的抗性水平都很低。湖南地区种群对联苯菊酯属于低抗水平(9.64倍),山东和北京地区的烟粉虱对联苯菊酯的抗性都 属于敏感水平。

图1 北京海淀、山东济阳和湖南长沙地区烟粉虱隐种鉴定Fig.1 Identification of B.tabaci sibling species in Haidian of Beijing,Jiyang of Shandong and Changsha of Hunan

表2 北京、山东和湖南地区烟粉虱对4种杀虫剂的抗药性Table 2 Resistance to four insecticides of B.tabaci from Beijing,Shandong and Hunan
2.3 荧光定量
以室内敏感种群T H-S烟粉虱为对照种群,通过荧光定量PCR分析了BJHD、SDJY和HNCS种群中CYP4v2和CYP6CX1基因的相对表达量(图2),相对于敏感种群发现CYP4v2基因在3个田间种群表达量显著提高,分别达到3.85倍,19.57倍和10.78倍,而CYP6CX1基因只是在BJHD种群中过量表达20.55倍,结果表明这两个P450基因在烟粉虱对药剂的田间抗性中可能起到重要作用。
3 讨论
1949年,我国首次发现烟粉虱,由于种群密度很低未形成危害[4]。直到20世纪90年代,世界超级害虫B隐种烟粉虱入侵我国,由于其很高的繁殖能力迅速在我国蔓延并造成严重的危害。而从2003年开始陆续在全国发现Q隐种烟粉虱,并且从2007年至今逐渐取代B隐种烟粉虱成为主要蔬菜花卉害虫。由于烟粉虱能够传播众多植物病毒,如烟粉虱传播的番茄黄化曲叶病毒导致很多番茄种植大棚减产甚至绝产,造成严重的经济损失[7-9],所以明确各地产生危害的烟粉虱隐种对于有效防治具有重要作用。
Q烟粉虱比B烟粉虱具有更强的抗药性,在田间复杂的环境中能对多种杀虫剂产生很高的抗药性,如 Wang[11]2008年在江苏地区发现具有1 900倍吡虫啉抗性和1 200倍噻虫嗪抗性的YC-Q种群,其他研究者也通过实验室筛选和田间采集获得具有很高抗药性的烟粉虱种群,表明烟粉虱具有产生很高抗药性的潜力[20-21]。
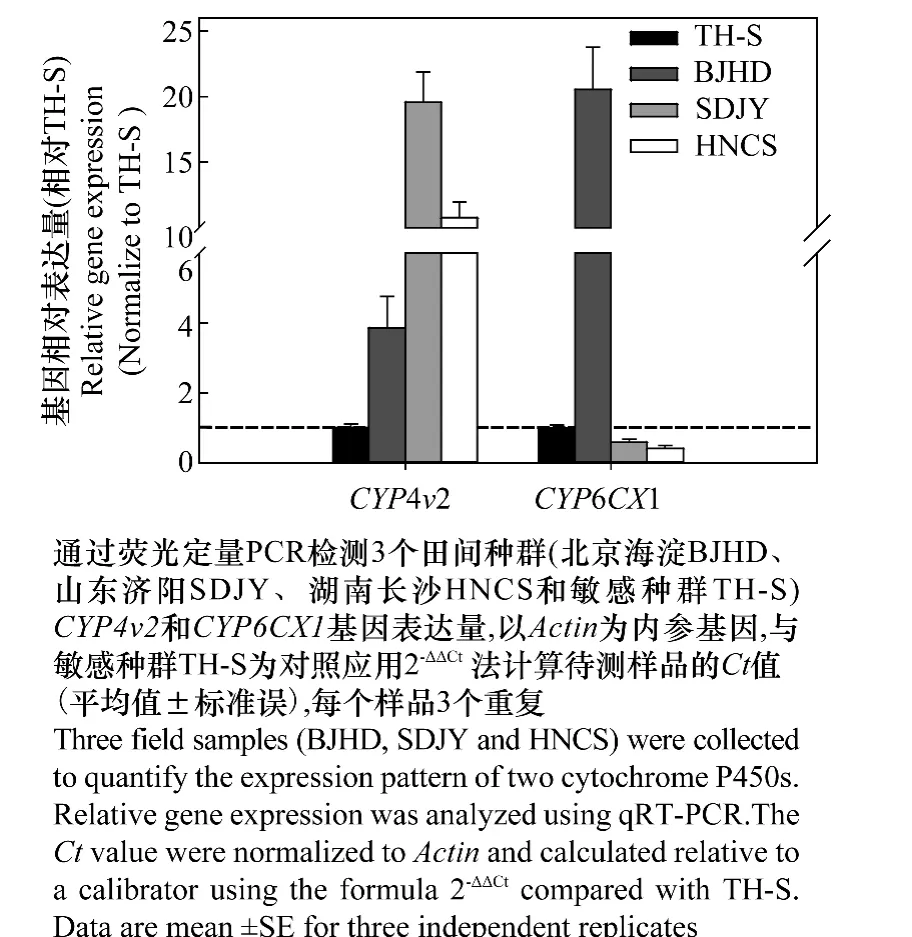
图2 田间烟粉虱的CYP4v2和CYP6CX1基因表达量Fig.2 Expression profiles of CYP4v2 and CYP6CX1 in B.tabaci from field samples
笔者采集北京、山东和湖南三地的烟粉虱样品,对4种常用杀虫剂进行了毒力测定。结果表明总体上北京地区烟粉虱对于大部分药剂的抗性水平要低于山东和湖南地区,其中对阿维菌素和联苯菊酯的抗药性都处于敏感水平,表明在北京地区施用这两类杀虫剂具有很好的防效。而对于传统药剂毒死蜱虽然抗性仍处于敏感水平,但是三地包括敏感种群的LC50值都相对比较高,表明该药剂对于防治烟粉虱效果不佳,同时该地区烟粉虱对于烟碱类药剂噻虫嗪的抗性程度也不高。在2008年,Luo[10]和王少丽[20]监测后发现噻虫嗪、吡虫啉抗性处于抵抗水平(LC50分别为6.45和4.11 mg/L),而2010年抗性达到中抗水平,2011年未发生显著上升,可能与该地区的施药习惯有关。山东济阳噻虫嗪LC50达到150.09 mg/L,抗性水平也达到7.84倍,属于低抗水平。同时对于田间防效较好的阿维菌素抗性水平达到14.2倍,原因可能是该类杀虫剂在山东地区大量施用后产生了较强的选择压力,所以促使了抗性的产生,该地区烟粉虱对其他药剂的抗性水平都较低。湖南长沙2010年烟粉虱为B隐种,2011年采集的烟粉虱为Q隐种,抗性水平也显著升高,其中以噻虫嗪最为明显,LC50由222.26 mg/L上升到938.46 mg/L,抗性倍数也显著升高,表明田间Q隐种烟粉虱比B隐种烟粉虱具有更高的杀虫剂适应机制,对某些药剂易形成抗药性,所以在该地区进行烟粉虱防治的过程中要选用有利于控制Q隐种烟粉虱的药剂。
田间害虫抗药性形成机制主要有两类,其一是杀虫剂作用靶标的改变,导致药剂的结合能力降低,从而产生较高的抗药性,如Liu[22]发现褐飞虱乙酰胆碱受体突变(Y151)形成了很高的吡虫啉抗性。而另一种产生抗药性的机制是害虫体内的解毒代谢作用引起的。解毒酶在昆虫抗药性产生过程中具有重要的作用,常见的解毒酶有多功能氧化酶、羧酸酯酶、谷胱甘肽转移酶等,其中细胞色素多功能氧化酶P450在多种昆虫中报道与抗性相关[23]。在烟粉虱体内,P450与抗药性的形成也有重要的关系,如Karunker报道的烟粉虱吡虫啉抗性与CYP6CM1基因过量表达有关,并且通过体外降解试验发现该酶能够代谢吡虫啉[13-14]。Xie等通过对B隐种烟粉虱噻虫嗪抗性和敏感品系的转录组研究,发现CYP4v2基因在抗性品系中过量表达可能与烟粉虱对噻虫嗪抗性有关[16];Zhuang等也发现田间抗药性的产生可能与CYP6CX1基因的过量表达有关[17];本研究也分析了北京、山东和湖南地区烟粉虱CYP4v2和CYP6CX1基因mRNA水平的表达量,发现相对于敏感种群CYP4v2基因在3个田间种群表达量显著提高,分别达到3.85倍,19.57倍和10.78倍,而CYP6CX1基因只是在BJHD种群中过量表达20.55倍,结果表明这两个P450基因的过量表达可能与北京、山东以及湖南地区的烟粉虱对噻虫嗪相对较高的抗药性有关,同时也有可能与其他药剂如毒死蜱、联苯菊酯较高的LC50有关,需要通过进一步的体外表达降解试验研究,来确定抗性机制。
由于田间环境的多样性以及野外烟粉虱遗传背景的复杂性,研究田间抗药性产生的机制是一个漫长而艰难的过程,需要通过进一步的研究分析来阐述烟粉虱抗药性的形成原因,为延缓和阻止烟粉虱的为害奠定理论基础,从而更好地进行防治工作。
[1] Wu J B,Dai F M,Zhou X P,et al.First reportof Tomato yellow leaf curl vir us in China[J].Plant Disease,2006,90(10):1359.
[2] Pan H P,Chu D,Zhang Y J,et al.Rapid spread of Tomato yellow leaf curl vir us in China is aided differentially by t wo invasive whiteflies[J].PLoS One,2012,DOI:10.1371/journal.pone.0034817.
[3] Br own J K,Czosnek H.Whitefly trans mission of plant vir uses[J].Advances in Botanical Research,2002,36:65-76.
[4] 周尧.中国粉虱名录[J].中国昆虫学,1949,3(4):1-18.
[5] 罗晨,张芝利.烟粉虱Bemisia tabaci (Gennadius)研究概述[J].北京农业科学,2000,18(S1):4-13.
[6] Ren S X,Wang Z Z,Qiu B L,et al.The pest status of Bemisia tabaci in China and non-chemical control strategies[J].Insect Science,2001,8(3):279-288.
[7] Chu D,Jiang T,Liu G X,et al.Biotype status and distribution of Bemisia tabaci (Hemiptera:Aleyr odidae)in Shandong Province of China based on mitochondrial DNA mar kers[J].Environmental Entomology,2007,36:1290-1295.
[8] Teng X,Wan F H,Chu D.Bemisia tabaci biot ype Q do minates other biotypes across China[J].The Florida Entomologist,2010,93:363-368.
[9] 潘慧鹏,戈大庆,张友军,等.在北京和河北局部地区Q型烟粉虱取代了B型烟粉虱[J].植物保护,2010,36(6):40-44.
[10]Luo C,Jones C M,Devine G,et al.Insecticide resistance in Bemisia tabaci biotype Q (Hemiptera:Aleyrodidae)fro m China[J].Cr op Pr otection,2010,29:429-434.
[11]Wang Z Y,Yan H F,Wu Y D,et al.Biotype and insecticide resistance status of the whitefly Bemisia tabaci from China[J].Pest Management Science,2010,66:1360-1366.
[12]Yuan L,Wang S,Wang J,et al.Status of insecticide resistance and associated mutations in Q-biotype of whitefly,Bemisia tabaci,from eastern China[J].Crop Protection,2012,31:67-71.
[13]Karunker I,Benting J,Lueke B,et al.Over-expression of cytochro me P450 CYP6CM1 is associated with high resistance to i midacloprid in the B and Q biotypes of Bemisia tabaci(hemiptera:Aleyr odidae)[J].Insect Biochemistry and Molecular Biology,2008,38:634-644.
[14]Karunker I,Moroub E,Nikoub D,et al.Structural model and f unctional characterization of the Bemisia tabaci CYP 6CM1v Q,a cytochro me P450 associated with high levels of i midacloprid resistance[J].Insect Biochemistry and Molecular Biology,2009,39:697-706.
[15]Roditakis E,Mor ou E,Tsagkarakou A,et al.Assess mentof the Bemisia tabaci CYP 6CM1v Q transcript and pr otein levels in laborator y and field-derived i midacloprid-resistant insects and cross-metabolism potential of the reco mbinant enzy me[J].Insect Science,2011,18:23-29.
[16]Xie W,Meng Q S,Zhang Y J,et al.Pyrosequencing the Bemisia tabaci transcripto me reveals a highly diverse bacterial co mmunit y and a r obust system for insecticide resistance[J].PLoS One,2012,DOI:10.1371/jour nal.pone.0035181.
[17]Zhuang H M,Wang K F,Wu G,et al.Identification and characterization of a cytochr o me P450 CYP6CX1 putatively associated with insecticide resistance in Bemisia tabaci [J].Insect Science,2011,18(5):484-494.
[18]Feng Y T,Wu Q J,Zhang Y J,et al.Fit ness costs and mor phological change of laboratory-selected thiamethoxam resistance in the B-type Bemisia tabaci (Hemiptera:Aleyr odidae)[J].Jour nal of Applied Ento mology,2009,133:466-472.
[19]刘凤沂,李惠陵,沈晋良,等.惠州地区褐飞虱对几种药剂的抗药性监测[J].昆虫知识,2010,47(5):991-993.
[20]王少丽,张友军,李如美,等.北京和湖南烟粉虱生物型及其抗药性监测[J].应用昆虫学报,2011,48(1):27-31.
[21]Vassiliou V,Emmanouilidou M,Perrakis A,et al.Insecticide resistance in Bemisia tabaci from Cyprus[J].Insect Science,2011,18(1):30-39.
[22]Liu Z,Williamson M S,Lansdell S J,et al.A nicotinic acetylcholine receptor mutation conferring target-site resistance to i midacloprid in Nil apar vata l ugens (bro wn plant hopper)[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(24):8420-8425.
[23]Qiu B L,Liu L,Li X X,et al.Genetic mutations associated with chemical resistance in the cytochr o me P450 genes of invasive and native Bemisia tabaci(He miptera:Aleyrodidae)populations in China[J].Insect Science,2009,16(3):237-245.
