三七总皂苷对大鼠肝缺血再灌注损伤的保护作用
2014-02-28李全辉纪志鹏葛运飞丁印鲁山东大学第二医院普外科济南250033
李全辉 纪志鹏 葛运飞 丁印鲁 山东大学第二医院普外科 济南 250033
肝脏缺血再灌注(HIR)是普外科临床常见的创伤后及肝脏手术后的病理生理过程,可导致严重的肝脏损伤,其具体损伤机制可能与氧化应激及炎症反应等途径有关[1-4]。三七,又名田七,是五加科人参属草本植物,其主要药理活性成分为三七总皂苷(panaxnonginsengsaponins,PNS),研究[5]表明其在神经系统、心血管系统等组织器官缺血再灌注损伤或其他损伤中均具有抗炎、抗氧化、抗肿瘤等作用。本研究利用大鼠肝缺血再灌注损伤模型,观察氧化应激及炎症相关指标变化,探讨三七总皂苷对肝脏缺血再灌注损伤的保护机制。
1 材料与方法
1.1 实验动物 雄性Spraque Dawley大鼠30只,体质量250~300g,购于山东大学实验动物中心。动物饲养合格证号:SCXK(鲁)20030004。术前予以自由进食饮水、恒温恒湿等规范化饲养。
1.2 实验试剂 三七总皂苷(粉剂,纯度99%,纯昆明植物研究所),MDA、SOD检测试剂盒(南京凯基生物公司),MPO、TNF-α、IL-1β、ICAM-1、ELISA 检测试剂盒(武汉博士德公司)。
1.3 动物分组及动物模型制备 30只大鼠随机分为假手术组(Sham组)、肝缺血再灌注组(HIR组)和三七总皂苷治疗组(PNS组),每组10只。三组均于术前禁食12h,戊巴比妥钠30mg/kg腹腔注射麻醉,参照Pringle法[6]构建肝缺血再灌注模型,Sham组仅暴露肝动脉、门静脉、胆管等肝门结构但不夹闭阻断,术后120min处死;HIR组及PNS组则夹闭肝门结构30min,开放再灌注180min后处死。PNS组术前1h予50mg/kg的PNS生理盐水溶液(浓度5mg/mL)腹腔注射,Sham组及HIR组则均于术前1h给予相同剂量的生理盐水腹腔注射。预处理3h后处死大鼠。
1.4 检测指标 ①丙二醛(malondialdehyde,MDA)测定:应用比色法测定大鼠缺血再灌注损伤后肝组织MDA含量以确定脂质过氧化水平,进而评估氧化应激水平。MDA在酸性和高温度条件下,可以与硫代巴比妥酸(thiobarbituric acid,TBA)反应生成红棕色的三甲川(3,5,5-三甲基恶唑-2,4二酮),最大吸收波长532nm。取大鼠肝脏组织100mg加入2mL PPS 50mmol/L液制成匀浆,超声粉碎10s×3次,根据MDA检测试剂盒说明操作,于分光光度计中计算MDA浓度。②超氧化物歧化酶(SOD)活性检测:肝组织匀浆SOD活性应用专用试剂盒测定,SOD活性单位以引起50%O2-歧化的酶含量表示。③髓过氧化物酶(MPO)检测:前述肝组织匀浆,应用MPO检测试剂盒检测,1U的MPO活力以25℃时1min分解H2O21mmol表示(U/g)。④炎症相关因子测定:血清肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)及肝组织中细胞间黏附因子-1(ICAM-1)含量均应用ELISA法检测。
1.5 统计学方法 实验数据以均数±标准差表示,采用SPSS19.0统计软件,将检验各组数据均符合正态分布,予单因素方差分析,其中方差齐性者,组间行SNK检验,方差不齐者,组间行Dunnett’s T3检验,P<0.05显示差异有统计学意义。
2 实验结果
2.1 三组氧化应激相关指标比较 肝缺血再灌注损伤组(HIR组)MDA水平较假手术组(Sham组)明显升高(P<0.05),而 SOD 活性则明显下降(P<0.05),三七总皂苷治疗组(PNS组)MDA水平较HIR组明显下降(P<0.05),且 SOD 活性明显上升(P<0.05),但与Sham组比较差异仍有统计学意义(P<0.05),见表1、图1。
2.2 三组炎症相关指标比较 HIR组肝组织中MPO活性、ICAM-1及血清TNF-α、IL-1β含量均较Sham组明显升高(P<0.05),而PNS组肝组织中MPO活性、ICAM-1及血清TNF-α、IL-1β含量虽较Sham组有显著升高(P<0.05),但较HIR组明显下降(P<0.05),见表 2、图 2~3。
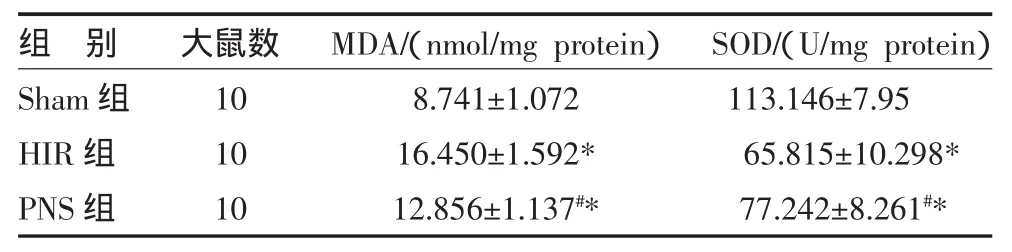
表1 三组大鼠肝组织氧化应激及内源性抗氧化指标比较
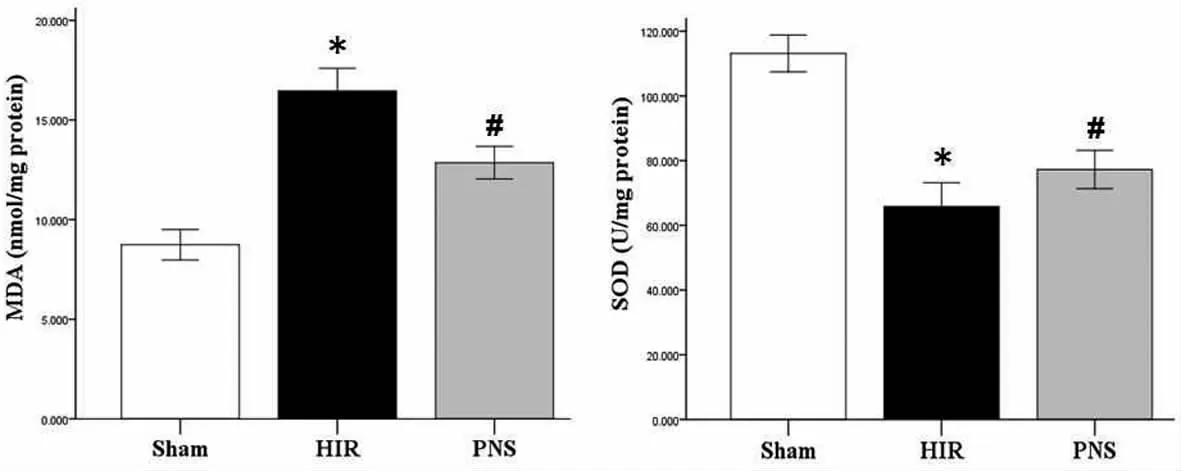
图1 三组大鼠肝缺血再灌注损伤后肝组织MDA及SOD变化注:Sham组:假手术组;H IR组:肝缺血再灌注损伤组;PNS组:三七总皂苷治疗组;MDA:丙二醛;SOD:超氧化物歧化酶

表2 三组大鼠肝组织及血清炎症相关指标比较

图2 三组大鼠肝缺血再灌注损伤后肝组织MPO、ICAM-1变化注:Sham组:假手术组;HIR组:肝缺血再灌注损伤组;PNS组:三七总皂苷治疗组
3 讨 论

图3 三组大鼠肝缺血再灌注损伤后
肝脏缺血再灌注损伤可以导致不同程度肝细胞肿胀、空泡变性,是一个复杂的病理生理过程,常见于肝脏外科手术、肝移植手术、低血容量性休克、肝静脉闭塞病、Budd-Chiari综合征等疾病及移植前的器官冷保存[7-9]。肝脏缺血再灌注损伤可导致肝代谢、解毒功能降低、循环阻力升高,乃至肝功能衰竭,进而影响患者预后。多种机制参与肝脏缺血再灌注损伤的发生发展过程,自由基引发的氧化应激可以导致肝脏氧化及抗氧化调节失去平衡,是肝脏缺血再灌注损伤发生发展的重要机制。已有研究表明,丙二醛(MDA)是生物体内自由基作用于脂质发生脂质过氧化的终产物,其含量水平可间接显示氧自由基对于机体细胞受攻击的程度[10],而超氧化物歧化酶(SOD)活性则反映了体内内源性抗氧化体系的功能,其可催化超氧阴离子自由基发生歧化反应,平衡体内氧自由基[11]。本研究表明缺血再灌注后肝组织MDA水平明显升高(P<0.05),内源性SOD活性则明显下降(P<0.05),进一步证实了氧化应激及内源性抗氧化体系失衡在缺血再灌注肝组织损伤中起重要作用,而PNS治疗后,虽然无法完全扭转这一失衡的趋势,但可以一定程度上减轻体内氧化应激及内源性抗氧化体系不平衡程度,进而表明,PNS可以通过减轻氧自由基损伤并改善内源性抗氧化体系功能来减轻肝组织缺血再灌注损伤。
此外,多种炎症相关因子的释放也参与了肝缺血再灌注损伤的病理生理过程。研究表明肝缺血再灌注损伤过程中导致缺血组织中性粒细胞黏附及迁移。在与内皮细胞交互作用下,结合黏附分子,中性粒细胞聚集可导致肝血窦阻塞、细胞毒性物质释放、Kuffer细胞激活等组织变化,进而引发肝组织损伤[12]。髓过氧化物酶(MPO)是中性粒细胞组织浸润程度的指标,已有研究及本实验均证实,缺血再灌注后肝组织MPO活性明显升高。ICAM-1参与中性粒细胞与内皮细胞之间黏附,是重要的黏附因子。TNF-α来源于巨噬细胞分泌,可以促进中性粒细胞在组织中的浸润,是重要的炎症介质。而IL-1β作为另一重要的致炎细胞因子可以诱导间质细胞分泌炎症相关蛋白酶(如MMP),并激活T细胞,参与组织炎症过程。TNF-α与IL-1β可以刺激组织ICAM-1表达,进而增加中性粒细胞浸润,加重组织损伤。本研究选取TNF-α、IL-1β、ICAM-1 作为 HIR 后炎症反应的主要指标,也证实缺血再灌注后肝组织TNF-α、IL-1β、ICAM-1均有不同程度升高,进而表明炎症反应与肝组织参缺血再灌注损伤的过程,与已有相关研究报道相符[2,12-14]。
三七总皂苷(PNS)为传统中药三七的主要活性成分,研究[5]证实,其在心血管系统、神经系统等组织器官中具有多种生理作用,具体药理机制与改善缺氧、降血糖、降血脂、改善微循环、抗氧化、抗炎、抗衰老等相关。研究[5]也表明,抗氧自由基损伤、减轻钙超载、抗炎等途径是其减轻肝组织缺血再灌注损伤的主要方式。本研究显示PNS治疗可以明显降低缺血再灌注后肝组织中MDA水平、MPO活性、ICAM-1含量及血清TNF-α、IL-1β,并明显升高SOD活性(P<0.05)。实验结果表明PNS可以通过抑制脂质过氧化并增强内源性抗氧化体系功能而减少肝缺血再灌注后氧化应激损伤,也可通过影响炎症介质释放及中性粒细胞浸润而减轻HIR损伤。
综上所述,三七总皂苷可以通过减少氧化应激水平以及炎症因子表达进而减轻肝缺血再灌注损伤,起肝脏保护作用,具有广泛的临床应用前景。
[1]廖喜望,卢绮萍,李德忠,等.大鼠肝脏缺血再灌注过程中信号转导与转录激活子1的表达变化及其意义[J].中华实验外科杂志,2009,26(10):1327-1329.
[2]张智勇,卢绮萍,陈孝平,等.丹参预处理对肝脏缺血再灌注后胃肠激素的影响[J].中华消化外科杂志,2014,13(3):213-217.
[3]刘作金,严律南.Kupffer细胞与肝脏缺血再灌注损害的研究进展[J].世界华人消化杂志,2008,16(24):2741-2745.
[4]冷建军,韩本立,董家鸿,等.肝脏缺血再灌注损伤机制和缺血预处理保护作用[J].消化外科,2005,4(2):142-148.
[5]马珂,汤金土.三七皂苷的实验研究进展[J].浙江中西医结合杂志,2002,12(3):197-封三.
[6]李绍强,梁力建,黄洁夫,等.依赖天冬氨酸特异性半胱氨酸蛋白酶-3的肝细胞凋亡在肝硬化大鼠肝缺血再灌注损伤中的作用[J].中国病理生理杂志,2001,17(6):519-522.
[7] Kim YI.Ischemia-reperfusion injury of the human liver during hepatic resection[J].J Hepatobiliary Pancreat Surg,2003,10(3):195-199.
[8] Jaeschke H.Mechanisms of reperfusion injury after warm ischemia of the liver[J].JHepatobiliary Pancreat Surg,1998,5(4):402-408.
[9]Bilzer M,Gerbes AL.Preservation injury of the liver:mech anisms and novel therapeutic strategies[J].JHepatol,2000,32(3):508-515.
[10] Petrache I,Birukova A,Ramirez SI,et al.The role of the microtubules in tumor necrosis factor-alpha-induced endothelial cell permeability[J].Am JRespir Cell Mol Biol,2003,28(5):574-581.
[11] Volanti C,Matroule JY,Piette J.Involvement of oxidative stress in NF-kappaB activation in endothelial cells treated by photodynamic therapy[J].Photochem Photobiol,2002,75(1):36-45.
[12]周进学,叶启发,明英姿,等.三七总皂苷对移植肝缺血再灌注后核因子-κ B、ICAM-1表达的影响[J].中国现代医学杂志,2005,15(9):1330-1332,1342.
[13]武凡,刘鹏年,马玉倩,等.三七皂苷Rg1、Rb1抗大鼠肝纤维化的作用及机制研究[J].河北医药,2013,(18):2731-2734.
[14]李剑瑜,刘毅,高波,等.三七皂苷Rg1对脂多糖诱导的大鼠肝细胞损伤的防护作用[J].环球中医药,2012,05(1):19-22.
