先天性胆总管囊肿癌变的临床研究
2014-02-27林间张翔曾永毅
林间 张翔 曾永毅
先天性胆总管囊肿是胆总管先天性的囊状或梭状扩张,也可伴有肝内胆管的扩张,该病具有癌变倾向[1],文献报道其癌变率为2.5%~28%[2],随年龄增长而逐步升高。先天性胆总管囊肿癌变的病例在临床上并不多见,且因其临床特点缺乏特异性,早期发现、诊断较困难,总体预后较差。近年来韩国一项多中心研究报道[3],该病预后类似胆管细胞癌,其中位生存期仅6~21个月。本文对我院手术治疗的11例先天性胆总管囊肿癌变病人的临床资料进行回顾性分析,并对相关问题展开分析讨论,探讨先天性胆总管囊肿癌变的临床特点、诊断、治疗及预后,以期对该病的诊治提供一些经验。
资料与方法
一、一般资料
回顾性分析我院2003年1月至2013年12月收治的133例先天性胆总管囊肿病人的临床资料。其中11例经手术和病理检查确诊癌变。11例中男性5例,女性6例;年龄30~64岁,平均年龄(52.2±10.1)岁。根据Todani分型,133例中I型89例,Ⅱ型3例,Ⅲ型1例,Ⅳ型40例,Ⅴ型0例。癌变病人中,I型7例,Ⅳa型4例。原发性癌变9例,内引流术后癌变2例。2例初次手术方式分别为:胆总管囊肿空肠Roux-en-Y吻合术1例,行胆囊切除、胆总管囊肿切除、肝管空肠吻合术1例。初次手术至癌变时间分别为8年、15年。
二、研究内容
研究内容包括病人的性别、年龄、囊肿类型、囊肿大小、临床表现、以及血清总胆红素(TB)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、癌胚抗原(CEA)、糖类抗原(CA)19-9、影像学诊断(B超、CT、MRI、MRCP)、手术方式、术后病理、术后辅助治疗(化疗、放疗、免疫治疗)及预后。对上述资料进行统计学分析,从而探讨先天性胆总管囊肿癌变的临床特点、诊断、治疗及预后。
三、随访方法
随访截至日期为2014年6月,中位随访时间为40个月。采用电话随访了解病人生活质量。病人定期返院或于当地医院复查,复查内容包括肝功能、CA19-9、B超或CT等影像学检查,若怀疑肿瘤复发、转移时再进一步全面检查(如全身骨显像等)。生存时间以手术日起至末次随访时间为准。11例病人随访率100%。
四、统计学分析
采用SPSS(18.0版)统计分析软件,计量资料采用t检验、计数资料采用χ2检验。生存预后的单因素分析采用Kaplan-Meier法。P<0.05为差异有统计学意义。
结 果
一、一般资料
133例先天性胆总管囊肿病人中,术后病理证实为癌变11例,癌变率为8.3%(11/133)。通过对病人术前临床资料的统计学分析(表1),结果显示,癌变组和非癌变组之间性别、囊肿类型、囊肿大小、腹痛、畏冷发热、腹部包块、恶心呕吐、ALT、AST、CEA差异无统计学意义;而两组间年龄、黄疸、体重减轻、TB、CA19-9差异有统计学意义。因此,我们认为年龄是胆总管囊肿癌变发生的危险因素;而黄疸、体重减轻、TB升高、CA19-9升高等因素有助于早期诊断胆总管囊肿癌变。另外,由于病例数偏少、不具备普遍代表性,故部分因素我们尚不能就本组数据确定其与胆总管囊肿癌变的发生是否相关,如术前合并胆道结石等。另外,11例癌变病人中,8例术前通过MRI增强+MRCP检查,发现有7例(87.5%)存在胰胆管汇合异常,故推测该因素可能与胆总管囊肿癌变的发生相关。

表1 先天性胆总管囊肿癌变与未癌变的临床特点比较
二、手术方式及术后并发症
11例癌变病人中9例为原发性胆总管囊肿癌变,其中7例行胰十二指肠切除术,1例因术中快速冰冻病理检查提示早期癌变,故行胆总管囊肿切除、胆囊切除术加肝管空肠Roux-en-Y吻合术,1例因术中探查发现腹腔广泛转移故行剖腹探查、腹腔肿物活检术。2例为内引流术后癌变,其中1例行胰十二指肠切除术,1例因腹腔广泛转移故行腹腔肿物活检术、T管外引流术。术后并发症包括:肺部感染1例,胰漏2例,予相应治疗后均好转出院。无围手术期死亡病人。
三、术后病理
术后病理包括乳头状腺癌7例,低度恶性的交界性黏液性囊腺瘤1例,囊腺癌1例,黏液腺癌1例,鳞癌1例。有6例伴有胰腺、十二指肠等周围脏器侵犯,有6例伴有淋巴结转移,详见表2。
四、术后辅助治疗及随访结果
本组病人术后辅助治疗情况及随访结果见表2。其中6例于术后14 d开始予“吉西他滨+顺铂”方案化疗2~6个周期(每个周期8 d,间隔13 d),化疗方案为“吉西他滨1 000 mg/m2(第1天、8天)+顺铂50 mg/m2(第1天)”。化疗期间出现不同程度的恶心、呕吐、骨髓抑制,予对症处理后均能耐受。11例病人中4例于术后1周开始配合免疫治疗,方案为胸腺肽α1一支皮下注射,每周2次,疗程半年。本组中11例病人均获随访,随访率为100%,中位随访时间40个月。术后出现转移共8例。其中1例因肝管空肠吻合口处转移于术后2个月配合三维适形放疗。1例因腹膜后淋巴结转移于术后7个月配合三维适形放疗。方法:CT以5 mm层厚在平静呼吸下连续全腹增强扫描,将图像传至治疗计划系统,沿CT上复发病灶的X、Y、Z轴各方向均外放5 mm为计划靶区。肝管空肠吻合口处转移病人以50%剂量曲线为处方剂量线,总放射剂量为49 Gy,分10次,1次/d,每周行5次治疗。腹膜后淋巴结转移病人以55%剂量曲线为处方剂量线,总放射剂量为50 Gy,分10次,1次/d,每周行5次治疗。1例因术后27个月出现肺部单发转移结节,予手术切除。1例术后4个月出现肝多发转移,行肝动脉插管化疗栓塞术1次。出现腹腔转移3例,出现腰椎及腹膜后淋巴结转移1例,以上4例均予对症处理。本组术后生存时间2~40个月,中位生存时间为14个月。目前有2例健康存活,余病人均已死亡。

表2 11例先天性胆总管囊肿癌变病人术后病理及随访资料
五、预后分析
总结临床相关资料,对胆总管囊肿癌变的预后采用Kaplan-Meier法生存分析,结果显示(表3,图1~3),手术方式、周围脏器侵犯、淋巴结转移、术后免疫治疗对于胆总管囊肿癌变病人预后有明显影响(P<0.05或P<0.01)。因本组病例数较少,未能进行多因素生存分析。
讨 论
先天性胆总管囊肿是一种少见疾病,先天性胰胆管汇合异常,产生胰胆反流及反复胆道感染是其主要致病因素[1],由于其存在癌变倾向可视之为一种癌前病变。关于影响胆总管囊肿发生恶变的相关危险因素,很多学者提出了各自的观点。相当一部分报道认为,胰胆管汇合异常在胆总管囊肿癌变过程中起着重要的作用。总结数个不同团队报道[4],凡行ERCP、PTC等相关检查确认的病例中大多数均合并有胰胆管汇合异常。Takahiko等[5]发现,合并胰胆管汇合异常的病人平均癌变年龄比未合并的病人小10岁。其可能机制为该解剖变异容易引起胰液反流,引发胆管上皮的慢性炎症,导致细胞异常增殖和凋亡,促进癌基因的激活及抑癌基因的失活,从而促进肿瘤的形成和发展。本研究11例癌变病人,有8例术前行MRCP检查,其中7例(87.5%)发现存在胰胆管汇合异常,提示该解剖异常为其癌变的重要相关因素,与上述观点符合。此外,许多国内外学者的研究证实[6-8],内引流手术史是先天性胆总管囊肿癌变的重要因素之一。常见的癌变部位是囊肿壁、胆囊、胆肠吻合口以及残余胆管。本研究11例病人中2例为内引流术后癌变,因入组病例较少,且本研究纳入随访的囊肿内引流术后病人偏少,随访时间不长,尚难以充分说明该因素与癌变的相关性。2例病人癌变部位,1例位于囊肿空肠吻合口处,1例位于术后胰腺段残余胆管,与日韩学者报道内引流术后常见的癌变部位相符[3,7-8]。高龄是目前较公认的胆总管囊肿癌变的高危因素,韩国一项多中心研究尚明确提出[3],年龄>40岁是一项癌变的危险因素。本组资料病例数虽较少,但统计学分析结果同样提示年龄是胆总管囊肿癌变的危险因素。因此我们认为,对于先天性胆总管囊肿病人一经确诊,应建议其尽早手术治疗,这与Wang等[9]观点一致。
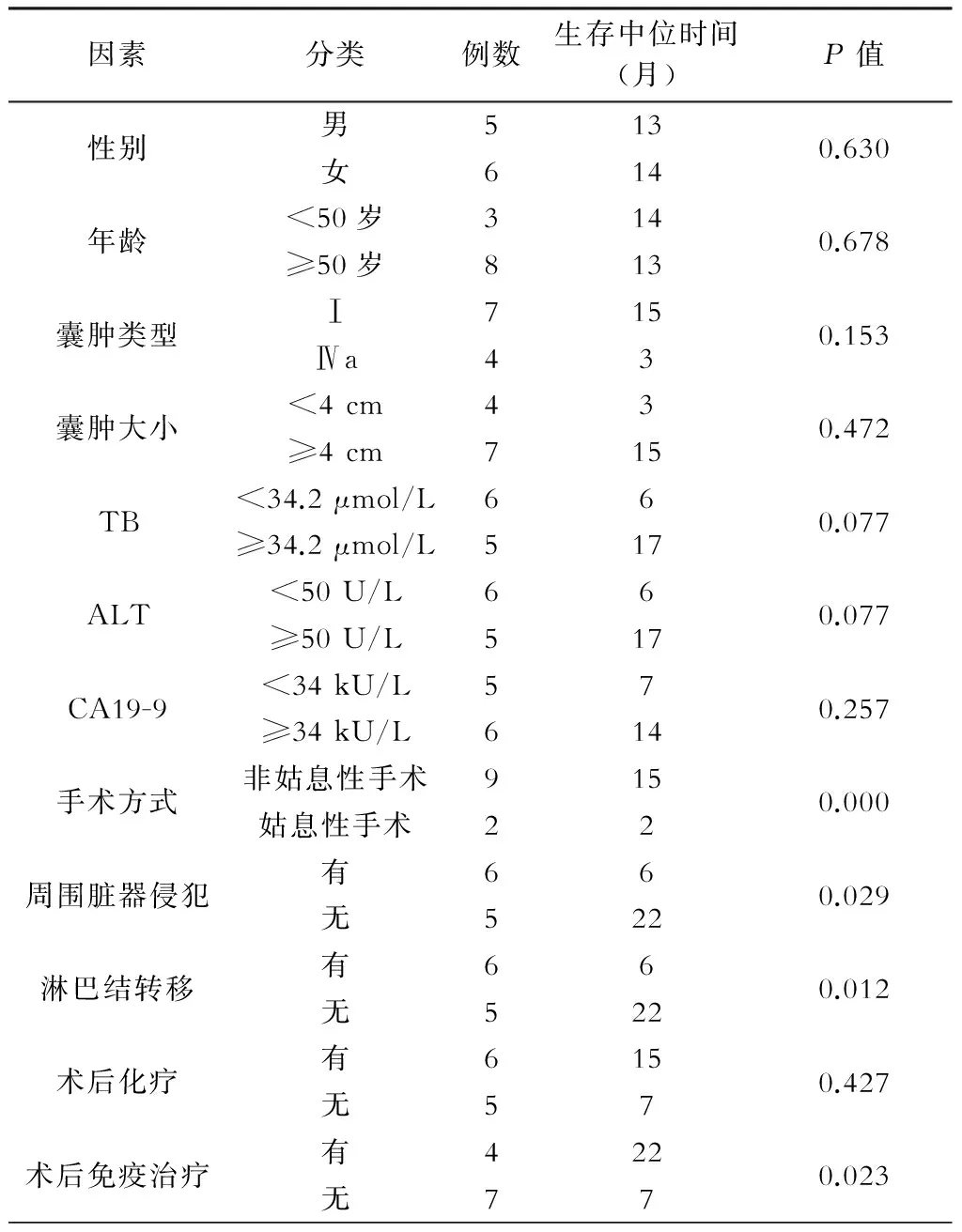
表3 单因素分析先天性胆总管囊肿癌变的预后

图1 先天性胆总管囊肿癌变病人是否存在周围脏器侵犯的预后生存曲线

图2 先天性胆总管囊肿癌变病人是否存在淋巴结转移的预后生存曲线

图3 先天性胆总管囊肿癌变病人是否术后采用免疫治疗的预后生存曲线
过去的研究显示先天性胆总管囊肿癌变病人早期诊断不易,其临床表现较胆总管囊肿伴慢性胆管炎差异并不明显,而实验室检查包括血清肿瘤标志物对筛选早期癌变的帮助也很有限[10]。但Lee等[11]认为,高龄的先天性胆总管囊肿病人,如存在黄疸,需警惕癌变可能。而韩国学者通过对808例先天性胆总管囊肿病人临床资料的分析,发现CA19-9升高是癌变的一项独立危险因素[3]。分析本组资料,提示黄疸、体重减轻、TB升高、CA19-9升高对于诊断胆管囊肿癌变是否癌变有统计学意义。先天性胆总管囊肿癌变影像学诊断方法包括了CT、B超、MRI、MRCP、ERCP等[12-13]。既往报道[14]提示ERCP可动态观察胰胆管形态改变,可作为诊断先天性胆总管囊肿癌变的重要检查手段。我们考虑MRCP同样可从各角度的显示肝内外胆管、胰管的走形,并对胆总管囊肿进行分型,且为无创性检查[15],故本组病例术前主要选择MRI +MRCP检查,结果亦较理想。因此我们认为,当临床上发现高龄病人存在近期体重减轻、黄疸、血CA19-9升高时,需警惕癌变可能,可建议其行MRI +MRCP检查,必要时联用B超、CT等其他影像学检查手段,有助于早期确诊先天性胆总管囊肿癌变。
对于先天性胆总管囊肿癌变病人的手术治疗,Ishibashis等[6]认为确诊后对无淋巴结转移的病例可行囊肿切除,肝管空肠Roux-en-Y吻合术;对伴有胰头浸润的病例可行囊肿切除、胆囊切除及胰十二指肠切除术;对局部浸润明显,囊肿完整切除困难的病例,可行囊肿部分切除、肝管空肠Roux-en-Y吻合术。本研究除2例晚期病例外,8例行胰十二指肠切除术,1例行胆总管囊肿切除、胆囊切除术加肝管空肠Roux-en-Y吻合术。其中术前诊断提示侵犯胰腺、十二指肠等周围脏器4例,淋巴结转移2例,而经术后病理证实伴随周围脏器侵犯6例(54.5%),淋巴结转移6例(54.5%)。因此,我们认为先天性胆总管囊肿癌变病人确诊后常已存在肿瘤周围脏器侵犯、淋巴结转移等情况,且术前检查并不一定能确切地发现早期转移病灶,而本研究统计学结果提示手术方式、周围脏器侵犯、淋巴结转移对于胆总管囊肿癌变病人预后有明显影响;故除术前术中可确诊为早期癌变的病例外还是应尽量选择行胰十二指肠切除术并彻底清扫引流区域淋巴结,有助于延长病人生存期,改善预后。
本病早期诊断困难,单纯手术切除效果欠佳,预后较差,现有报道术后生存时间仅4~31个月[18]。因此,我们采用以手术治疗为主,化疗、放疗、免疫治疗为辅的综合抗肿瘤治疗,较单纯手术治疗相比,病人生存期有所延长。目前,国内外对先天性胆总管囊肿癌变的化疗方案尚无定论。由于腺癌是其最常见的一种病理类型[17],在本组11例病人中,腺癌占9例(81.8%)。故我们借鉴国外学者经验[18],参照胆管癌化疗方案,采用“吉西他滨+顺铂”方案化疗。但本研究发现,术后化疗对于胆总管囊肿癌变病人预后无显著性差异。考虑到病例数较少,且选择化疗病人肿瘤分期相对较晚,因此尚有待今后大样本量、前瞻性的研究以证实该结论。
本研究11例癌变病人中,有2例因术后复发转移而行三维适形放疗,经治疗后转移病灶生长速度及局部压迫症状可获得一定程度的控制,治疗期间病人耐受良好,未发现明显副反应,但目前病例数偏少,仍有待日后扩大病例数以评估其利弊。11例中有4例术后辅予免疫治疗,方案为皮下注射胸腺肽α1。胸腺肽α1是一种免疫调节剂,一方面可增强细胞免疫,提高机体对肿瘤细胞的免疫应答能力及肿瘤组织的免疫原性,另一方面也可恢复因手术及术后化疗受损的抗感染能力[19]。分析随访结果显示,术后采用免疫治疗的病人,预后明显好于未采用免疫治疗的病人(如本文图3所示)。因此可考虑将其作为术后的一种常规辅助治疗推广应用。此外,本组1例术后发现肺部单发转移灶病人,经行手术切除肺部病灶后,随访至今未再发现新发转移灶。结合近年来对孤立性肺转移灶手术切除治疗的研究结果,我们认为,积极手术治疗切除单发的肺转移灶对改善预后是有帮助的。
1 Tyson GL, El-Serag HB. Risk factors for cholangiocarcinoma. Hepatology, 2011, 54: 173-184.
2 Sagawa T, Okamura S,Kakizaki S,et al. Functional gastrointestinal diseases in adolescents and quality of school life. J Gastroenterol Hepatol,2013, 28: 285-290.
3 Lee SE, Jang JY, Lee YJ, et al. Choledochal cyst and associated malignant tumors in adults: a multicenter survey in south korea. Arch Surg,2011,146:1178-1184.
4 Cho MJ, Hwang S, Lee YJ, et al. Surgical experience of 204 cases of adult choledochal cyst disease over 14 years. World J Surg, 2011,35:1094-1102.
5 Funabiki T,Matsubara T,Miyakawa S,et al.Pancreaticobiliary maljunction and carcinogenesis to biliary and pancreatic malignancy. Langenbecks Arch Surg, 2009, 394: 159-169.
6 Ishibashi T, Kasahara K, Yasuda Y,et al. Malignant change in the biliary tract after excision of choledochal cyst. Br J Surg,1997,84:1687-1691.
7 Ono S, Sakai S, Kimura O, et al. Development of bile duct cancer in a 26-year-old man after resection of infantile choledochal cyst. J Pediatr Surg,2008,43:E17-E19.
8 Ono S, Fumino S, Shimadera S,et al. Long-term outcomes after hepaticojejunostomy for choledochal cyst:a 10- to 27-year follow-up. J Pediatr Surg,2010,45:376-378.
9 Wang DC, Liu ZP, Li ZH, et al. Surgical treatment of congenital biliary duct cyst. BMC Gastroenterol,2012, 12: 29.
10Gong L, Qu Q, Xiang X, et al. Clinical analysis of 221 cases of adult choledochal cysts. Am Surg,2012,78: 414-418.
11Lee KF, Lai EC, Lai PB. Adult choledochal cyst. Asian J Surg, 2005,28:29-33.
12Law R, Topazian M. Diagnosis and treatment of choledochoceles. Clin Gastroenterol Hepatol,2014,12: 196-203.
13Sallahu F, Hasani A, Limani D, et al. Choledochal cyst - presentation and treatment in an adult. Acta Inform Med,2013, 21: 138-139.
14Liu QY, Lai DM,Gao M,et al. MRI manifestations of adult choledochal cystsassociated with biliary malignancy:a report of ten cases. Abdom Imaging, 2013,38:1061-1070.
15Sacher VY, Davis JS, Sleeman D, et al. Role of magnetic resonance cholangiopancreatography in diagnosing choledochal cysts: Case series and review. World J Radiol,2013,5:304-312.
16刘颖斌, 马孝明, 王建伟, 等. 先天性胆总管囊肿癌变20例报告. 中国实用外科杂志,2007,27: 723-724.
17Terada T.Adenosquamous carcinoma in a congenital choledochal cyst associated with pancreatico-biliary maljunction. Pathol Int,2009,59:482-485.
18Valle J, Wasan H, Palmer DH, et al.Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer. N Engl J Med,2010,362:1273-1281.
19Robert G.Gish,Stuart C.Gordon,et al.A randomized controlled trial of thymalfasinplus transarterial chemoembolization for unresectable hepatocellular carcinoma.Hepatol Int,2009,3:480-489.
