腹腔镜下电子胃镜手术治疗胃间质瘤38例
2014-02-27孔延龙于建平韩晓鹏朱万坤刘宏斌
孔延龙,于建平,韩晓鹏,朱万坤,苏 琳,刘宏斌
腹腔镜下电子胃镜手术治疗胃间质瘤38例
孔延龙,于建平,韩晓鹏,朱万坤,苏 琳,刘宏斌
目的探讨经腹腔镜下电子胃镜手术治疗胃间质瘤(GSTs)的安全性及可行性。方法 对2008年8月—2012年8月我院应用电子胃镜定位后腹腔镜下行胃腔外肿瘤楔形切除术38例GSTs的临床资料进行回顾性分析。结果 38例行胃肿瘤楔形切除术手术时间(82.4±31.6)min,术中出血量(32.2±13.8)m l,术后住院(5.8±1.6)d。术后无吻合口出血、吻合口漏、切口感染等并发症。35例获得随访,术后随访6~48个月,均未见复发。结论经腹腔镜下电子胃镜治疗GSTs具有定位准确,手术时间短,并发症少等优点,安全可行。
腹腔镜检查;胃镜检查;肠胃间质瘤
Mazur等[1]于1983年首次提出胃肠道间质瘤(gastrointestinal stromal tumor,GIST)的概念,是起源于胃肠道原始非定向多潜能间质干细胞,其组织学形态有梭形细胞、上皮样细胞或多形性细胞。Hirota于1998年发现GIST c-kit基因的突变,KIT蛋白产物(CD117)是GIST的高特异性的标记物[2]。近年研究表明GIST少有通过淋巴结途径转移,不需行大范围的淋巴结清扫,对于<5 cm的肿瘤可行局部切除。Lukaszczyk等[3]于1992年首次成功通过腹腔镜下切除GIST。随着腹腔镜技术的发展,其微创效果得到越来越多的人认可,但腹腔镜下对胃肠道病变范围较小的肿瘤和一些特殊部位的肿瘤(腔内生长或胃后壁),往往存在定位困难等技术方面的不足,导致手术效果不满意[4-5]。因此,术中电子胃镜协助定位,经腹腔镜切除胃肠道肿瘤(双镜联合)具有重要的临床意义。我院2008年8月—2012年8月对收治的38例胃间质瘤(GSTs)术中应用电子胃镜定位,成功行经腹腔镜下胃腔外肿瘤楔形切除、胃部分切除术,现报告如下。
1 资料与方法
1.1 一般资料 本组38例,男21例,女17例,年龄31~69岁,平均55.9岁。术前均行电子胃镜及电子超声胃镜检查示胃黏膜下肿物,直径2.0~4.0 cm,边界清楚,其中3例肿物表面有小溃疡。影像学诊断均考虑为GSTs。肿瘤位于贲门下方小弯侧8例,胃底部12例,胃体部15例(其中胃体前壁11例、胃体后壁4例),胃窦部3例。术后病理均明确诊断GSTs。
1.2 手术方法 气管插管全麻下,患者仰卧位,双腿分开,呈“大”字形。于脐下作弧形10 mm小切口,以气腹针穿刺入腹腔,充入 CO2气体造成12 mmHg气腹。拔出气腹针,以套管针穿刺腹腔,插入腹腔镜。腹腔镜明视下分别于双侧锁骨中线脐水平、双侧腋中线平肋缘作小切口(术者及一助右手操作部位置入12 mm Trocar,左手部位置入5 mm Trocar,以方便操作),经戳孔置入超声刀、抓钳等。腹腔镜下暴露胃体,确定瘤灶位置。对于肿瘤较大,向胃腔外突出者,可通过腹腔镜明确肿瘤位置,无需经电子胃镜配合;若肿瘤较小或肿瘤向胃腔内生长,通过腔镜无法确定肿瘤位置,则需经口腔置入电子胃镜观察胃内病变,确定瘤灶位置。依据术前胃镜及电子超声胃镜对肿瘤的初步定位,调整胃镜探头的角度及位置,施行胃镜定位者和腹腔镜术者在胃壁内外相互配合,通过器械挤压胃壁,并在腔镜高清图像中观看从胃腔内透出的光亮,准确定位肿瘤(图1A、B)。手术切除方法选择:①胃前壁(11例):直接用腔内直线型切割闭合器(Endo-GIA)闭合瘤体,或分离网膜等毗邻结构楔形切除(图1C);②胃后壁或胃底(胃体后壁4例,胃底10例肿瘤较小者):在横结肠上缘无血管区用超声刀剪开胃结肠韧带,将横结肠系膜之前叶分离。向右游离至胃窦部,向左至胃网膜左动脉,钛夹夹闭后离断,将胃挑起,继续游离胃后韧带至膈肌脚;沿脾胃韧带以超声刀向上游离至贲门左侧;彻底暴露胃后壁或胃底肿瘤,腔镜明视下Endo-GIA在距离病灶边缘>2 cm的范围将胃连同病灶一起离断闭合瘤体或楔形切除瘤体,止血;③对于胃底或胃窦部较大肿瘤并向胃腔内生长者(胃窦3例,胃底2例),需行近侧胃或远侧胃部分切除术。标本的移除:较小肿瘤,可放入取物袋内自12 mm戳孔中取出。对于较大肿瘤者,无法从戳孔中取出,则需于上腹正中或顺延戳孔取一小口,长3~5 cm(视肿瘤大小相应调整),逐层切开进腹,置入切口保护套,保护切口,将游离的标本移除腹腔,观察肿瘤是否完整,周围切缘是否足够(图1D)。标本送冷冻病理检查,确保完整切除及排除胃癌可能。

图1 胃间质瘤腹腔镜及电子镜肿瘤定位及切除
2 结果
38例均成功施行腹腔镜手术,无中转开腹(其中2例行远侧胃次全切,于上腹正中取3~5 cm小切口,在保护套下取出标本)。手术时间30~144(82.4±31.6)min、术中出血量20~100(32.2±13.8)ml、术后胃管留置时间10~14 h,肠道功能恢复时间12~48 h、下床活动时间8~20 h、术后24~48 h恢复流质饮食、术后住院时间5~8(5.8±1.6)d。术后无吻合口出血、吻合口漏、切口感染等并发症。免疫组织化学结果:CD117阳性35例(92.1%),CD34阳性28例(73.7%)。生物学风险分级:极低度风险22例(图2A),免疫组化显示:瘤组织 CKp(-),Vimentin(++),CD117(+),CD34(+),Dog-1(+),SMA(-),S-100(-),Ki-67 <5%;低度风险11例(图2B),免疫组化显示:瘤组织CKp(-),Vimentin(++),CD117(++),CD34(++),Dog-1(++),SMA(-),S-100(-),Ki-67<5%。中度风险3例。高度风险2例(图2C),免疫组化显示:瘤组织 CKp(-),Vimentin(++),CD117(+++),CD34(+++),Dog-1(+++),SMA(- ),S-100(-),Ki-67核阳性细胞灶性 >10%,Desmin(-)。切缘均未见瘤体组织。随访6~48个月,均未见复发。术后石蜡切片病理诊断示GSTs。术后35例疼痛轻微,3例感疼痛,给予盐酸哌替啶肌内注射,疼痛缓解。术后35例(92.1%)获得随访,时间6~48个月,平均26个月。随访病例经CT、电子超声胃镜检查未发现复发及转移。
3 讨论
GIST是一种起源于Cajal细胞的胃肠道非上皮源性间质肿瘤,占胃肠道肿瘤的3%,其中GSTs约占GIST的60%[6]。GIST是一种具有多向分化潜能并具有潜在恶性的肿瘤,其恶性程度主要与瘤体大小及核分裂数目相关。目前研究认为,CD117阳性表达是诊断GIST的金标准[7-8]。GSTs主要是通过血行转移到肝脏[9],临床上也可见淋巴结转移,但术中一般无需淋巴结清扫[10-11]。对未转移的GSTs患者,手术切除是治疗的首选[12]。手术切除的关键是肿瘤完整切除并尽可能保留胃的功能,重点强调切缘无转移[9,12]。
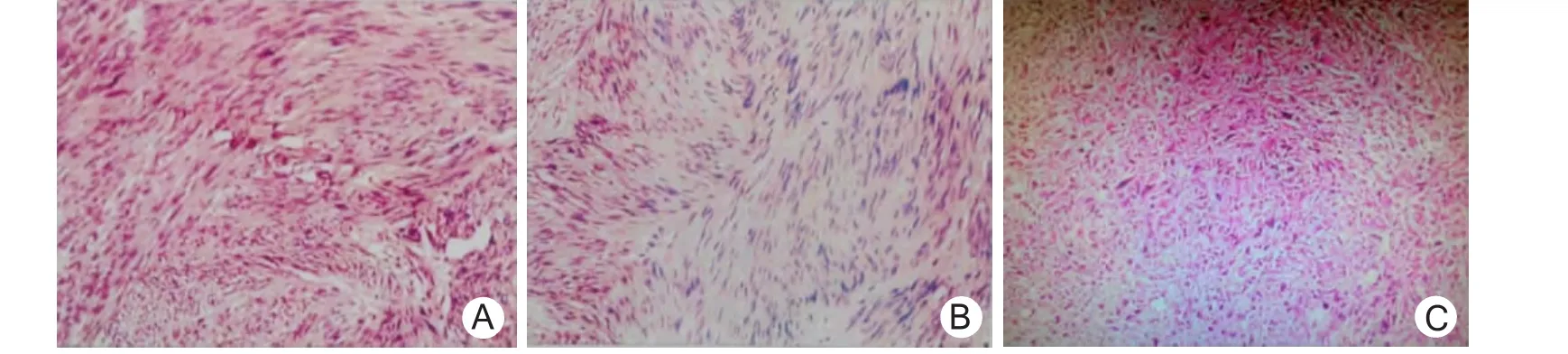
图2 胃间质瘤切除组织免疫组化结果(HE×100)
1992年Lukaszczyk等[3]首先报道了通过腹腔镜成功切除 GIST,Nguyen等[13]通过大宗的病例研究,认为通过腹腔镜行GIST切除术在并发症及病死率方面与传统手术比较无明显差异,是安全可行的。随着工业科技的发展,腹腔镜器械发展和腹腔镜手术技术日益成熟,Endo-GIA可直接将标本切除并一次性完成吻合,大大简化了手术的过程,缩短了手术时间。但是单纯行腹腔镜下GSTs切除在临床仍存在一些技术方面的难点:①肿瘤较小或瘤体向腔内生长时难以精确定位,手术操作有一定的盲目性;②腔镜下操作,视野局限,但手术要求较高,需要肿瘤完整切除,切缘无转移,还要保留胃的功能。
电子胃镜联合腹腔镜(LGCS)手术切除GSTs在一定程度充分发挥了双镜的优势,弥补了单一腹腔镜在GSTs手术切除方面的弱项,充分显示了其在微创外科的临床应用价值。电子胃镜能够精准地为肿瘤定位并协助其完成手术。同时腹腔镜手术在胃镜直视定位下进行病灶完整切除,可保证切缘的阴性,还可尽量保留正常胃壁组织,减少对胃正常功能损伤。同时可通过胃镜检查有无狭窄、漏气,确保了手术质量[14]。
LGCS手术中的关键点是病变的定位。术中应用胃镜活检钳在胃镜直视下将病变处黏膜向外推动或从腔镜高清图像中观看从胃腔内透出的光亮,准确定位肿瘤,以达到定位目的。本组38例GSTs,36例在双镜联合下成功利用Endo-GIA局部直线切除或楔形切除,2例因肿瘤较大,位居贲门或胃窦部,为避免术后出现狭窄,行胃部分切除。通过本组研究,笔者体会下列情形需采用LGCS切除GSTs:①肿瘤横径<5 cm并向腔内生长;②肿瘤位于胃后壁,术中预计寻找瘤体有困难;③瘤体较小单纯性腹腔镜下无法探及;④术前通过电子超声胃镜及CT检查肿瘤未侵犯周围脏器及腹腔转移。本组38例应用双镜联合的方法,均准确定位肿瘤并确定肿瘤范围,顺利通过腹腔镜完成GSTs切除,达到微创的效果。
LGCS技术在近年来是一种新型微创外科手术,在治疗GSTs中有重要的临床应用价值。与传统的开放性手术相比,具有创伤小、手术时间短、出血少、术后恢复快等优点[15-18]。内镜下黏膜下切除适应证较窄,一旦穿孔需急诊二次手术,内镜与腹腔镜联合手术能相互补充不足,相辅相成,较单纯腹腔镜手术、内镜治疗更安全、术后并发症更少、复发率更低[19]。临床经验:①不能盲目追求小切口或无切口,防止取标本时肿瘤破裂播散;②腹腔镜定位后,胃镜再次明确是否抓取准确,确保一次性整块切除;③手术医师、器械护士、胃镜技师为一固定团队。随着腹腔镜手术的广泛开展,手术者操作水平的提高,超声刀及Endo-GIA的合理使用,以及临床外科医师的不断探索,双镜联合技术缩短了手术时间,减少了手术创伤,将有更广泛的发展空间。
[1] Mazur M T,Clark H B.Gastric stromal tumors.Reappraisal of histogenesis[J].Am J Surg Pathol,1983,7(6):507-519.
[2] 师英强,杜春燕.胃肠道间质瘤临床治疗进展[J].实用肿瘤杂志,2003,18(4):263-265.
[3] Lukaszczyk J J,Preletz R JJr.Laparoscopic resection of benign stromal tumor of the stomach[J].J Laparoendosc Surg,1992,2(6):331-334.
[4] 仇明,沈炎明,郑成竹,等.电视腹腔镜技术在胃肠外科的应用[J].中华医学杂志,1996,76(2):92-95.
[5] Sasaki A,Koeda K,Obuchi T,et al.Tailored laparoscopic resection for suspected gastric gastrointestinal stro-mal tumors[J].Surgery,2010,147(4):516-520.
[6] Bertolini V,Chiaravalli A M,Klersy C,et al.Gastrointestinal stromal tumors-frequency,malignancy,and new prognostic factors:the experience of a single institution[J].Pathol Res Pract,2008,204(4):219-233.
[7] Miettinen M,Lasota J.Gastrointestinal stromal tumorsdefinition,clinical,histological,immunohistochemical,and molecular genetic features and differential diagnosis[J].Virchows Arch,2001,438(1):1-12.
[8] 饶旭光,杨伟,马立民,等.13例食管贲门间质瘤的诊断和治疗[J].中国肿瘤临床,2008,35(10):566-567.
[9] Ponsaing L G,Hansen M B.Therapeutic procedures for submucosal tumors in the gastrointestinal tract[J].World JGastroenterol,2007,13(24):3316-3322.
[10] Heinrich M C,Corless C L.Gastric GI stromal tumors(GISTs):the role of surgery in the era of targeted therapy[J].JSurg Oncol,2005,90(3):195-207.
[11]付焱,李恒,金曙,等.双镜联合行胃间质瘤切除术的临床分析[J/CD].中华临床医师杂志:电子版,2012,6(20):6557-6558.
[12] D'Amato G,Steinert D M,McAuliffe JC,et al.Update on the biology and therapy of gastrointestinal stromal tumors[J].Cancer Control,2005,12(1):44-56.
[13] Nguyen SQ,Divino CM,Wang JL,etal.Laparoscopic management of gastrointestinal stromal tumors[J].Surg Endosc,2006,20(5):713-716.
[14]杨平,邓建中,程龙庆,等.双镜联合技术在胃间质瘤切除术中的应用[J].中华腔镜外科杂志,2010,3(2):178-181.
[15]江平,李桂圆.胃肠道间质瘤56例的外科诊疗分析[J/CD].中华临床医师杂志:电子版,2012,6(6):1592-1593.
[16]朱柱.胃间质瘤的CT诊断[J].中国医药科学,2011,1(7):111-112.
[17] Tsujimoto H,Yaguchi Y,Kumano I,et al.Successful gastric submucosal tumor resection using laparoscopic and endoscopic cooperative surgery[J].World JSurg,2012,36(2):327-330.
[18]范西红,张小化,张小桥,等.胃肠间质瘤35例诊治体会[J].中华肿瘤防治杂志,2009,16(9):713-714.
[19]Eisenberg D,Bell R.Intraoperative endoscopy:a requisite tool for laparoscopic resection ofunusualgastrointestinal lesions a case series[J].JSurg Res,2009,155(2):318-320.
Laparoscopes Combined with Electronic Gastroscope in Surgical Treatment of 38 Patients with Gastrointestinal Stromal Tumors
KONG Yan-long,YU Jian-ping,HAN Xiao-peng,ZHUWan-kun,SU Lin,LIU Hong-bin(Department of General Surgery,Lanzhou General Hospital of Lanzhou Military Area Command,Lanzhou 730050,China)
ObjectiveTo explore the feasibility and security of laparoscopes combined with electronic gastroscope in surgical treatment of gastrointestinal stromal tumors(GSTs).MethodsClinical data of38 patientswith GSTs
gastric extraluminalwedge-resection under laparoscopes after intraoperative localization by the electronic gastroscope during August2008 and August2012 was retrospectively analyzed.ResultsOf the38 patients,the average operation time was(82 ±31)min,intraoperative blood losswas(32 ±13)m l,and postoperative hospital stay was(5.8 ±1.6)d.Therewas no complication such as postoperative stoma bleeding,stoma leakage or incision infection.During 6-48 months of follow-up for 35 patients,there was no recurrence.ConclusionLaparoscopes combined with electronic gastroscope in surgical treatment of GSTs is safe with the advantages of accurate location,short operative time and fewer complications.
Laparoscopy;Gastroscopy;Gastrointestinal stromal tumor
R735
A
2095-140X(2014)04-0064-04
10.3969/j.issn.2095-140X.2014.04.018
国家科技部、财政部惠民计划(2012GS620101);甘肃省科技厅科技重大专项资助项目(2010GS04390)
730050兰州,兰州军区兰州总医院普通外科
刘宏斌,E-mail:Liuhongbin999@163.com
2013-12-01 修回时间:2014-01-09)
·论著·
