黄芪用于阻断宫颈癌前病变机制的研究
2014-02-27朱建楠
朱建楠,朱 艳
宫颈癌是仅次于乳腺癌在世界范围内最常见的女性癌症[1]。全球每年女性癌症新发病例中9%为宫颈癌,8%的女性癌症患者死于该病[2]。目前,已经证实70%宫颈癌的发生与两种高危型人乳头瘤病毒 (human papillomavirus,HPV)——HPV16和HPV18持续感染有关[3]。在临床上对于感染HPV的女性尚缺乏有效的干预治疗。黄芪是多年生草本植物,可增强机体免疫力、保护肝脏、抗衰老和抗菌,可用于癌症的治疗[4]。但对于宫颈癌前病变细胞的作用尚缺乏研究报道。本研究以宫颈永生化上皮细胞 (H8)作为宫颈癌前病变的体外实验研究模型,研究不同浓度黄芪注射液抑制增殖和诱导凋亡的机制。
1 材料与方法
1.1 细胞株 H8购自上海拜力生物科技有限公司,用含10%胎牛血清的DMEM/HIGH培养液置于37℃、5%二氧化碳(CO2)的恒温培箱中培养,用0.25%乙二胺四乙酸(EDTA)胰酶消化传代,取对数生长期细胞进行实验。
1.2 药物 黄芪注射液购自神威药业集团有限公司,生产批号:12120342,10 ml/支 (相当于原药材20 g)。
1.3 主要试剂 DMEM/HIGH培养基 (赛默飞世尔生物化学制品有限公司),Bioind优级胎牛血清 (上海创未生物技术有限公司),Bcl-2、Bax抗体 (北京博奥森生物技术有限公司),p53抗体 (美国Proteintech Group公司);流式试剂盒(南京凯基生物科技发展有限公司)。
1.4 仪器 Olympus-LX70倒置显微镜;HEARcel 1150培养箱;超净工作台;中国DNM-9602G酶标分析仪;美国BD公司FACSCalibur流式细胞仪;美国Bio-Rad伯乐043BR119 12半干转印仪;美国Bio-Rad伯乐041BR24044电泳槽;曝光显影系统。
1.5 四甲基偶氮唑盐微量酶反应比色法 (MTT法)检测黄芪注射液对H8的影响 取对数生长期的H8用0.25%胰酶消化后制成单细胞悬液,调整细胞浓度,将细胞悬液接种于96孔板,100 μl/孔,共5组,每组设5个复孔。24 h后,药物处理组分别换以含黄芪终浓度100、200、500、1 000 g/L的培养液孵育,空白对照组以DMEM培养液,药物处理24、48、72 h后,每孔加入5 g/L的MTT 20 μl,继续培养4 h,离心弃孔内上清液,每孔加入二甲基亚砜 (DMSO)150 μl,振荡混匀10 min,使结晶溶解;用自动酶标读数仪在波长为490 nm时测定每孔的光密度值 (即OD值)。细胞抑制率 (%)=(1-实验组OD值/对照组OD值)×100%。
1.6 Annexin V-FITC/PI法检测细胞凋亡率 取对数生长期的H8接种于6孔板,设实验组和空白对照组,实验组收集不同浓度的黄芪注射液处理48 h后的H8,用磷酸盐缓冲液(PBS)洗涤细胞3次 (离心半径13.5 cm,2 000 r/min,5 min),收集细胞于流式管中;加入500 μl的Buffer悬浮细胞;加入Annexin V-FITC和Propidium lodide各5 μl,室温、避光反应5~15 min,流式细胞仪激发波长 (EX)=488 nm,发射波长 (EM)=530 nm测试细胞凋亡。
1.7 Western blotting法检测Bcl-2、Bax及p53的表达 将H8接种于25 cm培养瓶,细胞贴壁后换液,加入黄芪注射液,使其终浓度分别为100、200、500、1 000 g/L。未加药物的为空白对照组。常规收集经不同浓度药物处理48 h的细胞,提取蛋白质后,加入20 μl上样缓冲液。煮沸5 min后,在SDS-聚丙烯酰胺凝胶 (SDS-PAGE)上进行电泳。每孔加入20 μl样品,加适量1×电泳缓冲液,接好正负电极。开始设为90 V恒压,观察marker的移动情况,电泳至分离胶底部时,终止电泳,转移到聚偏氟乙烯 (PVDF)膜上,封闭1 h以上,分别加入1∶400稀释的兔抗人Bcl-2、Bax单克隆抗体和1∶1 000稀释的兔抗人p53单克隆抗体。摇床上4℃杂交过夜。取出PVDF膜,用TBST洗3次,5 min/次。再放入装有1∶5 000稀释的羊抗兔IgG-HRP的15 ml离心管中,摇床上杂交1 h。取出PVDF膜,用TBST洗3次,5 min/次。倒掉洗膜液,吸去多余液体,铺于玻璃板上。将ECL试剂盒内的detection reagent 1与detection reagent 2等体积混合后,均匀滴在PVDF膜上,反应1~2 min。上机检测。
1.8 统计学方法 采用SPSS 17.0统计软件进行统计学处理,计量资料以 ()表示,多组间比较采用单因素方差分析、析因分析,以P<0.05为差异有统计学意义。
2 结果
2.1 黄芪注射液对H8体外的增殖抑制作用 MTT法检测结果显示,不同浓度的黄芪注射液对H8都有一定的抑制作用,且呈时间和浓度的依赖性,各组细胞抑制率比较差异有统计学意义 (F组间=4.782,F时间=5.539,P<0.05,见图1)。
2.2 黄芪注射液对H8凋亡的影响 Annexin V-FITC/PI法检测结果显示,4种浓度的黄芪注射液均可导致细胞的凋亡。经黄芪注射液干预48 h,凋亡率分别为空白对照组 (4.492±1.084)%、100 g/L组 (18.054±1.108)%、200 g/L组(29.368±1.115)%、500 g/L组 (37.090±2.652)%、1 000 g/L组 (54.614±3.052)%,各组间比较差异有统计学意义 (F=3.782,P<0.05,见图2)。
2.3 Western blotting检测Bcl-2、Bax、p53的表达 不同浓度的黄芪注射液 (100、200、500、1 000 g/L)干预48 h后,Bcl-2在空白对照组的表达量最高,在实验组随着药物浓度的增加Bcl-2的表达量逐渐减少。Bax、p53在对照组的表达量最低,在实验组随着药物浓度的增加Bax、p53的表达量逐渐增加 (见图3)。
3 讨论
宫颈癌近几年的发病逐渐呈现了年轻化的趋势,严重影响了女性的健康,其发病是由宫颈癌前病变逐渐衍变而来的。因此,控制癌前病变阶段的发展成为预防宫颈癌的关键。

图1 黄芪注射液对H8的抑制率Figure 1 Inhibition rate on H8 cells with astragalus membranaceus injection
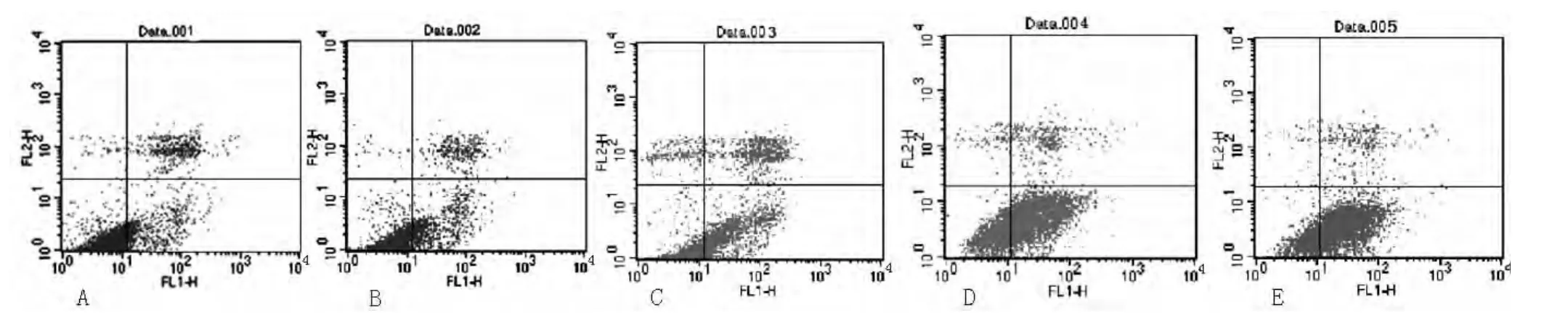
图2 H8经黄芪注射液处理48 h的流式图Figure 2 FCM showed effect of astragalus membranaceus injection on apoptosis of H8 cells after 48 h

图3 Western blotting法检测Bcl-2、Bax、p53的表达Figure 3 Expression of apoptosis related protein Bcl-2,Bax and p53 detected by western blotting
经大量研究证明,宫颈癌的发生与高危型HPV的持续、慢性感染密切相关,其中以HPV16/18型最多见[5]。H8是用含HPV16 E6/E7基因的rAV转染胎儿宫颈上皮细胞获得的,该细胞可以在体外无限传代,但其本身不具有致瘤性。所以该细胞系可以作为宫颈癌前病变的体外研究模型[6-7]。
黄芪在传统医学中的应用已有数千年的历史,相关研究一直受到人们的广泛关注[8-9]。国内外研究表明,黄芪及其提取物的有效成分通过抑制某些肿瘤细胞 (宫颈癌、结肠癌、肺腺癌、子宫内膜癌、肝癌、乳腺癌、胃癌)的增殖和诱导肿瘤细胞的凋亡而具有一定的抗癌作用[10]。本实验通过MTT法检测,结果显示黄芪注射液能够明显抑制H8的体外增殖,并且呈现时间剂量依赖关系。这与樊占兵等[11]的实验结果相似。Annexin V-FITC/PI法检测细胞凋亡表明,H8经不同浓度的黄芪注射液处理48 h后,发生了不同程度的凋亡且随着药物浓度的增加凋亡率逐渐增高。因此表明黄芪注射液可以诱导H8的凋亡。所以可以推测黄芪注射液对H8的体外增殖抑制作用可能与其诱导细胞凋亡有关。Western blotting法检测Bcl-2、Bax、p53表达量表明,随着药物浓度的增加Bcl-2的表达量逐渐减少,Bax、p53的表达量逐渐增加,可以推测黄芪注射液诱导H8的凋亡与Bcl-2的表达量逐渐减少,Bax、p53的表达量逐渐增加有关[12]。这与徐经安等[13]的实验结果相似。但是不同的细胞株对黄芪注射液的敏感度有所不同,这可能与不同细胞株之间的分子生物学差异有关系。
本研究结果可以为临床上感染高危型HPV和宫颈癌前病变的治疗提供一定的理论依据以及为中药防治宫颈癌提供相关的实验基础。同时表明黄芪可以通过抑制细胞生长以及诱发凋亡作为一种防癌药物在临床中得以应用。但是具体是黄芪中的哪种有效成分具有防癌作用还有待于进一步研究和探讨。
1 Ell K,Vourlekis B,Xie B,et al.Cancer treatment adherenceamong low-income women with breast or gynecologic cancer:A randomized controlled trial of patient navigation [J].Cancer,2009,115(19):4606-4015.
2 Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
3 谭训清.HPV与CIN、宫颈癌的关系探讨 [J].中国现代医学杂志,2012,22(5):107-109.
4 顾恪波,孙桂芝.黄芪及其提取物抗恶性肿瘤的研究进展 [J].辽宁中医杂志,2012,39(7):1431-1432.
5 Jin XW,Sikon A,Yen-Lieberman B.Cervical cancer creening:Less testing,smarter testing [J].Cleve Clin J Med,2011,78(11):737-747.
6 汪廷乐,宋萌.人永生化细胞系模型建立的方法[J].上海口腔医学,2010,19(2):212-215.
7 潘镏镏,万小洁,章圣辉,等.鸦胆子油乳对宫颈永生化细胞体外增殖和凋亡的作用[J].中国妇幼保健,2013,28(5):834-837.
8 仝欣.黄芪主要活性成分的药理作用 [J].时珍国医国药,2011,22(5):1246-1249.
9 张国用.中药黄芪的药理作用及其临床应用研究[J].实用心脑肺血管病杂志,2012,20(6):1059.
10 王晓莉,苏志红,李妍芹,等.黄芪对体外培养人宫颈癌Hela细胞的抑制作用 [J].西北国防医学杂志,2010,31(4):270-272.
11 樊占兵,李明,魏双江,等.黄芪注射液对结肠癌SW480细胞的生长抑制作用 [J].中国医药导报,2011,8(18):33-34.
12 耿国军,姜杰,杜好信,等.黄芪对肺腺癌细胞凋亡及Bcl-2、Bax表达的影响 [J].现代肿瘤医学,2011,19(6):1080-1083.
13 徐经安,胡平.黄芪注射液联合顺铂对Hela细胞生长的影响[J].新乡医学院学报,2013,30(3):172-174.
