接种量对单增李斯特菌生长期及生长界面的影响
2014-02-27周小红李学英杨宪时
周小红,李学英,杨宪时,迟 海
(中国水产科学研究院东海水产研究所,上海200090)
接种量对单增李斯特菌生长期及生长界面的影响
周小红,李学英,杨宪时*,迟 海
(中国水产科学研究院东海水产研究所,上海200090)
为了初步了解接种量对单增李斯特菌生长状况及生长/非生长界面的影响,本实验对单增李斯特菌在0、4、10、25℃下通过培养菌液在600nm下的吸光光度值对其生长周期曲线分别进行了测定,并分析了不同接种量的单增李斯特菌菌液在25℃下的生长周期状况,探讨了纯培养条件下不同盐度和pH下,接种量对单增李斯特菌生长/非生长状况的影响。结果表明:不同的温度下,单增李斯特菌的生长周期有很大的差别;而在相同温度下,接种量对单增李斯特菌的生长周期有较大的影响,随着接种水平的降低,菌种生长所需的延滞时间越长,接种量为107CFU/mL时,其生长延滞期为0~4h,而当接种量减少为10CFU/mL时,其生长延滞期为0~16h;而对于单增李斯特菌的生长/非生长界面而言,接种量对其也有一定的影响,但其作用机制还有待进一步深入的研究。
单增李斯特菌,接种量,生长期,生长界面
单核细胞增生性李斯特菌(Listeria monocytogenes,简称单增李斯特菌,LM)是目前国际公认的重要食源性病原菌之一,曾多次引起食物中毒事件,临床死亡率高达20%~70%,WTO将其列为四大食源性致病菌之一[1-2]。它是一种人畜共患的致病菌,能引起人类脑膜炎、败血症等疾病,尤其对孕妇、新生儿、老年人以及免疫功能缺陷者具有较高的感染风险[3]。虽然发病率不高,但致死率(20%~30%)[4]远高于其他常见食源性病原菌。虽然在国内基本还没有爆发由单增李斯特菌引起的严重中毒事件,但在国外时有此类相关报道,所以引起了广泛的关注和重视,国外对单增李斯特菌的研究也较多,但是有关接种量对单增李斯特菌生长状况的影响还相当有限,所以本文旨在探讨接种量对单增李斯特菌生长及生长/非生长状况的影响,以期为进一步建立单增李斯特菌在纯培养和实际产品中的生长/非生长模型奠定基础和提供参考依据。本文在0、4、10、25℃温度下通过菌液的OD600值对单增斯特菌的生长周期进行了测定,分析了不同接种量菌液在25℃下的生长周期状况,并探讨了纯培养条件下不同盐度和pH下,接种量对单增增李斯特菌生长/非生长状况的影响。旨在进一步建立纯培养条件下不同接种量下单增李斯特菌在不同温度、盐度和pH下的生长/非生长界面模型,为实际产品中单增李斯特菌生长/非生长模型的建立提供参考依据,预测和控制单增李斯特菌在食品中的污染。
1 材料与方法
1.1 材料与仪器
实验菌种单核细胞增生李斯特菌(LM 54001) 购自中国药品生物制品研究所;含0.6%酵母浸膏的胰酪胨大豆肉汤(TSB-YE),含0.6%酵母浸膏的胰酪胨大豆琼脂(TSA-YE)、脑心浸液(BHI) 北京陆桥技术有限公司;邻苯二甲酸氢钾、硼砂、磷酸氢二钠、氢氧化钠、盐酸等化学试剂(AR) 国药集团化学试剂上海分公司。
ESCO CA2-4A1型操作安全柜 上海生叉仪器有限公司;YXQ-LS-50SII型全自动立式压力蒸汽灭菌锅 上海博讯实业有限公司;Sanyo M IR 150、153型恒温培养箱 日本三洋科研设备公司;721型可见光分光光度计 上海菁华科技仪器有限公司数显;Sanyo M IR 253、553高精度低温培养箱 日本三洋科研设备公司;pHS-3C型数显酸度计 上海伟业仪器厂;SA-960-II SHJ-系列净化工作台 上海净化设备厂;LabMASTER-aw型水分活度仪 瑞士Novasina公司;Power wave XS型酶标仪 美国Bioteck公司。
1.2 实验方法
1.2.1 菌悬液的准备 菌株采取斜面低温保藏法于4℃冰箱中保藏[5]。每月移种一次,实验前用无菌接种环挑取一至两环加入无菌TSB-YE液体培养基中,37℃下培养至菌液浓度达到108CFU/m L[6-7],以作为菌悬液备用。
1.2.2 单增李斯特菌在不同温度和接种量下生长周期的测定 选择0、4、10、25℃四个温度,参照PMP数据库的相关数据,通过分光光度计测定培养菌液的OD600值,分别对单增李斯特菌在该几个温度下的生长周期进行测定;取灭菌后的TSB-YE培养基无菌操作移取到灭菌的96孔板里,每个小孔分装200μL,分别做四个平行[8]。将菌悬液分别稀释到10、103、105、107CFU/m L数量级,分别吸取50μL到上述的小孔中,然后滴加50μL的无菌石蜡油并盖上无菌塑料盖,置于25℃恒温箱中培养[9-10],每两小时取出培养板放入微孔板扫描分光光度计中读取各孔在光波波长600nm下的OD值。
1.2.3 不同接种量下单增李斯特菌生长/非生长的测定 基于前期实验的单因素实验[11]以及一些相关参考文献,选择温度25℃,盐度分别为0.5%、2.5%、4.5%、6.5%、8.5%,pH分别为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5,在接种量分别为10、103、105、107C FU/m L四个水平下对单增李斯特菌的生长与非生长状况进行了部分因子实验。根据实验设计,配制TSB-YE液体培养基,调节其盐度、pH到各实验所需的条件下,然后将各培养基分装到各个试管中,121℃下灭菌20m in。将菌悬液分别以10倍梯度稀释到10、103、105、107CFU/m L的接种水平,单增李斯特菌的初始接种量通过涂布TSA-YE平板计算得到。各试管振荡混匀后放入相应温度的恒温培养箱,根据前期的实验结果,每组实验做两个平行,培养结束后观察各试管的混浊度。
1.2.4 单增李斯特菌生长/非生长的判定方法 如果试管中菌液混浊度明显,则判定其生长,并记为1;对于菌液混浊度不明显或者有质疑的试管,则对该试管进行涂布确认,并将菌种培养48h后的菌落总数与初始接种菌数进行比较,如果最终的菌量比初始接种量多于0.5lg CFU/m L[12],则判定单增李斯特菌生长,并记为1,否则记为0。对于实验结果与预测结果有偏差的实验数据,按上述方法再次进行重新测定确认,如果还是与预测结果不符,则作为异常点保留。
2 结果与分析
2.1 各温度下单增李斯特菌的生长曲线
如图1所示,图(a)、(b)、(c)、(d)分别表示单增李斯特菌在0、4、10、25℃下的生长周期曲线,单增李斯菌在该四个温度下的生长稳定期分别为12~20d、12~18d、6~8d、20~24h,由此可以看出,菌种在不同的温度下其生长周期是不同的,一般温度越低,生长所需的时间越长。所以在后期实验中,可分别选择不同温度下单增李斯特菌对应的生长稳定期作为菌液的培养时间。
温度作为影响微生物生长最直接的因素之一,对菌种的生长有较大的影响,因此在实际产品贮藏过程中,可以适当提高和降低贮藏温度,再结合其他生长控制条件来控制菌种的生长。
2.2 不同接种量下单增李斯特菌的生长曲线
如图2所示,接种量1、接种量2、接种量3、接种量4分别对应单增李斯特菌的菌液接种浓度为107、105、103、10CFU/m L,由图2可以看出,4条生长曲线中,接种的菌液浓度越高,菌种对应的生长延滞期越短。接种量为107CFU/m L的时候,其生长延滞期为0~4h;接种量为105CFU/m L的时候,其生长延滞期为0~8h;接种量为103CFU/m L的时候,其生长延滞期为0~14h;接种量为10CFU/m L的时候,其生长延滞期为0~16h。由此可以得出,接种量对于单增李斯特菌的生长周期有很大的影响。
接种量不同的情况下,单增李斯特菌生长的延滞时间的差别,可针对实际产品中微生物污染率的不同,预测其致病性和食品的安全性。与腐败菌达到一定数量食品才会出现问题不同,致病菌处于任何生长期就有引起中毒的潜在危险,因此对于含有潜在致病菌和产毒素菌株的食品来说,描述接种量对其生长/非生长情况具有重要的意义。
2.3 不同接种量下单增李斯特菌的生长/非生长状况
由表1~表4可看出,在温度为25℃的环境下,当培养基的pH≤4.5时,在盐度为0.5%~8.5%的范围内,接种量为10、103、105、107CFU/m L的菌液均不生长;当培养基的pH≥6.0时,在盐度为0.5%~8.5%的范围内,接种量为10、103、105、107CFU/m L的菌液均生长,即pH≥6.0时,盐度和接种量对单增李斯特菌的生长基本没什么影响;而当4.5≤pH<6.0时,菌液的浓度低于105CFU/m L时,例如接种浓度分别为10、103CFU/m L时,接种量为10CFU/m L的菌液对盐度和酸度的耐受性反而高于接种量为103CFU/m L的菌液,当接种菌液浓度为105CFU/m L和107CFU/m L,单增李斯特菌的生长与非生长状况基本没什么差异;而接种量为103CFU/m L和105CFU/m L作比较,可以看出菌液接种浓度越高,单增李斯特菌对盐度和酸度的耐受性越强。

图1 单增李斯特菌在0、4、10、25℃下的生长曲线Fig.1 Growth curve of Liseriamonocytogenes under 0,4,10,25℃
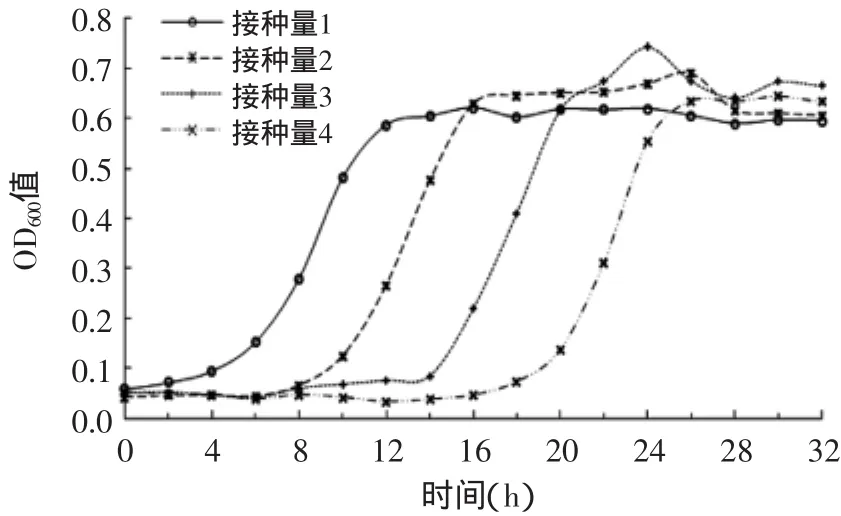
图2 25℃下单增李斯特菌在接种量10、103、105、107CFU/mL下的生长曲线Fig 2 Growth curve of Liseriamonocytogenes under 25℃with inoculation level of 10,103,105,107CFU/mL
表1 25℃环境下单增李斯特菌在接种量为10CFU/mL下的生长/非生长状况Table 1 Growth and no growth state of Liseriamonocytogenes under 25℃with inoculation level of 10CFU/mL
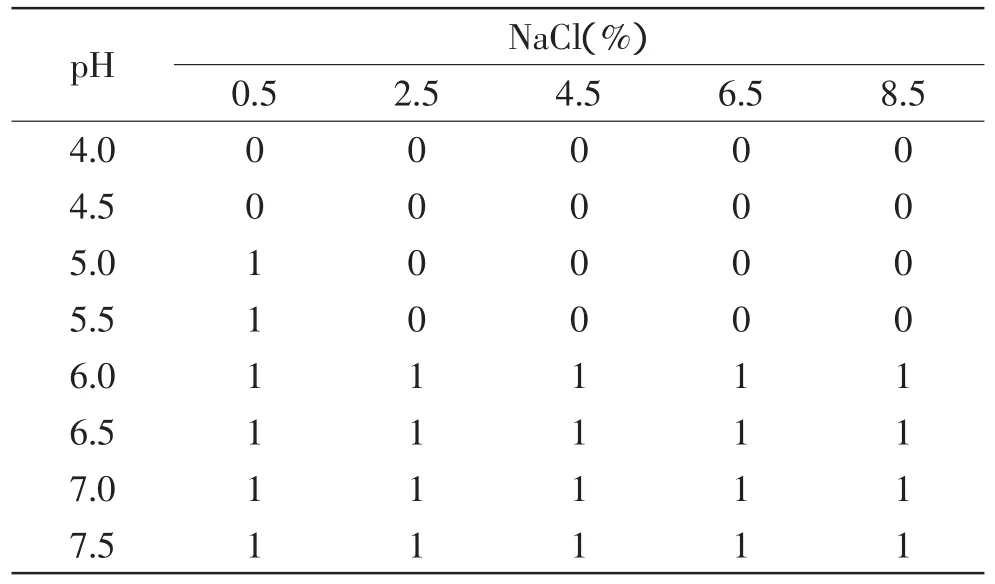
表2 25℃环境下单增李斯特菌在接种量为103CFU/mL下的生长/非生长状况Table 2 Growth and no growth state of Lismonocytogenes under 25℃with inoculation level of 103CFU/mL
单增李斯特菌作为一种重要的食源性致病菌,国内外学者对其生长及生长动力学模型做了大量的研究,虽然在研究其微生物生长动力学中很少将接种量作为影响因子,但是有研究表明它可能对微生物的生长产生影响。Baranyi[13]、Baranyi和Pin[14]在其研究中表明随着接种的细胞数的减少,接种水平达到102~103细胞数的菌液生长延滞期延长[15]。最新研究也表明接种量对于微生物开始能够生长这种能力具有的重要性,Robinson等的报道中指出单增李斯特菌开始生长所需的细胞数在理想生长条件下为1CFU/m L,在1.8mol/L浓度的NaCl作用下增加到105CFU/m L,类似的结论在降低pH和增加化学抗菌剂浓度的研究中也有报道[16-17]。因此本实验为了进一步了解和证实接种量对单增李斯特菌生长的影响,对其在10、103、105、107CFU/m L接种水平下的生长周期和生长/非生长状况做了研究。
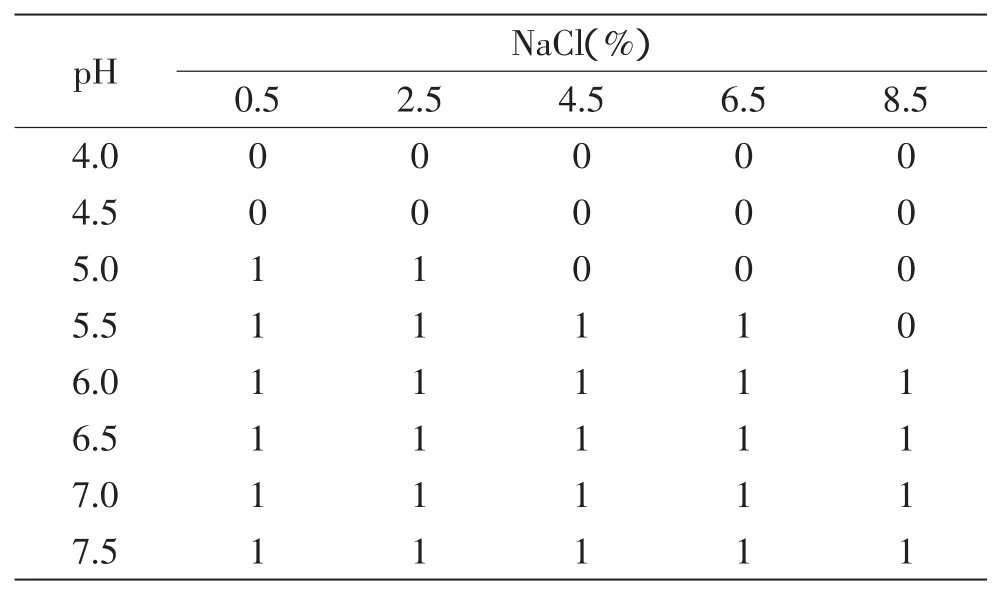
表3 25℃环境下单增李斯特菌在接种量为105CFU/mL下的生长/非生长状况Table 3 Growth and no growth state of Liseriamonocytogenes under 25℃with inoculation level of 105CFU/mL
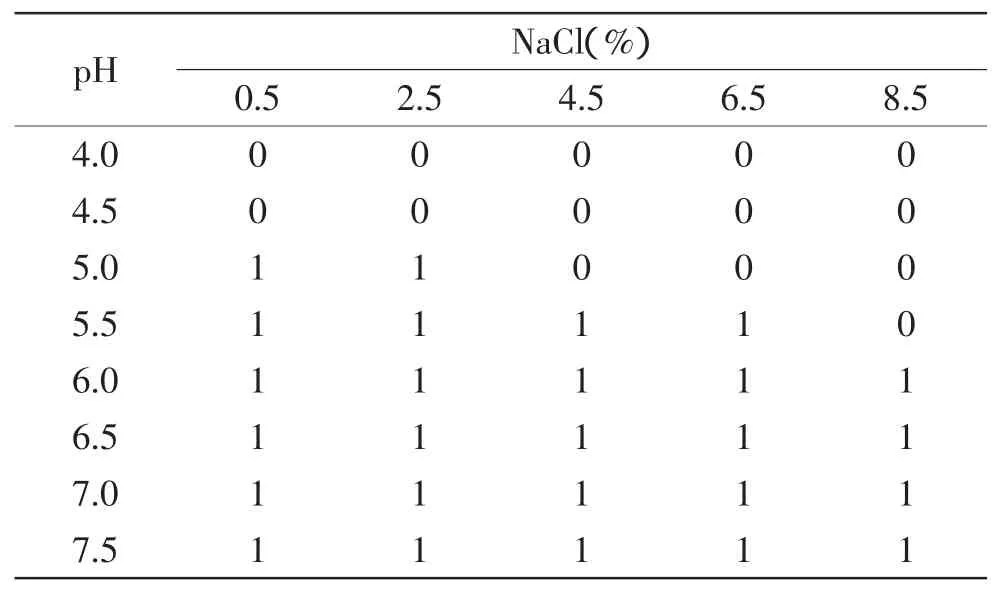
表4 25℃环境下单增李斯特菌在接种量为107CFU/mL下的生长/非生长状况Table 4 Growth and no growth state of Liseriamonocytogenes under 25℃with inoculation level of 107CFU/mL
本实验先对单增李斯特菌在0、4、10、25℃下的生长曲线进行了测定,是为下一步生长与非生长模型的建立过程中各温度所需的培养时间提供一定的参考依据。另外接种量对单增李斯特菌生长期和生长/非生长状况的影响,通过实验得出结论,接种量对单增李斯特菌的生长周期有显著的影响,随着接种水平的降低,菌种生长所需的延滞时间越长,接种量为107CFU/m L时,其生长延滞期为0~4h,而当接种量减少为10CFU/m L时,其生长延滞期为0~16h;而对于单增李斯特菌的生长/非生长而言,接种量对其可能有一定的影响,当接种菌液浓度较低时,如10CFU/m L和103CFU/m L时,接种量低的菌液对环境的耐受性反而强于接种量高的菌液,这有可能受菌与菌之间的相互竞争影响,而当接种菌液浓度达到一定值时,接种量对其生长/非生长基本没有什么影响,如105CFU/m L和107CFU/m L接种量时,单增李斯特菌的生长与非生长状况基本没什么差异,而将接种量为103CFU/m L和105CFU/m L作比较,又得出菌液接种浓度越高,单增李斯特菌对盐度和酸度的耐受性越强,但差异也不是很明显,所以接种量对于微生物的生长与非生长界面可能有一定的影响,但其作用机制还有待进一步深入的研究。
3 结论
实验表明温度不同,单增李斯特菌的生长周期有很大的差别,温度越低,延滞期的时间越长,这对于不同温度下确定微生物的致病性具有一定的参考意义;而在相同温度下,接种量对单增李斯特菌的生长周期有较大的影响,随着接种水平的降低,菌种生长所需的延滞时间越长,接种量为107CFU/m L时,其生长延滞期为0~4h,而当接种量减少为10CFU/m L时,其生长延滞期为0~16h,所以可以预测在实际产品中,致病菌的污染率不一样,其致病性也会有一些差别;而对于单增李斯特菌的生长/非生长界面而言,接种量对其也有一定的影响,但其在纯培养条件下波动性较大,变化趋势不是特别有规律,其作用机制还有待进一步深入的研究,而且在实际产品中其生长/非生长界面情况还会更复杂,所以需要更进一步的研究和探索。
[1]沈晓盛,郑国兴,李庆,等.食品中单核细胞增生李斯特菌的危害及其检测[J].食品与发酵工业,2004,30(8):87-91.
[2]马瑜丹.单核细胞增生李斯特菌菌膜形成突变株的筛选[D].上海:上海交通大学,2008.
[3]Mook P,O Brien SJ,Gillespie IA.Concurrent conditions and human Listeriosis,England,1999-2009[J].Emerging Infectious Diseases,2011,17(1):38-43.
[4]白艳红,成亚宁,王玉芬,等.我国低温肉制品研发现状与发展[J].肉类工业,2005(1):285-287.
[5]吕红线,郭利美.工业微生物菌种的保藏方法[J].山东轻工业学院学报,2007,21(1):52-55.
[6]刘柳,孙保华.温度及气调包装对冷却猪肉中单核细胞增生性李斯特菌生长的影响[J].食品科学,2008,29(1):334-337.
[7]李燕杰,朱小花,阴冠秀,等.不同方法观察单增李斯特菌生物被摸的比较研究[J].食品工业科技,2010,31(10):241-246.
[8]StewartCM,Cole M B,Legan JD,etal.Staphylococcusaureus growth boundaries:Moving towardsmechanistic predictivemodels based on solute-specific effects[J].Applied and Environment Microbiology,2002,68(4):1864-1871.
[9]Valero A,Pérez-Rodríguez F,Carrasco E,et al.Modelling the growth boundaries of Staphylococcus aureus:Effect of temperature,pH and water activity[J].International Journal of Food Microbiology,2009,133(1):186-194.
[10]Konstantionsp K,Patricia A K,John NS,etal.A comparative study on growth limits of Listeria monocytogenes affected by temperature,pH and aw when grown in suspension or on a solid surface[J].International Journal of Food Microbiology,2004,21(4):415-422.
[11]周小红,李学英,杨宪时,等.培养条件对单增李斯特菌生长的影响[J].食品工业科技,2013,34(15):140-148.
[12]Skandamis PN,Stopforth JD,Kendall P A,et al.Modeling the effect of inoculum size and acid adaptation on growth/no growth interface of Escherichia coli O157∶H7[J].International Journal of Food Microbiology,2007,120(3):237-249.
[13]Baranyi J.Comparison of stochastic and deterministic concepts of bacterial lag[J].Journal of Theoretical Biology,2008,192:403-408.
[14]Baranyi J,Pin C.Estimating bacterial growth parametersby means of detection times[J].Applied and Environmental Microbiology,2006,65:732-736.
[15]Konstantinos P Koutsoumanis,John N Sofos.Effect of inoculum size on the combined temperature,pH and aw limits for growth of Listeria monocytogenes[J].International Journal of Food Microbiology,2005,104:83-91.
[16]McClure P J,Roberts T A,Oguru PO.Comparison of the effects of sodium chloride,pH and temperature on the growth of Listeriamonocytogenes on gradient plates and in liquid medium [J].Letters in Applied Microbiology,2001,28:216-220.
[17]McKellar R C.A heterogeneous population model for the analysis of bacteria growth kinetics[J].International Journal of Food Microbiology,2003,36:179-186.
Effect of inoculum size on grow th phase and grow th interface of Listeria monocytogenes under different cultural conditions
ZHOU Xiao-hong,LIXue-ying,YANG Xian-shi*,CHIHai
(East China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Shanghai200090,China)
To p relim inary understanding the influence of inoculation levelon g row th/no g row th interface of Listeria monocytogenes,the experiment was carried on 0,4,10,25℃under 600nm absorp tion values to determ ine its grow th phase by its turbid ity of bacteria liquid respec tively,and the g row th state of Listeria monocytogenes in different inoculum size under 25℃ was analyzed,and the effect of inoculation level on grow th/no grow th interface of Listeriamonocytogenes under pure cultivation combined w ith d ifferentsalinity and pH was d iscussed. The results showed that there was a big difference among the g row th of Listeria monocytogenes under different tem peratures.And at the same tem perature,inoculation level had a great influence on the g row th of Listeria monocytogenes.With the decrease of inoculation level,the lag phase required for bac terial g row th was p rolonged.When the inoculation level was 107CFU/m L,its lag phase was 0~4h.However,its lag phase increased to 0~16h when the inoculation level reduced to 10CFU/m L In term s of grow th/no grow th of Listeria monocytogenes,inoculum size also had certain influence on its interface,but the mechanism requires further specific studies.
Listeriamonocytogenes;inoculum size;grow th phase;g row th interface
TS201.3
A
1002-0306(2014)18-0180-05
10.13386/j.issn1002-0306.2014.18.030
2013-11-20 *通讯联系人
周小红(1988-),女,硕士研究生,研究方向:食品科学与工程。
农业部引进国际先进农业科学技术项目(2011-Z12)。
